pH 响应型毒死蜱水凝胶体系的构建及其缓释性能
2022-06-14查显艳侯雪娟
查显艳, 侯雪娟, 南 慧, 田 江
(湘潭大学 环境与资源学院,湖南 湘潭 411105)
提高传统农药在环境中的稳定性是提高农药利用率的有效措施。近年来,快速发展的农药缓控释系统 (controlled release systems,CRS)是通过感知外部环境,如pH 值、光照、温度等的变化,在特定环境下作出刺激响应,从而引起其物理化学特性和功能状态发生转变,以此获得农药的控制释放特性的响应性聚合物[1]。该体系能够有效降低光、水、热、pH 值及酶等环境因素对农药分子的分解,提高农药有效成分的稳定性和持效期,减少农药流失,从而提高农药利用率[2]。根据外界刺激响应方式的不同,可将刺激响应性聚合物分为温度响应型聚合物[3]、pH 值响应型聚合物[4]及酶响应型聚合物[5]等。
pH 值响应型聚合物,如聚丙烯酸、聚乙烯吡啶和海藻酸钙 (CA) 等,存在一些可离子化的酸性或碱性基团 (如 −COOH、−NH2、−NHR、−NR2),当环境介质中的pH 值发生变化时能够接受或者给出质子[6]。海藻酸钠 (SA) 中含有大量的 −COO−,在水溶液中可表现出聚阴离子行为。当有Ca2+存在时,其G 单元上的Na+与Ca2+即可发生离子交换反应,形成“蛋壳式”的交联网络结构,即聚阴离子型pH 敏感水凝胶海藻酸钙 (CA)。当pH 值较低时,水凝胶中羧基以 −COOH形式存在,离解度低,凝胶溶胀率低,体积收缩;但随着pH 值升高,−COOH 离解度增大,大部分羧基转变成 −COO−,静电斥力增加,溶胀率急剧增大,释放出原药分子[7](如图1 所示)。利用海藻酸钙水凝胶的pH 响应特性来作为载体运输药物,可使其在人体微环境中不同的pH 值下达到靶向释药的目的[8]。近来已有相关研究将该载体用于农药的控制释放[9],且因其具有价格低廉、生物降解性好的特点,作为pH 控释农药的包覆材料拥有广阔的应用前景[10]。

图1 海藻酸钙水凝胶在不同pH 值的缓冲溶液中分子链变化示意图Fig. 1 Schematic diagram of molecular chain changes of calcium alginate hydrogels in buffer solutions with different pH values
但海藻酸钙水凝胶存在表面孔洞较大、机械强度不高以及药物容易“突释”的局限性[11],可以通过在凝胶体系中加入黏土,如高岭土[12]、膨润土[13]、凹凸棒[14]等无机物,通过与其进行共混改性形成聚合物/黏土复合材料,并使用多巴胺 (dopamine)修饰凹凸棒,以提供酚羟基和氨基。凹凸棒、海泡石、伊利石和蒙脱石是4 种常见层链状结构的含水富镁铝硅酸盐黏土矿物[12],均具有比表面积大、离子交换性强、对有机物的吸附性大以及对环境无毒、无危害的特点[15]。毒死蜱属于有机磷农药,具有广谱杀虫性,在农业生产上应用广泛[16],但毒死蜱在外界环境中不稳定,易受到光、热等的影响导致过早降解[17],故本研究选择其为模型药物。先对4 种黏土矿物 (凹凸棒、蒙脱石、伊利石、海泡石) 进行酸化处理,然后使用多巴胺进行修饰。由于前期研究表明,4 种矿物负载毒死蜱后,负载率最高的是凹凸棒,故用它作为载体,制备了多巴胺改性凹凸棒/毒死蜱/海藻酸钙复合水凝胶 (PRCH),继而探索PRCH 在不同pH 环境下的特定响应以及对毒死蜱的控制释放性能和缓释机制,并在紫外光和不同温度条件下测试水凝胶的稳定性。
1 材料与方法
1.1 供试材料、药剂、试剂及设备
海泡石 (sepiolite,200 目,筛孔径75 μm) (上海麦克林生化有限公司);伊利石 (illite, 800 目,筛孔径18 μm) 、蒙脱石 (montmorillonite,800目,筛孔径18 μm) 、凹凸棒 (attapulgite, 400 目,筛孔径38 μm) (鼎邦矿产品科技公司);
97%毒死蜱 (chlorpyrifos, 以下简称CPF) 标准品 (成都麦卡希化学有限公司)。盐酸多巴胺(dopamine) 和海藻酸钠 (SA) (上海麦克林生化有限公司);无水氯化钙 (天津科密欧化学试剂有限公司);三羟基氨基甲烷盐酸盐(Tris-HCl) (酷尔化学科学技术 (北京) 有限公司);吐温-20 (国药集团化学试剂有限公司);磷酸盐缓冲溶液(PBS):磷酸氢二钠、磷酸二氢钾、氯化钠和氯化钾 (天津科密欧化学试剂有限公司)。
DF-101S 磁力搅拌器(金坛区华城兴万仪器经营部);蔡司Sigma 300 扫描电子显微镜(上海百贺仪器科技有限公司);Zetasizer Nano series 纳米粒度ζ电位分析仪(马尔文仪器公司 (中国));Quantachrome Novawin BET 比表面积测试仪(康塔克默仪器贸易 (上海) 有限公司);UV2300 紫外可见光分光光度计(安捷伦科技 (中国) 有限公司);ALPHA 傅里叶变换红外光谱仪(布鲁克科技有限公司)。
1.2 多巴胺改性凹凸棒/毒死蜱/海藻酸钙复合水凝胶的制备
1.2.1 酸化处理 分别称取海泡石、伊利石、蒙脱石和凹凸棒4 种黏土矿物10 g,分散于150 mL 2 mol/L 的盐酸溶液中,室温下磁力搅拌4 h 后水洗至无氯离子。过滤,将所得样品冷冻干燥12 h,得到每种材料约9.5 g 淡黄色粉末,装袋备用。
1.2.2 多巴胺修饰矿物 将酸化后的矿物3 g 置于150 mL Tris-HCl (10 mmol/L) 缓冲溶液中,磁力搅拌 (500 r/min) 30 min,加入0.3 g 多巴胺,黑暗条件下搅拌12 h,离心 (4000 r/min, 10 min) 并用去离子水洗涤3 次。收集黑色沉淀,冷冻干燥12 h,得到多巴胺修饰的凹凸棒、伊利石、蒙脱石和海泡石各约2.7 g,分别标记为PA、PI、PM 和PS。
1.2.3 装载毒死蜱 分别称取PA、PI、PM 和PS 1.5 g,分散在毒死蜱乙醇溶液 (15 mL,20 mg/mL)中,于室温下振荡12 h,过滤,用少量乙醇洗涤2 次,真空冷冻干燥,分别得到PA-CPF、PICPF、PM-CPF 和PS-CPF。准确测量滤液体积,用紫外分光光度计测量滤液中毒死蜱的余量 (每个样品设置3 个平行),对比4 种黏土矿物的负载效果,挑选负载效果最好的黏土矿物。
1.2.4 pH 响应型水凝胶的制备 取PA-CPF 样品1 g 分散于30 mL 去离子水中,加入0.25 g 海藻酸钠,置于旋涡振荡器中均匀分散,用吸入注射器(体积 = 5 mL,针头直径 = 0.7 mm) 滴加至氯化钙溶液中 (100 mL,0.1 moL/L),滴毕,静置30 min。弃去氯化钙水溶液,用去离子水清洗3 次,经 −45 ℃冷冻干燥24 h 得到多巴胺改性凹凸棒/毒死蜱/海藻酸钙复合水凝胶 (PRCH)。图2 为PRCH 的制备流程图。
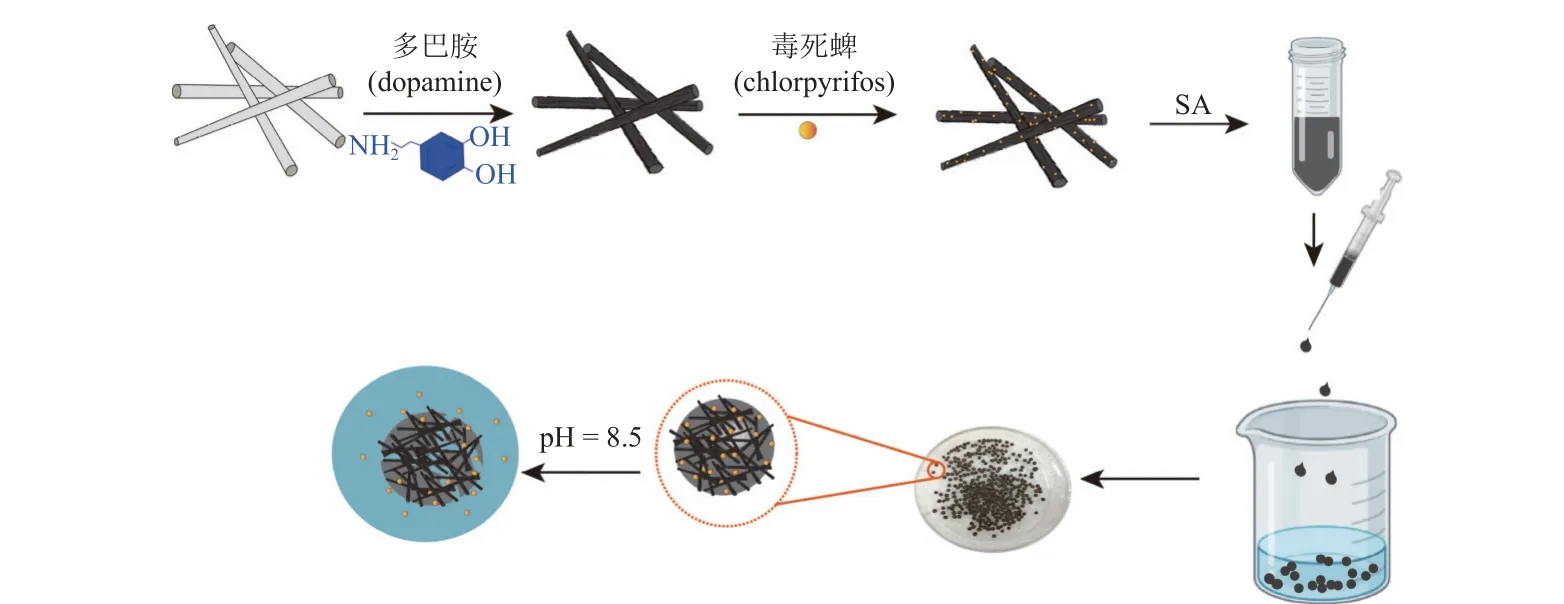
图2 海藻酸钙复合水凝胶制备流程图Fig. 2 Schematic diagram of the preparation process of calcium alginate composite hydrogels
1.3 材料表征
利用扫描电子显微镜观察材料表面的微观形貌特征,采用ζ-电位、BET 比表面积测试和傅里叶红外光谱仪分析材料的结构变化。
1.4 溶胀率的测定
针对农药在喷施环境中可能遇到的pH 值范围,选择在pH = 5.5、7.0 和8.5 的3 种磷酸盐缓冲溶液中测定水凝胶的溶胀规律。预先称取0.1 g PRCH,浸泡在20 mL 缓冲液中,在适当的时间间隔将水凝胶取出,用滤纸吸掉多余的水后称量质量。所有样品设置3 个平行,用 (1) 式计算水凝胶的动态质量变化[18]。

式中,SR为溶胀率 (swelling rate),m1、m2分别为吸水溶胀前后水凝胶的质量,g。
1.5 水凝胶的控释性能测定
分别称取0.2 g PRCH 于20 mL 磷酸盐缓冲溶液中 (pH = 5.5、7.0 和8.5),添加1.0 g/L 的吐温-20 。室温条件下静置,每隔一段时间取出2 mL上清液,用紫外分光光度计在最大吸收波长292 nm处测定溶液的吸光度,计算毒死蜱浓度。取出上清液的同时加入2 mL 对应pH的缓冲溶液,以确保释放环境总体积保持不变 (所有样品设置3 个平行)。用累积释放率 (controlled release rate,CR) 表征控释效果,按 (2) 式计算[19]。
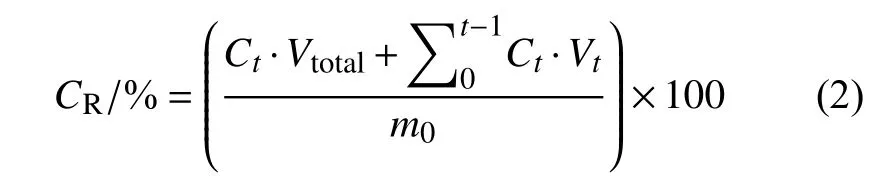
式中:CR为累积释放率;Vtotal表示PBST 的体积 (20 mL);Ct表示t时刻的样品浓度;Vt表示取样体积,mL;m0表示负载质量,mg。
1.6 释放动力学模型
根据不同pH 条件下农药释放相关数据,采用Korsmeyer-Peppas 方程进行拟合,研究不同条件下毒死蜱的释放机理。其模型表达式如(3)式[20]:

其中Mt/M∞表示t时刻毒死蜱的释放率,K为释药模型特征常数,n为释放机理的特性指数,其值决定着扩散类型。当n< 0.43 时,属于Case-I类Fickian 传输机制;当0.43
1.7 紫外稳定性和温度稳定性测试
取0.1 g 毒死蜱标准品和PRCH 于20 mL 乙醇溶液中,使样品质量浓度为5 mg/mL,置于暗室,其上方20 cm 处悬挂紫外灯 (16 W),进行抗紫外性能试验。同时,在20 mL 乙醇溶液中分别加入0.1 g CPF 和PRCH,置于5、25、45 ℃的培养箱中进行温度稳定性试验,每个样品设置3 个平行。在适当时间间隔点取出2 mL 上清液,用紫外分光光度计测定溶液的吸光度,并且向所取样品中加入等体积乙醇,保持总体积不变。毒死蜱残留率 (remaining rate,RR)[21]由式(4) 确定,PRCH 中农药的残留率用总量减去累积释放率,见式(5)。
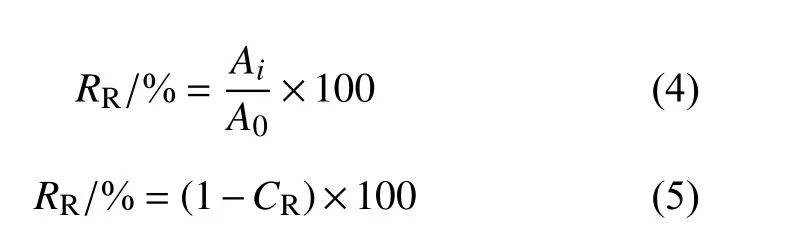
式中:A0为毒死蜱溶液中的原始质量浓度,mg/L;Ai为i时刻时溶液中剩余毒死蜱的质量浓度,mg/L。
2 结果与分析
2.1 复合水凝胶的制备
分别采用凹凸棒、海泡石、伊利石和蒙脱石负载毒死蜱,对比其负载效率。结果 (表1) 表明,凹凸棒对毒死蜱的负载率 (67.6%) 远大于其他3 种黏土,同时鉴于已有研究表明,酸化处理能去除凹凸棒孔道中的杂质,使孔道疏通,增加比表面积[22],因此本研究选择酸化处理后的凹凸棒作为后续研究的载体。

表1 不同黏土矿物装载毒死蜱的能力Table 1 Chlorpyrifos loading capacity of different clay minerals
本研究结果 (图3) 表明,酸化后的凹凸棒对农药的负载率有了明显提升。鉴于已有研究表明,多巴胺在碱性环境下能自发形成黏附聚多巴胺 (polydopamine, PDA) 涂层,可以沉积在黏土矿物表面,自组装成单体层,聚多巴胺结构中的酚羟基和氨基可以通过配位、氢键、π-π 堆积等多种作用与其他物质结合[23],因此本研究选择酸化后的凹凸棒采用多巴胺修饰,再负载上毒死蜱。

图3 经酸化 (HCl-ATP) 和未经酸化的凹凸棒 (ATP) 对20 g/L 毒死蜱的负载能力Fig. 3 Load capacity of acidified (HCl-ATP) and unacidified attapulgite (ATP) with 20 g/L chlorpyrifos
多巴胺修饰后的酸化凹凸棒对20、5、1 g/L的毒死蜱的负载率,如图4 所示。其中,其对5 g/L的毒死蜱负载率最高,为85%。

图4 经多巴胺修饰后的酸化凹凸棒对20、5 和1 g/L毒死蜱的负载率Fig. 4 Load capacity of acidified attapulgite loaded with 20, 5 and 1 g/L CPF
2.2 PRCH 的形貌和结构分析
2.2.1 SEM 形貌表征 扫描电镜结果 (图5) 显示:凹凸棒 (图5a) 为纳米级的棒状结构,大小较为均一,长度为500~1000 nm,粒径约为几十纳米。具有微纳尺寸的凹凸棒能形成网络结构,有利于将农药分子锁在其中。经过酸化处理后 (图5b),由于盐酸溶解了部分有机物或碳酸盐杂质,使凹凸棒内部结构变得疏松多孔,棒状结构也变得更加清晰和分散,形成较多的架空孔洞,增加了比表面积。由多巴胺修饰之后的凹凸棒更加疏松,表面更加粗糙(图5c)。负载毒死蜱后,凹凸棒结构并无明显变化 (图5d)。海藻酸钙水凝胶是以海藻酸钠和氯化钙为交联体系的,其粒径取决于液滴的大小,图 (5e,5f) 为干燥后的水凝胶实物及表面图,其形状规整,大小均一,直径在2.5 mm左右。在经过冷冻干燥后球体表面大量失水,呈现出不同程度的塌陷和褶皱。将球剖开观察其横截面,发现球内部为多孔疏松的层状结构 (图5g,5h 和5i),且出现很多微小的孔,这可能是因为交联反应中包裹在水凝胶中的水分蒸发导致[14]。

图5 (a) 凹凸棒 (ATP) 、 (b) 酸化凹凸棒 (HCl-ATP) 、 (c) 多巴胺修饰的凹凸棒 (PA) 、 (d) 负载毒死蜱的多巴胺修饰凹凸棒 (PA-CPF)、(e-f) PRCH 和(g-i) PRCH 截面的扫描电镜图Fig. 5 SEM of (a) attapulgite (ATP), (b) acidified attapulgite (HCl-ATP), (c) dopamine-modified attapulgite (PA),(d) dopamine-modified attapulgite located on chlorpyrifos (PA-CPF), (e-f) PRCH, (g-i) PRCH cross sections
2.2.2 BET 比表面积测试 通过BET 比表面积测试仪测定样品的比表面积和孔径分布情况,如图6a 所示:凹凸棒的吸附-脱附曲线表现出一个明显的迟滞环。根据国际纯粹与应用化学联合会(IUPAC)报告分类可知[24],该曲线属于Ⅳ型吸附类型,回滞环属于H3 型,表明凹凸棒具有明显的介孔结构。类似地,酸化凹凸棒 (HCl-ATP)、多巴胺修饰的凹凸棒 (PA)、负载上毒死蜱的PA (PACPF) 和PRCH 也具有介孔的结构特点。如图6b、6c 所示,凹凸棒经酸化后比表面积增加了23.5%,孔容积增加了41.3%,这是因为凹凸棒经酸化处理后纤维束解离,部分阳离子溶解从而使得凹凸棒孔道对外开放,导致比表面积显著增加,孔容增大[25]。多巴胺在碱性条件下发生氧化聚合交联反应,生成的聚多巴胺能够包裹在凹凸棒表面形成均匀的膜层,从而使其粒径变大,比表面积和孔容积减小,但是平均孔半径反而有所增大。在负载上CPF 后,PA 的比表面积从130.386 m2/g 减少到130.028 m2/g,有轻微下降,孔容积以及孔半径也有下降,说明CPF 成功负载在PA 上。当PA-CPF 制备成水凝胶后,三者均有不同程度的下降。
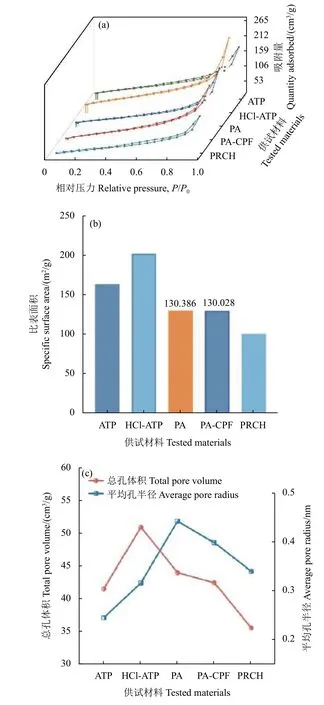
图6 ATP、HCl-ATP、PA、PA-CPF、CPF、PRCH的氮吸附-脱附曲线 (a) 及比表面积 (b) 和总孔容积和平均孔径 (c)Fig. 6 Nitrogen adsorption and desorption curves(a),specific surface area (b), total pore volume and average pore radius (c) of ATP, HCl-ATP, PA, PA-CPF,CPF and PRCH
2.2.3ζ-电位表征 Zeta 电位能反应凹凸棒修饰前后,载药及功能化后表面的电性特征。如图7 所示:凹凸棒本身带正电,酸活化使凹凸棒内部及表面产生更多带负电的基团,由于凹凸棒表面杂质经酸化去除后暴露了更多的−OH 等负电基团,从而显示出负电性。多巴胺在碱性条件下形成的聚多巴胺黏附在凹凸棒表面,提供了许多氨基,氨基经质子化作用改变了电性,从而展现出正电性[26]。毒死蜱呈负电性,多巴胺修饰的凹凸棒在负载上毒死蜱后由正电转变为负电,说明毒死蜱成功负载在材料上。而PRCH 由于凝胶化处理形成的海藻酸钙上含有大量的羧基等负电基团,从而展现出负电性。

图7 ATP、HCl-ATP、PA、PA-CPF、PRCH 和CPF 的ζ 电位Fig. 7 Zeta potentials of ATP, ATP-HCl, PA,PA-CPF, PRCH and CPF
2.2.4 傅里叶红外光谱分析 图8 为ATP、PA、PA-CPF 和PRCH 的红外光谱图。在凹凸棒中波数为1033 cm−1和984 cm−1处为Si−O 键的伸缩振动峰,476 cm−1为Si−O−Si 键的弯曲振动峰,它们均为凹凸棒的特征吸收峰[18]。在PA 中,1637 cm−1处归属于酰胺中的羰基 (C=O)[19]和3450 cm−1处归属于 −OH 的伸缩振动峰都变得更强,并且在1383 cm−1处出现了酰胺的N−H 伸缩振动峰,说明多巴胺成功包裹在了凹凸棒上。而在负载上毒死蜱后,PA 的N−H 吸收峰却消失了,这可能是由于毒死蜱与PA 的 −NH2发生静电相互作用引起的,表明毒死蜱吸附在了PA 的表面[20]。当水凝胶形成时,3450 cm−1和1636 cm−1处的 −OH 和C=O 键吸收峰大大增强,并且在1405 cm−1处出现了海藻酸钠的特征基团 −COO−的对称拉伸[8],而在2928 cm−1处新出现的峰与聚合物链中亚甲基的C−H 伸缩振动有关[21]。

图8 ATP、PA、PA-CPF、CPF 和PRCH 的红外光谱图Fig. 8 IR spectra of ATP, PA, PA-CPF, CPF and PRCH
2.3 PRCH 的释药性与溶胀率
2.3.1 释放动力学 本研究采用Korsmeyer-Peppas 模型来对累积释放曲线进行拟合,表2 为拟合的相关参数。在pH 值为5.5 的介质中,释药特性指数n在0.43~0.85 之间,为Non-Fickian 扩散机制,说明药物的自身扩散和水凝胶的溶胀降解是同步进行的[27]。在pH 值为7 的介质中,n值为1.168,属于Case-II 类Fickian 传输机制,说明水凝胶裂解的速率在药物传输过程中占主导作用;而在pH 值为8.5 的磷酸盐缓冲液中n值为0.3386,属于Case-I 类Fickian 传输机制,说明毒死蜱的扩散速率大于水凝胶的裂解速率,药物自身的扩散在毒死蜱的释放过程中起主导作用[28]。
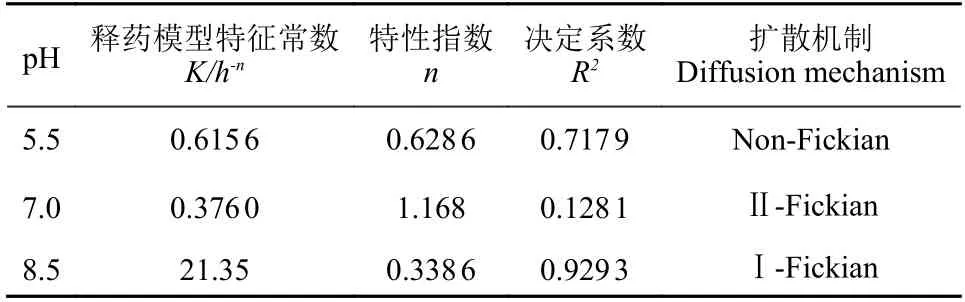
表2 PRCH 在pH 值为5.5、7.0 和8.5 的3 种介质中毒死蜱的累积释放曲线拟合参数Table 2 Fitting parameters of cumulative release curves of chlorpyrifos by PRCH at pH 5.5, 7.0 and 8.5
2.3.2 控释性能与溶胀率 溶胀行为是药物传递系统的重要特性,它对药物的释放有着很大的影响。在一定体积的磷酸盐缓冲溶液模拟释药介质中,毒死蜱的释放是从溶胀的水凝胶中扩散出来的。制约毒死蜱从海藻酸钙水凝胶中释放的两个重要因素是药物自身的扩散和水凝胶的溶胀裂解[27]。
图9a 和9b 为PRCH 在3 种磷酸盐缓冲液中的溶胀率和累积释放率曲线图,图9c 为24 h 内不同pH 值下PRCH 的动态变化。当pH = 5.5 时,凝胶微球的溶胀率相对较小,PRCH 这时处于紧缩状态,毒死蜱释放也较少。这是因为海藻酸钙的 −COO−基团转化为 −COOH 基团,羧基之间存在的氢键导致聚合物-聚合物之间的作用力强于聚合物-缓冲液之间的作用力占主导地位[8],因此这些基团之间的静电斥力减小,分子链收缩,导致水凝胶的溶胀率低 (图9b 和9c),从而锁住PA-CPF导致毒死蜱的释放率较小 (图9a)。pH 值增加到7.0 时,溶胀率开始增大,PRCH 已经有部分结构坍塌,释放出少量毒死蜱。因为这时 −COOH 基团开始解离,由于缓冲液中游离的H+浓度较高,渗透压增加,促进水分吸收,导致 −COO−之间的静电斥力增加[7],此时水凝胶溶胀率能达到原水凝胶的15%左右。图9c 可以看出,pH=7.0 时溶液在8 h 开始变得浑浊,同时水凝胶部分坍塌释放出包裹在其中的部分凹凸棒和毒死蜱,最后能达到60% 左右的释药率。当pH 值升高到8.5 时,由图9b 可以看出,水凝胶在8 h 迅速溶胀,并在12 h 时已经完全破裂,大大加速药物的扩散。同时图9a 发现,在5~20 h 内,毒死蜱的累积释放率迅速增加,并在24 h 后稳定达到80%以上,最大能达到89%的释放率。因为在碱性溶液中羧酸盐离子之间的静电斥力取代羧基基团间的氢键作用,引起分子链的松弛,海藻酸钙的亲水性增加,分子链伸展,水凝胶迅速溶胀到原来的23%,微球表面的结构迅速坍塌,吸附在水凝胶内部的农药在浓度差的驱动下迅速扩散到外部介质中[9]。随着时间的推移,毒死蜱从凝胶网络空隙向缓冲溶液扩散的难度越来越大,导致毒死蜱释放速度减慢,直至慢慢平衡。
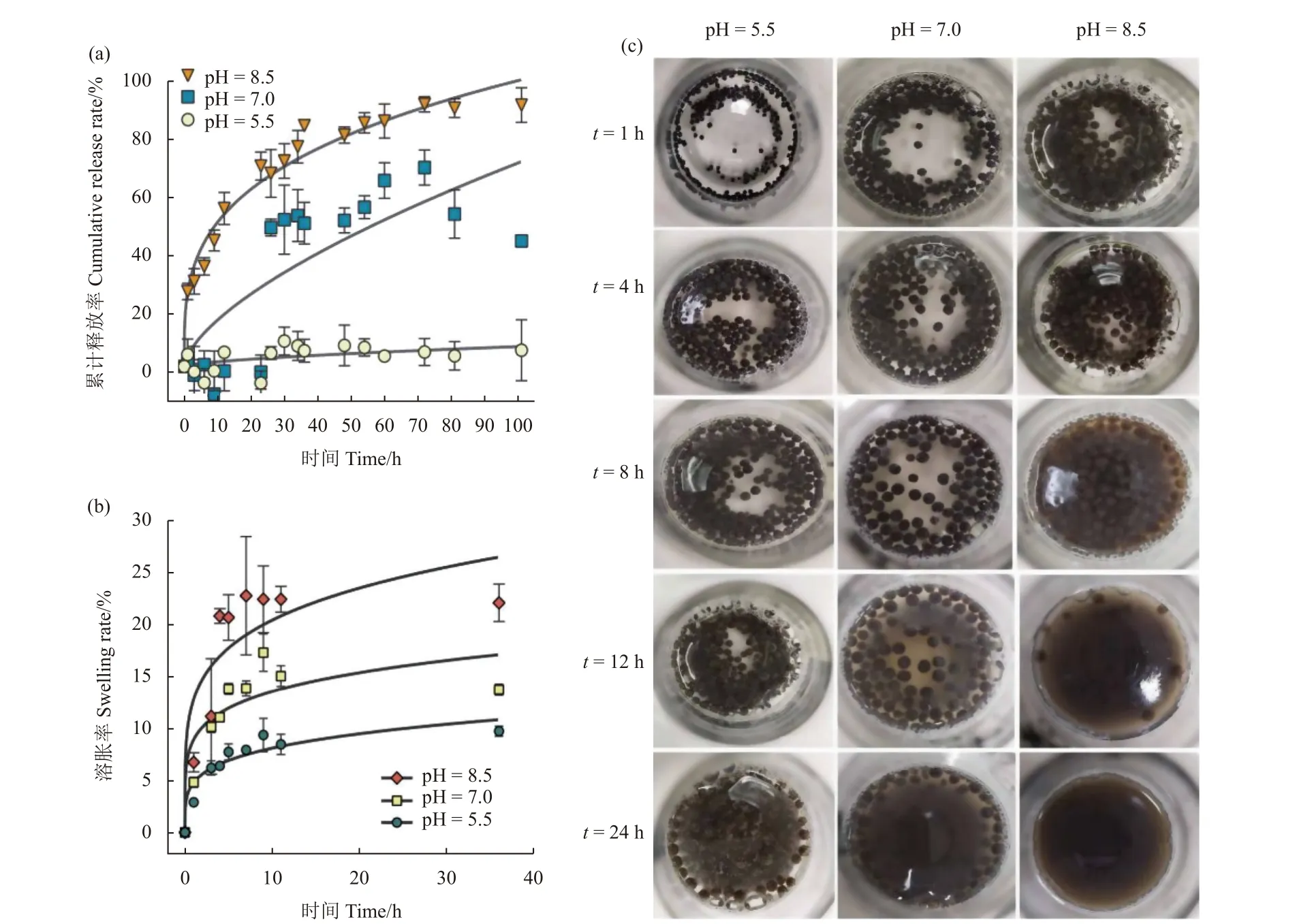
图9 PRCH 在pH = 5.5、7.0、8.5 条件下CPF 累积释放率(a)以及溶胀率(b),PRCH 在3 种pH 缓冲溶液中的状态图(c)Fig. 9 CPF cumulative release rates (a) and swelling rates (b) of PRCH in buffer solutions with pH = 5.5, 7.0, and 8.5,and digital photos of PRCH in buffer solutions with different pH values (c)
2.4 稳定性
考虑到大多数农药在施用于农作物和杂草时都会经历变温场景和强烈的太阳辐射,因此研发的制剂在紫外线和不同温度条件下的稳定性能尤为重要。本研究将PRCH 和毒死蜱标准品放置在紫外灯下照射223 h,由图10a 发现,PRCH 中的毒死蜱降解率不到5%,在紫外照射下基本不发生降解,而没有水凝胶包裹,直接暴露在紫外线下的毒死蜱降解率超过了50%。由此表明,海藻酸钙凝胶可以显著提高毒死蜱的光稳定性,有效地防止了毒死蜱的光解,而PRCH 水凝胶中毒死蜱对紫外线的屏蔽作用,可能是由于海藻酸钙水凝胶能够吸收或反射紫外线,能将其保护起来免受紫外光的分解[5]。而将两者放置在45、25 和5 ℃3 个不同温度的环境中 (图10b、图10c、图10d),发现毒死蜱在45 ℃降解了40%左右,在25 ℃、5 ℃时降解率都超过了50%,而PRCH 则基本不发生降解,保持了很好的稳定性。综上所述,水凝胶PRCH 相比于毒死蜱标准品表现出更好的紫外稳定性和温度稳定性。这将延长毒死蜱的持效期,让其能稳定的达到药效。
3 结论
1) 本研究使用多巴胺修饰的凹凸棒负载毒死蜱,采用外源挤出法制备了多巴胺改性凹凸棒/毒死蜱/海藻酸钙复合水凝胶 (PRCH)。其对毒死蜱的负载率高达85%,在缓冲溶液中随着碱性增强,PRCH 释放毒死蜱的速率增高,成功地实现了水凝胶体系的pH 响应性。
2) 在pH = 5.5 的介质中,毒死蜱从水凝胶PRCH中释放出来的行为遵循Non-Fickian 扩散机制,说明药物的自身扩散和水凝胶的溶胀降解是同步进行的;在pH = 7.0 时,属于Case-II 类Fickian 传输机制,说明药物传输过程中占主导作用的是水凝胶裂解的速率;而在pH = 8.5 时,毒死蜱释放行为属于Case-I 类Fickian 传输机制,药物自身的扩散起着主导作用,但水凝胶的快速裂解加速了毒死蜱的扩散。
3) 由多巴胺、凹凸棒和海藻酸钙构建的水凝胶PRCH 可实现对毒死蜱很好的包埋,提高其在紫外光和不同温度下的稳定性,其只在碱性条件下对环境作出特定的响应,从而释放出毒死蜱。因此,PRCH 有效地提高了毒死蜱的持效期。这种绿色环保,高效负载、特定响应的缓释体系在提高传统农药稳定性和防治效果等方面具有良好的应用前景。
