氟吡呋喃酮及其类似物研究进展
2022-06-14苏彦豪许磊川李益豪王明安
苏彦豪, 许磊川, 赵 宇, 张 倩, 李益豪, 王明安
(中国农业大学 应用化学系,农药创新研究中心,北京 100193)
新烟碱类杀虫剂是以烟草中的生物碱尼古丁(nicotine)为先导化合物开发而来,作用于昆虫乙酰胆碱受体,自1991 年第1 个品种——吡虫啉商品化至今,该类杀虫剂已发展至第4 代,有10 多个商品化品种。在高毒农药逐渐被禁用的趋势下,新烟碱类杀虫剂在防治病虫害方面发挥着越来越重要的作用[1]。然而近年来随着该类杀虫剂的大量使用,其对桃蚜、稻褐飞虱、棉粉虱、温室粉虱等产生的抗性问题也越来越严重,部分新烟碱类杀虫剂还对蜜蜂高毒或剧毒,多国已逐步禁用部分高毒新烟碱类杀虫剂[2]。因此开发高效、对蜜蜂低毒,且与现有品种无交互抗性的新型杀虫剂迫在眉睫。在21 世纪开发的新农药品种中[3],拜耳公司的新型丁烯内酯类杀虫剂—氟吡呋喃酮(flupyradifurone,FPF,商品名Sivanto®)[4-6]较好地解决了这一问题,其纯品为白色至米黄色固体粉末,几乎无味,对多种刺吸式口器害虫具有药效快、持效期长等特点,对包括幼虫和成虫在内的所有生长时期害虫皆有效,且与现有新烟碱类杀虫剂无交互抗性,对蜜蜂急性接触LD50> 100 μg/头,急性经口LD50为1200 ng/头,叶面残留量200 g/hm2时对蜜蜂无影响。对蜜蜂的田间长期研究表明,施药量为有效成分205 g/hm2时,对觅食期的蜜蜂无副作用,对大黄蜂的急性接触 LD50> 100 μg/头[6],因此也可在花期使用。氟吡呋喃酮相比于传统新烟碱类杀虫剂具有较低毒性,可能是两者与蜜蜂体内乙酰胆碱受体具有相反的键合方式[7],按标签规定剂量使用,对蜜蜂活动区域也没有不利的影响[8]。
在农药制剂研发过程中,将两种或多种农药品种进行复配可以提高药效,有效减少使用量以及延缓抗性的产生,杀虫剂氟吡呋喃酮也是如此。如拜耳公司针对氟吡呋喃酮申请了多个与其他杀菌剂或杀虫剂的组合物专利[9-12],中国也有多家单位先后开展了该药剂与不同杀虫剂、杀菌剂以及生物农药的复配制剂研究,不仅提高了药效,而且拓展了活性谱,扩大了应用范围[13-21],例如:将氟吡呋喃酮分别与杀菌剂异菌脲[13]、氟吡菌酰胺[14]混配,可提高其对线虫的防治效果;氟吡呋喃酮与其他杀菌剂的复配制剂,可应用于马铃薯上病虫害的防治[15-18];将氟吡呋喃酮与咯菌腈和咪酰胺的三元复配制剂用于种子处理,可以显著提高对蔬菜蚜虫、蓟马、黄曲条跳甲和蔬菜白粉病的防治效果[19];氟吡呋喃酮与苯基吡唑类杀菌剂(metyltetraprole)的复配制剂还可以用来防治棉花上的病原真菌[20]。此外,氟吡呋喃酮还有与拟除虫菊酯类、双酰胺类、螺环季酮酸类杀虫剂[21-38]以及苦参碱、黎芦碱、印楝素和伊维菌素等生物源类杀虫剂进行复配的制剂[39-42],也有将枯草芽孢杆菌菌株FB17 与氟吡呋喃酮形成协同增效组合物的专利,以及氟吡呋喃酮作为药肥成分以改善植物生长和健康状况等的研究报道[43-45]。
鉴于氟吡呋喃酮获得的广泛应用以及针对其持续研究所获得的新成果以及对新农药创制的启示,本文拟从其创制过程、作用机制、生物活性及抗性、代谢残留、对蜜蜂的影响以及结构修饰等方面进行综述。
1 氟吡呋喃酮的创制过程
百部碱(stemofoline)是Irie 等于1970 年首次从蔓生百部Stemona japonicaMiq. 的根和叶中分离得到的一种具有复杂骨架结构的百部类生物碱(图式1)[46]。研究表明,百部碱对小菜蛾幼虫和夜蛾科幼虫具有一定杀虫活性,同时对昆虫还具有击倒、拒食和趋避活性[47]。百部类生物碱可以作用于昆虫乙酰胆碱酯酶,而这可能是其具有杀虫活性的原因[48-49]。鉴于此,百部碱被作为先导化合物用来开发新型杀虫剂。有关从百部碱的结构修饰到氟吡呋喃酮的创制过程已有文献提及[6,50],本文作一简要介绍。

图式1 百部碱的分子结构Scheme 1 Molecular structure of stemofoline
对百部碱的结构改造主要分为两个方向:一是对笼状莨菪烷的修饰[51-52]。拜耳公司合成了大量的取代莨菪烷类化合物,其对蚜虫、线虫和粉虱具有较好的致死活性,其中代表性的化合物为N取代的3-(5-氯-3-吡啶基)-氰基莨菪烷,其在生物体内可以被代谢为N上没有取代基的活性化合物,从而起到杀虫作用。所合成的化合物在500 μg/mL 时对桃蚜具有较好的活性,但在低浓度时活性不好,因此并未开展深入研究。
另外一个方向是对百部碱“头部基团(head group)”——丁烯内酯部分的改造 (图式2)。早期拜耳公司通过对作用于乙酰胆碱受体的杀虫剂进行分子结构模拟,设计了一类新的活性结构片段(I),发现该片段中含有类似吡咯、五元杂环[53]和六元杂环内酯或者内酰胺等[54]化合物都具有较好的杀虫活性(图式2)。由于丁烯内酯结构可修饰位点多,他们将I 中的杂环基团替换为丁烯内酯,合成了大量烯胺羰基化合物(II)[55-56],并发现当Z 为O、S 或CH2时具有良好的杀虫活性,尤其为O 时杀虫活性最好,最终确定以通式III (Z =O)为先导结构继续进行结构优化(图式2)。

图式2 百部碱的优化和氟吡呋喃酮的发现[6,50]Scheme 2 The optimization of stemofoline and discovery of flupyradifurone[6,50]
对于丁烯内酯类化合物 (III ,Z = O),通过构效关系分析,发现当取代基A 为六元杂环(尤其是取代吡啶)时对刺吸式口器昆虫具有较好的杀虫活性(IV)。对于取代基R2和R3,卤素或烷基的引入并不能提高杀虫活性,反而还有可能降低活性,从而确定R2和R3的最优基团均为H (V)。对吡啶环不同位置取代基进行修饰,发现取代基为6-F、6-Cl、6-Br 时均有较好的杀虫活性,尤其是6-氯吡啶-3-基时活性最好(VI)。通过分析N 上不同取代基R1的生物活性发现,当R1为含氟烷基,如2-氟和2,2-二氟乙基时对桃蚜表现出优异活性,且2,2-二氟乙基时对小猿叶甲Phaedon cochleariae的活性更好,从而得到新的先导化合物VII,而将R 基团替换为其他卤素、甲基或者三氟甲基后,化合物对桃蚜和小猿叶甲的活性均会显著降低,至此确定化合物VII 中R 最优基团为氟,最后选择化合物N-2,2-二氟乙基-N-(6-氯吡啶-3-基)-4-氨基丁烯内酯(即氟吡呋喃酮)进行了商业化开发(图式2)[6]。
2 氟吡呋喃酮在植物体内的传导机制
通过与氚代吡虫啉([3H]-IMD)的放射性配体结合研究,发现氟吡呋喃酮能够取代与家蝇头部烟碱型乙酰胆碱受体(nAChRs)结合的氚代吡虫啉,可逆地与昆虫烟碱乙酰胆碱受体结合(IC50=2.38 ± 1.93 nmol/L)。以不同浓度的氟吡呋喃酮和乙酰胆碱处理从草地贪夜蛾Spodoptera frugiperda细胞分离出的孤立神经元,并记录细胞电生理反应。结果显示,氟吡呋喃酮能作为部分激动剂,使昆虫烟碱乙酰胆碱受体内源表达,证明氟吡呋喃酮能够选择性地作用于昆虫中枢神经系统的乙酰胆碱受体,是烟碱乙酰胆碱受体激动剂[50]。分子对接结果显示,与商业化烟碱乙酰胆碱受体激动剂相比,氟吡呋喃酮具有独特的结合方式,国际杀虫剂抗性行动委员会单独将其归为丁烯内酯类(4D),以区别于新烟碱类(4A)、烟碱类(4B)、氟啶虫胺腈(4C)和三氟苯嘧啶(4E)杀虫剂[57]。
以14C 标记的氟吡呋喃酮可溶性液剂SL200 溶液施用于番茄植株根部,分别于施药后1、3、7、14 和24 d 取近土壤端枝条进行荧光显色处理,发现1 d 后氟吡呋喃酮即可在植株中均匀分布,表明其可通过木质部转运,7~14 d 时浓度达到最高,24 d 后浓度有所下降,可见氟吡呋喃酮具有优异的转运和内吸性,药效快且持续时间长(图1)[6]。此外,氟吡呋喃酮也表现出明显的叶片远端积累,如图1a 所示,随着施药时间的延长,仅在叶片边缘部分氟吡呋喃酮的浓度逐渐升高,随后开始下降,表明其是通过木质部的质外体转运并且缺乏明显的韧皮部转运。施用于番茄中脉和叶片上的氟吡呋喃酮也能通过蒸腾作用在植株体内达到很好的分布(图1b),表明其很适合植株喷淋。施药2 h 内害虫就会因为接触或取食药剂而迅速终止摄食。氟吡呋喃酮还具有跨层分布效应,即便是位于叶片背面或没有直接暴露在喷雾液滴下的蚜虫也会迅速停止摄食[6]。由于药物从根部吸收转运到作物叶片有一定的距离,因此相比于用作种子处理剂,喷淋法使用氟吡呋喃酮会更快地杀死害虫。
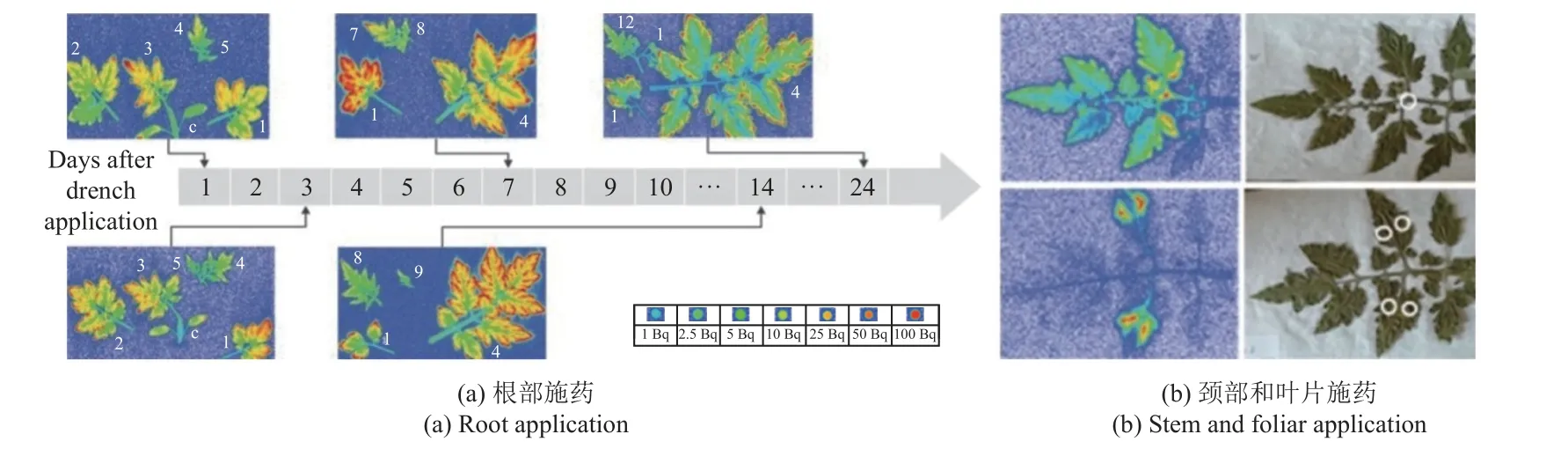
图1 番茄植株不同部位施药后氟吡呋喃酮在植株体内的分布情况[6]Fig. 1 The distribution of flupyradifurone in different parts of the tomato plants after the application[6]
氟吡呋喃酮因其独特的作用机制,对大多数水果、蔬菜、种植园以及特定的大田作物上的刺吸式口器害虫有较好的防治效果[58],如蚜虫(如莴苣膨管蚜、苹果蚜、棉蚜[59]、桃蚜[60])、飞虱(如稻褐飞虱)、粉虱(如温室白粉虱、烟粉虱)、叶蝉[61](如葡萄小绿叶蝉、葡萄带叶蝉)等,也可作用于水蜡虫、潜叶虫、软蚧、象鼻虫、跳甲以及木虱类害虫[62]。研究发现,用亚致死剂量的氟吡呋喃酮处理棉蚜成虫后,其对母代棉蚜寿命和繁殖率没有显著不利影响,但是能够显著抑制其子代棉蚜的生长发育和繁殖,从而抑制子代棉蚜的种群扩增[60]。亚致死剂量的氟吡呋喃酮会对亚洲柑橘木虱(Asian citrus psyllid,Diaphorina citri)的取食、定居、迁飞行为和雌虱的生育力产生影响,致死和亚致死剂量的药剂还会对亚洲柑橘木虱产生毒物兴奋效应[63];采用滴灌技术,氟吡呋喃酮对亚洲柑橘木虱也有较好的防治效果,这种施药方式不仅可以延长防效期,还可以避免因喷雾法施药而造成蜜蜂等非靶标生物与药剂的直接接触[64]。另外,氟吡呋喃酮对狡诈花蝽Orius insidiosus也有较高的致死率[65],在实验室条件下,对杜鹃花军配虫Stephanitis pyrioidesScott 也具有一定的趋避作用[66]。
对于由烟粉虱传播的南瓜黄色矮化失调病毒(cucurbit yellow stunting disorder virus)[67]、由棉粉虱传播的番茄黄化曲叶病毒(tomato yellow leaf curl virus)[68]以及由桃蚜传播的芜菁花叶病毒(turnip mosaic virus)[69],氟吡呋喃酮也能起到较好的控制作用。同时,氟吡呋喃酮对靶标昆虫,如粉虱、木虱以及蚜虫,有较好的摄食中止作用,这也从一定程度上降低了病毒和细菌的传播风险。Tejedareyes 等[70]研究了番茄木虱Bactericera cockerelliSulc 对氟吡呋喃酮的敏感性。结果表明,当番茄木虱暴露于喷洒了氟吡呋喃酮的空气中时,其摄食量会大大降低。也有研究表明[71-72],氟吡呋喃酮具有一定的杀蚊活性,还可以作为卫生杀虫剂使用。
3 氟吡呋喃酮的抗性研究
农药的大量使用会加速靶标抗药性的产生,近年来已相继报道了褐飞虱、烟粉虱、温室白粉虱和桃蚜等对新烟碱类杀虫剂产生抗性的问题[73],使用推荐剂量已难以达到理想的防治效果。随着氟吡呋喃酮的广泛使用,其抗性问题已有显现。Smith 等[74]研究了MEAM1 型烟粉虱对吡虫啉、噻虫嗪、氟吡呋喃酮和呋虫胺的敏感性,发现其敏感率分别为21%、26%、47%和53%,与实际应用敏感率基本一致,即使是没有接触过氟吡呋喃酮的田间烟粉虱对氟吡呋喃酮也有55~79 倍的抗性,且对氟吡呋喃酮具有高抗性的烟粉虱通常对其他杀虫剂也具有较高的抗性,表明氟吡呋喃酮与其他杀虫剂也存在交互抗性。Guo 等[75]研究了中国8 省份19 个不同地区烟粉虱对新烟碱类以及氟吡呋喃酮的抗性问题,发现只有两个地区(湖北洪山和天津东丽)对氟吡呋喃酮表现出低抗性,与实验室敏感型相比,抗性比分别为6.2 和7.0。任志杰等[76]研究了褐飞虱Nilaparvata lugens和白背飞虱Sogatella furcifera对氟吡呋喃酮抗性问题,发现多地褐飞虱田间种群已对氟吡呋喃酮产生中等水平抗性,即使未使用过氟吡呋喃酮的田间稻飞虱,也对其产生了一定的抗性,进一步说明的确与现有杀虫剂存在一定的交互抗性。Byrne 等[77]通过研究吡虫啉对翅叶蝉Homalodisca vitripennis抗性发现,对吡虫啉抗性较高的翅叶蝉也对其他种类杀虫剂具有抗性,其中对吡虫啉具有抗性的成虫也对氟吡呋喃酮产生了抗性,约是敏感品系的4 倍。
虽然已有对氟吡呋喃酮出现抗性的报道,但具体的抗性机制研究还不深入,目前的研究是基于与吡虫啉对比而开始的。对吡虫啉和吡蚜酮表现高抗性的烟粉虱(Q 型和B 型)研究发现,表现抗性的原因可能与其体内一种基因CYP6CM1的过度表达,诱导细胞色素 P450 单氧化酶增加有关[78-80],研究发现,吡虫啉能够与CYP6CM1vQ模型中的35 个空腔结合,约20%空腔表现出药物分子朝向血红素铁-氧活性中心的结合模式(图2a),这会致使其N-硝基亚氨基咪唑烷基部分发生羟基化(图2b),进而失活。

图2 IMD 和FPF 与CYP6CM1vQ 分子对接模型[58]Fig. 2 Molecular docking mode of IMD and FPF within the CYP6CM1vQ[58]
而氟吡呋喃酮与CYP6CM1vQ只有23 个空腔结合,由于N-二氟乙基的存在,改变了氟吡呋喃酮分子的键合方式,大多数结合模式是无反应性的二氟乙基侧链朝向血红素铁-氧活性中心(图2c),因此没有表现出代谢丁烯内酯的可能[58],而将新烟碱类杀虫剂分子结构中N 上的烷基替换为二氟乙基后,活性却是下降的,由此可见二氟乙基在丁烯内酯类杀虫剂结构中具有至关重要的作用。
Wang 等[81]在湖北武汉和襄阳地区对氟吡呋喃酮具有抗性但对溴氰虫酰胺和吡虫啉无交叉抗性的烟粉虱研究发现,其细胞色素P450 和酯酶的活性明显增加,增效醚(PBO)和磷酸三苯酯(TPP)会抑制细胞色素P450 和酯酶的活性,并且PBO和TPP 分别与氟吡呋喃酮混用有较好的协同作用(添加PBO 和TPP 的氟吡呋喃酮药剂与原药相比,对襄阳烟粉虱的协同增效比分别为3.13 和4.46,PBO 对武汉烟粉虱的协同增效比为3.76)。随后,该团队将分离出来的对氟吡呋喃酮表现抗性的烟粉虱进行多代培养得到抗性株,研究表明其抗性原因可能与谷胱甘肽-S-转移酶(GST)和P450 单氧化酶有关,与敏感株相比,抗性株中的CYP6CX4和GSTs2过表达,但其具体机制还未真正阐明[82]。
当植物被害虫侵害时,能够分泌一种次生代谢产物,而这种次生代谢产物可以影响昆虫代谢及其生理功能等,以避免有害昆虫再次侵害,Després 等[83]发现这种次生代谢物可能影响杀虫剂的敏感性。基于此,Zhang 等[84]研究发现,植物的这种次生代谢物会增加有害昆虫的细胞色素P450 活性,以对抗这种植物的自身防御,经次生代谢物处理的烟粉虱成虫会显著增加其对噻虫嗪和氟吡呋喃酮的抗性,当用细胞色素P450 抑制剂处理具有抗性的烟粉虱后,其死亡率明显增加。通过基因水平的研究发现,次生代谢物会诱导细胞色素P450 基因CYP6CM1、CYP6CX4和CYP4C64的表达。此外,该团队也验证了PBO 能够显著增加被氟吡呋喃酮和噻虫嗪处理过的烟粉虱的死亡率这一结论。Hamada 等[85]通过肉毒杆菌表达系统表达的CYP6ER1-del3和CYP6ER1-T318Sdel3突变发现,与对照组相比其对吡虫啉的抗性比为288.7,而对呋虫胺的抗性比仅为3.6,且抗性增加缓慢,抗性比主要是通过代谢的方式增加的,他们也发现,氟啶虫胺腈不会被这两种基因突变体代谢,但是对氟吡呋喃酮却有一定的代谢作用,显示出CYP6ER1突变体对底物的选择性。
目前已经发现氟吡呋喃酮与部分传统新烟碱类杀虫剂具有一定交互抗性。但是分子对接研究发现,由于二氟乙基的引入,其抗性机理与传统新烟碱类杀虫剂并不相同,这也是其抗性不如传统新烟碱类显著的一个原因。目前氟吡呋喃酮的抗性机制尚未被阐明,但是针对细胞色素P450 的研究发现,细胞色素P450 基因的过度表达可能是抗性产生的一个重要原因。
4 氟吡呋喃酮在生物体内的代谢产物及残留分析
联合国粮农组织(FAO)、世界卫生组织(WHO)和农药残留专家联席会议(JMPR) 于2015 年对氟吡呋喃酮及其代谢物毒性进行了评估,认为该化合物对小鼠或大鼠无致癌性,同时也没有生殖毒性和遗传毒性,对人类无致癌风险;同时确定了氟吡呋喃酮的每日允许摄入量ADI (acceptable daily intake)为0~0.08 mg/kg bw,急性参考剂量ARfD (acute reference dose)为0.2 mg/kg bw[86]。2016年,JMPR 又对氟吡呋喃酮及其代谢物的残留进行了评估[87,88]。氟吡呋喃酮在植物、动物以及环境中的代谢产物多达50 种,部分结构如图式3 所示,其中最主要的包括6-氯烟酸(6-CNA) (与吡虫啉具有相同的代谢产物)[89]、二氟乙氨基呋喃酮(DFEAF)、二氟乙酸(DFA)以及氟吡呋喃酮丁烯内酯部分被氧化得到的fpd-OH 等。残留物检测发现,植物体内母体化合物氟吡呋喃酮依然是残留量最高的,其主要代谢产物为CHMP-di-glyc、6-CNA 和DFA,而含有呋喃酮结构的代谢物并没有检测到;在动物代谢研究中,氟吡呋喃酮仍然是大鼠及反刍动物的主要残留物,对于家禽类,例如在母鸡体内检测到的氟吡呋喃酮残留量很少,在鸡蛋、肌肉和脂肪中的主要代谢物为acetyl-AMCP,在肝脏中的主要代谢物为fpd-OH-SA;在有氧条件下,氟吡呋喃酮在土壤中主要被分解为DFA 和6-CNA,并进一步被分解为CO2;此外,氟吡呋喃酮在水中会主要代谢为DFA、BYI 02960-succinamide 和BYI 02960-azabicyclosuccinamide。JMPR 在2017 年的评估中增加了对氟吡呋喃酮最大残留限量(MRL)的定义[90]:在植物中其残留量定义为氟吡呋喃酮、DFA 和6-CNA 的总和;在动物中定义为氟吡呋喃酮和DFA 的总和;会议同时还建议樱桃、桃、李子和西梅中的MRL 值分别为2、1.5、0.4 和3 mg/kg。
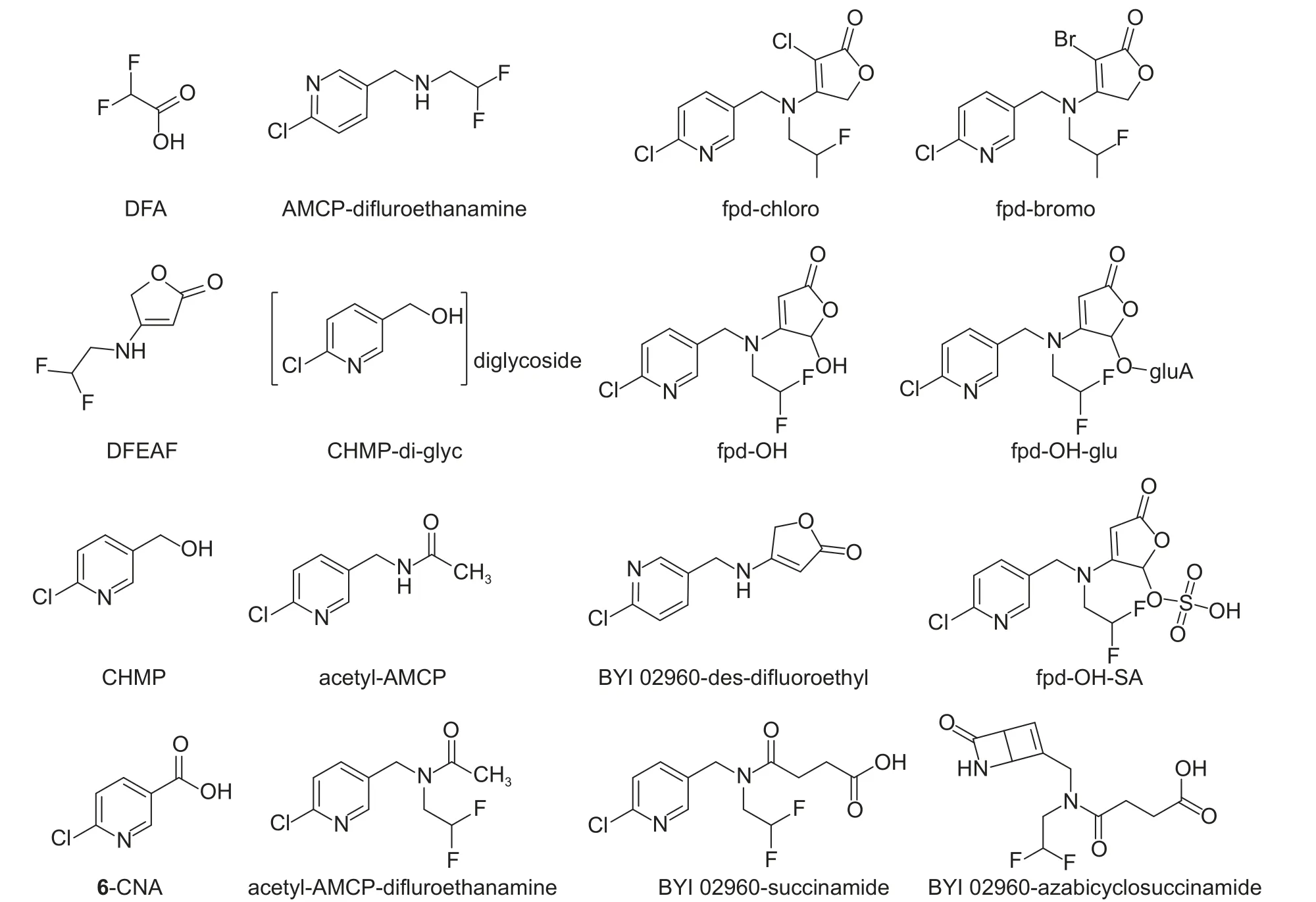
图式3 氟吡呋喃酮主要的代谢产物Scheme 3 The main metabolites of flupyradifurone
欧盟也对氟吡呋喃酮进行了相应的风险评估,并确定其在欧盟地区的ADI 和ARfD 值分别为0.064 和0.15 mg/kg bw。在土壤中,氟吡呋喃酮、6-CNA 和DFA 被评估为低风险,且在地下水变成地表水的情况下,这3 个化合物对水生生物的风险较低。由此可见,氟吡呋喃酮及其代谢产物对环境无风险或风险较低[91]。对于氟吡呋喃酮及其主要代谢产物DFA,欧盟也重新设定了二者在草莓、黑莓和山莓中的MRL 值[92],同时也对二者在油菜籽、芥菜籽[93]和秋葵[94]上的MRL 值进行了修订。
含有氯代吡啶结构的氟吡呋喃酮在生物体内被代谢为6-CNA、DFEAF 和DFA 等多种代谢物(图式3)。研究表明,氟吡呋喃酮及其代谢产物会对人类淋巴细胞产生细胞毒性和遗传影响[95],因此其残留量的测定及风险评估至关重要。美国在对药剂的评估中,重点对拜耳公司针对氟吡呋喃酮及DFA 和6-CNA 的分析方法进行了验证,结果确认该方法对土壤及水中的残留物检测完全适用[96-98]。Li 等[99]首先利用超高效液相色谱-串联质谱 (UPLC-MS/MS) 法,开发了一种可以快速测定水果、蔬菜和谷物上氟吡呋喃酮及其代谢产物(6-CAN 和DFEAF)残留量的方法,并将这一方法应用于马铃薯(大田中的样品首先施加剂量为有效成分200 g/hm2的氟吡呋喃酮可溶性粉剂,并分别于0、1、2、5、7、14、21 和28 d 采样,−20 ℃保存)上氟吡呋喃酮残留量的测定,发现随着时间的延长,其残留量逐渐下降,并未检测到DFEAF和6-CAN,推测可能是这两个代谢产物在马铃薯里的含量较低,或被进一步代谢为其他产物所致。李双双等[100]采用UPLC-MS/MS 技术建立了同时检测柑橘全果、橘肉及橘皮中氟吡呋喃酮及其代谢物二氟乙酸、6-CNA 和DFEAF 残留量的分析方法,经过实际样品分析发现,氟吡呋喃酮相较于其代谢产物的检出率更高,且以在柑橘果皮中的检出浓度较高。Fang 等[101]应用UPLC-MS/MS 法,开发了一种可以快速检测中国传统中草药中氟吡呋喃酮及其6-CAN 和DFA 残留量的方法。另外也有报道测定了16 种杀虫剂及其代谢产物在商业红葡萄酒和白葡萄酒中的残留量,但并未检测到氟吡呋喃酮的残留,可见使用氟吡呋喃酮可以有效地防治葡萄虫害,按推荐剂量使用,其在葡萄上的最大残留量也符合要求[102]。
氟吡呋喃酮除了在哺乳动物、植物、昆虫体内会发生代谢外,在光照下也会发生分解。Chaubey等[103]采用核磁共振(NMR)方法,研究了在天然腐殖酸(humic acid, HA)存在时氟吡呋喃酮在土壤-水体系中的光解速率及可能的产物。结果表明,光照条件下氟吡呋喃酮会分解为DFA 及呋喃酮开环的产物,并且由于HA 的存在,会与氟吡呋喃酮通过共价键相结合,从而放慢氟吡呋喃酮的降解进程,因此氟吡呋喃酮在土壤中具有更长的持效期。在风险评估时,农药原药及其代谢产物的检测至关重要,因此开发快速、简便、有效且安全的检测方法对氟吡呋喃酮风险评估及最大残留量的制定具有重要意义。
5 对蜜蜂等非靶标生物的影响
由于部分新烟碱类杀虫剂对蜜蜂高毒[104],因此很多国家开始逐步对其禁用。虽然按标签推荐剂量使用,氟吡呋喃酮对蜜蜂无不利影响,可以在花期前和花期使用[8],但也有相关研究表明,高剂量以及长期应用氟吡呋喃酮也会对蜜蜂有一定的影响。例如,Tosi 等[105]总结了氟吡呋喃酮与其他农药对蜜蜂的协同效应:与丙环唑共同使用会增加蜜蜂的死亡率和非正常的行为;与乐果共同使用时,其对采食蜜蜂的毒性比蜂巢中的更高;夏季时氟吡呋喃酮的毒性会更高。Siviter 等[106]总结了氟吡呋喃酮对益虫的影响,虽然正常剂量条件下无法检测亚致死效应,但其对益虫确实具有明显的消极影响,例如无论是低剂量还是高剂量,均会降低中华蜜蜂幼蜂及成蜂的嗅觉学习能力和记忆力[107]。此外,在较高剂量(8.3 × 10−4mol/L)下,氟吡呋喃酮会影响蜜蜂对花粉和花蜜的味觉和认知能力[108],但由于正常使用剂量并没有这么高,因此认为氟吡呋喃酮对蜜蜂无害。Al Naggar等[109]研究了氟吡呋喃酮对意大利蜜蜂的长期影响,将幼蜂短期暴露于亚致死剂量的氟吡呋喃酮中,然后转移至自然环境条件下研究后期的生长情况。结果显示,其存活率显著降低,还会改变几个免疫和解毒基因的表达,最终导致蜜蜂健康状况下降。对于意大利蜜蜂,氟吡呋喃酮有更强的影响幼蜂基因表达的作用[110]。Tan 等[111]证明,按田间使用剂量,长期暴露于氟吡呋喃酮中会削弱亚洲蜜蜂幼蜂和成蜂的嗅觉学习能力。Hesselbach等[112]将亚致死剂量(830 μmol/L)的氟吡呋喃酮作用于夏季蜜蜂以及越冬蜜蜂,结果均可引起运动障碍并干扰正常的运动行为,且这种影响在越冬蜜蜂上更加强烈,但连续投服24 h 以上这种影响会减弱。此外,氟吡呋喃酮还会影响蜜蜂的体温调节能力[113]和飞行能力,使觅食提前[114],增加蜜蜂的氧化应激并诱导细胞凋亡[115],在400 μg/kg 的田间剂量下,氟吡呋喃酮会减少蜜蜂的生存机会并损伤其行为[116]。虽然大量的研究表明氟吡呋喃酮对蜜蜂有一定的影响,但其在急性或短期慢性田间实际剂量下都不会改变蜜蜂对蔗糖的反应性[117],也不会影响蜜蜂的觅食行为[118]。Haas 等[119]研究发现,蜜蜂表达的3 种P450 细胞色素CYP6AQ1、CYP9Q2和CYP9Q3可以有效代谢氟吡呋喃酮,且代谢产物对蜜蜂几乎无毒。定量PCR 分析证实,蜜蜂在所有生命周期中均表达此3 种细胞色素,这表明蜜蜂在所有生命阶段都具有代谢氟吡呋喃酮的能力,这一发现解释了氟吡呋喃酮对蜜蜂低毒的机理。
由于新烟碱类杀虫剂具有环境持久性和高水溶性,容易渗入地表水,因此研究氟吡呋喃酮对非靶标水生昆虫产生的负面影响也很重要。有研究表明,氟吡呋喃酮对蜗牛和淡水贝壳几乎无害,但是会影响淡水浮游生物的生存和生长[120-121]。相较于其他新烟碱类杀虫剂,氟吡呋喃酮对浮游生物表现出中等程度的毒性[122]。
由此可见,虽然在规定剂量下使用,氟吡呋喃酮对蜜蜂和大黄蜂几乎无害,但在高剂量以及长期使用时,其对蜜蜂具有一定的亚致死效应,例如影响蜜蜂的运动能力、嗅觉、学习能力、体温调节能力等,因此在氟吡呋喃酮的研究和使用过程中应予以重视。
6 氟吡呋喃酮的结构修饰
目前氟吡呋喃酮的合成路线主要有3 条,即吡啶部分、二氟乙胺部分和丁烯内酯3 个片段的不同组合[123-125],对此相关文献已经有了详细的总结[126-128],在此不再赘述。
由于氟吡呋喃酮结构的新颖性,自上市以来就成为了研究的热点。2014 年杜邦公司Zhang 等[129]以早期专利[54]中的化合物1 为先导,合成了2-唑酮化合物2 (图式4),该化合物对桃蚜和玉米飞虱具有良好的杀虫活性。2015 年Urch 等[130]在申请的农业领域作为杀虫剂和杀螨剂的化合物专利中,包含了6 个针对氟吡呋喃酮结构改造的化合物 (图式4),其中化合物3 和5 去掉了丁烯内酯结构,且二氟乙基分别替换为酯基链和1,1-二甲氧基乙基;化合物7 是在氟吡呋喃酮的基础上,关环得到了一个含有吡咯并呋喃酮结构的化合物;化合物4、6 和8 与氟吡呋喃酮结构类似,只是其中二氟乙基分别被替换为酯基链、1,1-二甲氧基乙基和氰基甲基,但这些化合物对蚜虫和蛛螨的活性均较差,还需要进一步的结构优化和活性评价。
2015 年范志金课题组[131]用酰氧基或氰基甲基替换丁烯内酯结构,合成了一系列噻唑取代化合物(图式4),其中化合物9 和10 在100 μg/mL 下对蚜虫的致死率分别为85.3%和75.6%。2016 年,该课题组[132]又公开了一类含二氟乙基的杂环化合物,该发明以氟吡呋喃酮为先导化合物,保留二氟乙胺部分,对其余两部分进行修饰,例如将丁烯内酯替换为吡啶或异噻唑甲基,噻二唑甲基或甲酰基以及酯基,探讨丁烯内酯部分被含硫杂环取代后,或者丁烯内酯环被打开后对活性的影响;另一个修饰方向是将吡啶基替换为异噻唑,看活性是否会有显著变化,结构式见图式5 所示。生物活性测定结果表明,这类化合物均表现出一定的抑菌活性,同时在100 μg/mL 下,用药72 h 后部分化合物对蚜虫表现出较好的毒杀作用,其中化合物15 在该质量浓度下对蚜虫有100%的致死率,与现有新烟碱类杀虫剂(如噻虫胺、吡虫啉)相比,活性更好;另外部分化合物对烟草花叶病毒也表现出一定的抑制作用。可见,丁烯内酯作为关键药效基团,在结构修饰时将其保留更容易发现高活性的化合物。
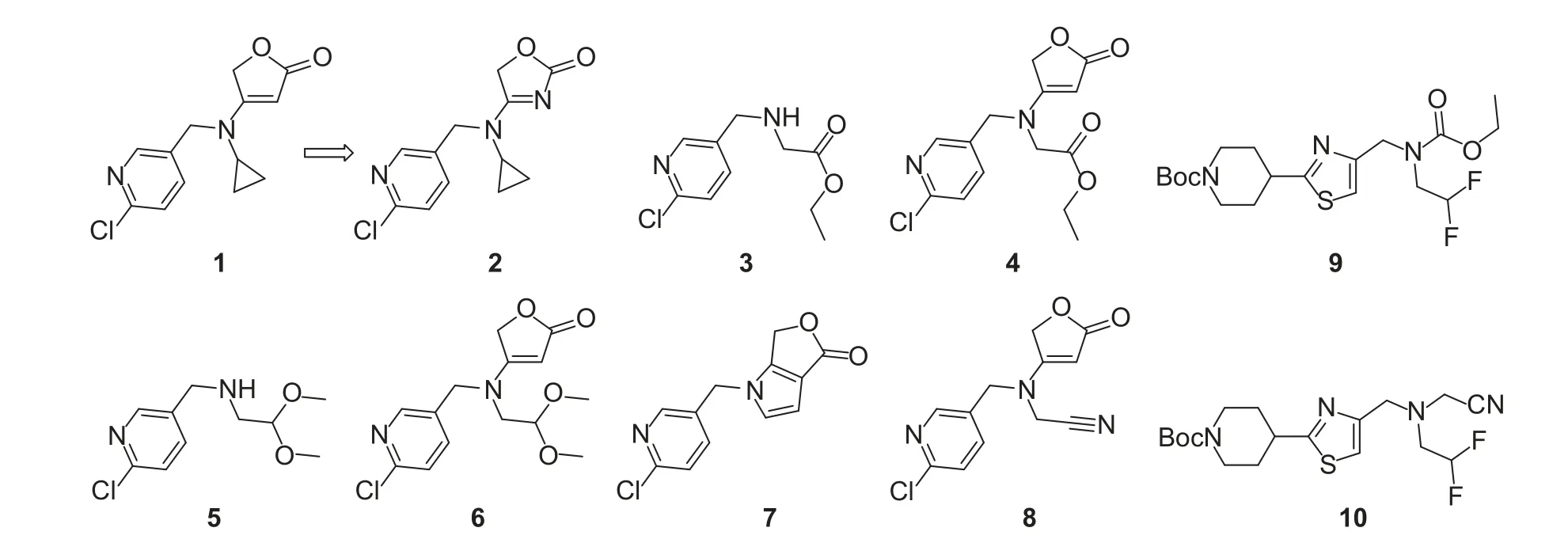
图式4 化合物1~10 的化学结构式 [129-131]Scheme 4 Chemical structures of compounds 1-10[129-131]
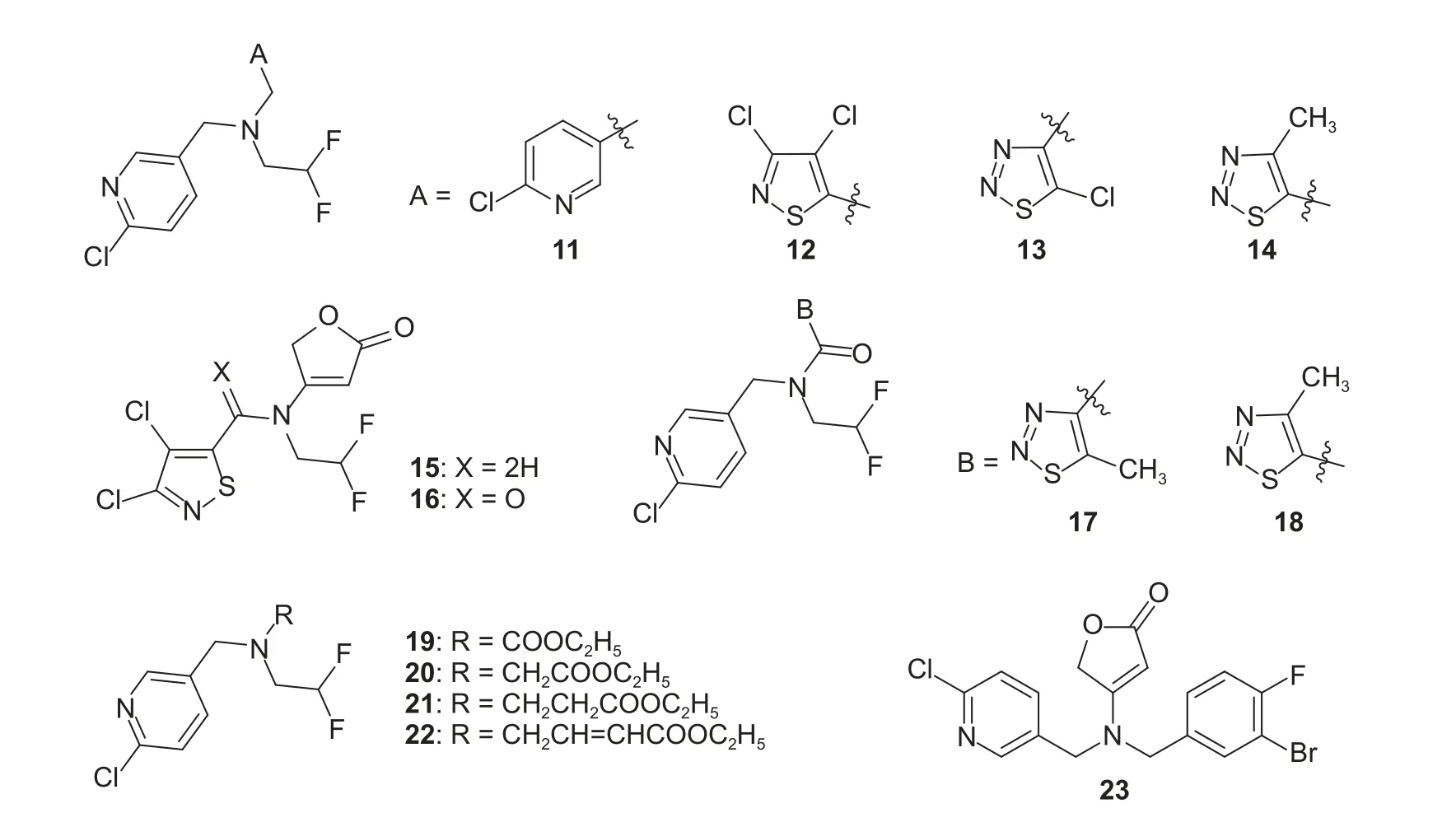
图式5 化合物11~23 的化学结构式[132-133]Scheme 5 Chemical structures of compounds 11-23[132-133]
2019 年宋宝安课题组[133]在对氟吡呋喃酮结构修饰过程中,发现对二氟乙基部分的微小改变以及将6-氯吡啶替换为其他杂环均会导致杀虫活性明显降低,因此他们认为对氟吡呋喃酮的修饰应该保留吡啶以及丁烯内酯两个部分,而对二氟乙基部分进行结构改造。在众多农药分子结构中,大都含有卤素取代的苯基,因此设想将含卤素的苯基引入氟吡呋喃酮分子结构中,替换其中二氟乙基部分可能会得到活性更好的化合物。基于这一设计思路,他们合成了N,N-二芳甲基呋喃酮衍生物,部分化合物对苜蓿蚜Aphis craccivora表现出较好的杀虫活性,且当苯环4 位含有氟原子时活性更好,其中代表化合物23 对苜蓿蚜的半致死浓度 (LC50) 为1.72 μg/mL,优于对照药剂吡蚜酮(LC50= 6.86 μg/mL)。通过分子对接发现,化合物23 缺少CYP6CM1的氧化代谢基团,没有对吡虫啉类似的代谢抗性。研究表明,该化合物对苜蓿蚜的神经系统、代谢、免疫功能和骨架蛋白也有较大的影响,另外它也可能是一种潜在的作用于乙酰胆碱受体的杀虫剂,因此可以作为高活性先导化合物进行进一步结构优化。
2019 年王先浩等[134]以氟吡呋喃酮为先导化合物,与具有丁烯内酯的天然产物相结合,设计合成了一系列含烷氧基取代的丁烯内酯衍生物(图式6)。生物活性测定结果显示,大多数化合物在100 μg/mL 时对苜蓿蚜和稻褐飞虱Nilaparvata lugens有中等强度的致死活性;构效关系分析发现,当X = Br 时,R1烷基链越长,活性越弱,甲基活性最高,R2基团含氟时活性更好;另外,X =Cl 或H 时,相较于Br,化合物对苜蓿蚜的活性有明显的提高,且对稻褐飞虱的活性高于苜蓿蚜;当用药浓度降低到4 μg/mL 时,化合物24 (X =Br, R1= CH3, R2= CH2CH2F)对两种害虫依然有60%和75%的致死率,其可以作为新的先导化合物进行结构优化。
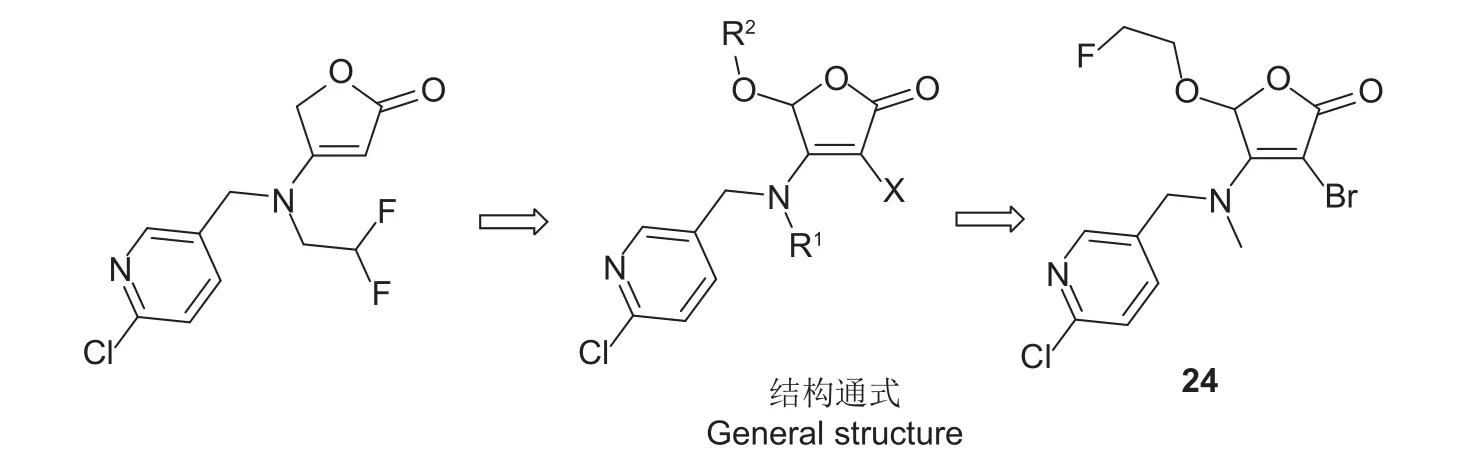
图式6 烷氧基丁烯内酯类化合物的设计思路[134]Scheme 6 Design strategy of the alkyloxy butenolide compounds[134]
2020 年田忠贞等[135]在王先浩[134]的研究基础上,采用骨架跃迁以及生物电子等排策略,用高效杀微生物剂4,5-二氯-1,2-二硫环戊烯酮结构替换氟吡呋喃酮结构中的丁烯内酯药效团,期望能够发现活性更好且含二硫环戊烯酮结构的先导化合物,在此基础上将吡啶环替换为噻虫嗪中间体2-氯-5-氯甲基噻唑,考察不同杂环对活性的影响。合成路线如图式7 所示,以四氯乙烯为起始原料,首先合成4,5-二氯-1,2-二硫环戊烯酮,再与中间体经过迈克尔加成-消除反应得到一系列全新结构的化合物。杀虫活性测试表明,在100 μg/mL时,所有化合物均对苜蓿蚜和稻飞虱有一定的杀虫活性,但整体活性均低于对照药剂氟吡呋喃酮。通过构效关系分析,只有当结构中含有吡啶环以及R 为含氟基团,尤其是二氟乙基时活性最好。
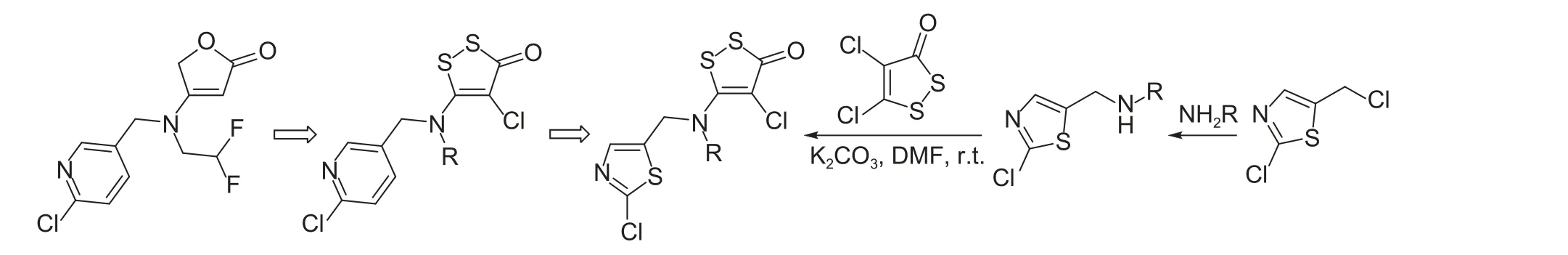
图式7 目标化合物的合成路线[135]Scheme 7 Synthetic route of the target compounds[135]
2020 年,在东阳光农药研发有限公司申请的专利中,将2,2-二氟乙基替换为五元杂环、六元杂环、二苯醚等结构,合成了一系列氟吡呋喃酮衍生物[136-138](图式8),其中部分化合物具有较好的杀虫活性,如化合物25 对蚜虫、黏虫、粉虱和小菜蛾等具有良好的杀虫活性;化合物26 在200 mg/L 下对黏虫的致死率超过80%;化合物27 在100 mg/L 下对粉虱的致死率为100%,优于氟吡呋喃酮。
2020 年,Mesquita 等[139]报道了4 个氟吡呋喃酮类似物28-31 (图式8),与氟吡呋喃酮结构相比分子中缺少了二氟乙基,且丁烯内酯部分被替换为含氟取代的苯基。生物活性测定结果显示,在48 h 内化合物28, 29, 30 在低浓度下显示出较高的杀幼虫活性,LC50值分别为0.57、 0.97 和 0.90 μg/mL,与氟吡呋喃酮(LC50= 1.18 μg/mL) 相比活性更好。通过分子对接,发现新化合物活性更好的原因可能是其与昆虫乙酰胆碱受体有着独特的结合方式以及含氟苯基的引入有关,但化合物31 的杀虫活性不高。通过光分解试验发现,虽然在水体系中化合物29 在阳光直射下会很快降解,但活性并不会因此而降低。
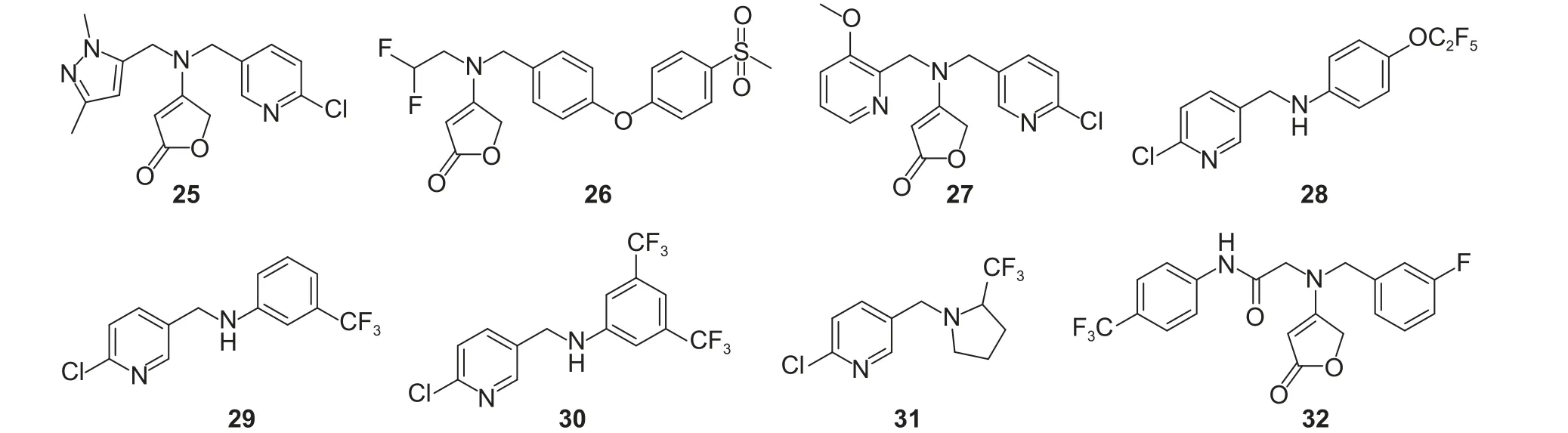
图式8 化合物25~32 的化学结构式[136-140]Scheme 8 Chemical structures of compounds 25-32[136-140]
2021 年胡德禹课题组[140]以氟吡呋喃酮为先导结构,用酰胺结构替换6-氯吡啶,设计合成了一系列新型丁烯内酯衍生物。生物活性试验发现,该系列化合物未表现出杀虫活性,但表现出了良好的抗菌活性。化合物32 (图式8)对米黄单胞菌Xanthomonas oryzae pv. oryzae的离体EC50值为35.8 mg/L,在100 mg/L 下,对其引起的水稻白叶枯病的防治效果为49%。作用机制研究表明,该化合物可以激活植物中特定的细胞防御相关酶以及上调参与氧化磷酸化的蛋白水平。
本课题组赵宇等[141]在新农药创制过程中,希望在氟吡呋喃酮的丁烯内酯5 位引入螺环或偕二甲基骨架,得到新的具有杀虫活性的先导化合物,但在实际合成过程中(图式9),发现中间体与2-氯-5-氯甲基吡啶反应时,并没有发生N-烷基化反应,而是在羰基的α-位发生了区域选择性C3-烷基化反应,意外得到一类全新结构的位置异构体类化合物,遗憾的是该类化合物没有明显的杀虫活性。
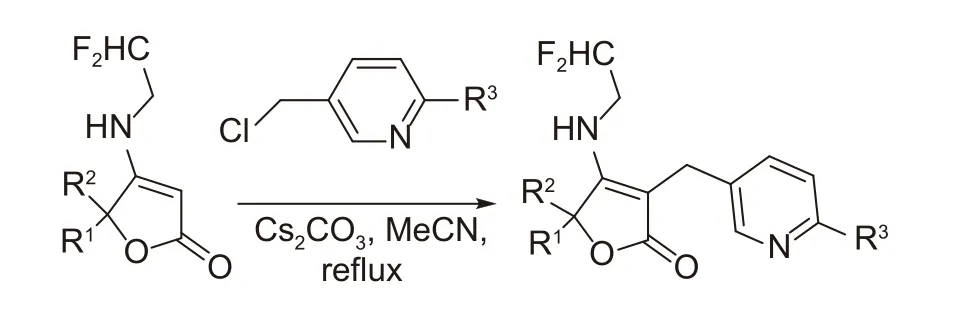
图式9 区域选择性C3-烷基化合成路线[141]Scheme 9 Synthetic route of the regioselective C3-alkylation[141]
在此基础上,为了得到预先设计的目标化合物,赵宇等[142]开发了一种在无催化剂条件下4-羟基烷基-2-炔酸乙酯与N-杂环芳基甲基-N-2,2-二氟乙基-1-胺的串联反应(图式10),成功实现了目标化合物的合成,即以氟吡呋喃酮为先导化合物,在丁烯内酯5 位成功引入了偕二甲基或取代环己基。杀虫活性测试结果表明:在供试药剂质量浓度为600 μg/mL 下,取代基R1及R2均为甲基,R3为卤素或甲氧基时,化合物对桃蚜的致死率为60%~100%,对黏虫的致死率为50%~85%;当R1,R2为甲基,R3分别为F、Cl、Br 取代吡啶时,化合物对桃蚜的致死率大于90%。初步构效关系表明,当取代基R1及R2组成螺环己基以及杂环为(取代)嘧啶时化合物均失去杀虫活性,表明5 位碳的空间位阻和杂环类型对杀虫活性具有至关重要的影响。

图式10 无催化剂的串联反应合成路线[142]Scheme 10 Synthetic route of catalyst-free tandem reactions[142]
最近段红霞等[143]设计合成了两类含有取代苯乙烯基和丁烯内酯为特征的新型氟吡呋喃酮结构类似物(图式11),生物活性测试结果显示,该类化合物对大豆蚜具有一定的杀虫活性,但活性不及对照药剂吡蚜酮、吡虫啉和氟吡呋喃酮。此外,该类化合物对植物病原菌表现出一定的杀菌活性。
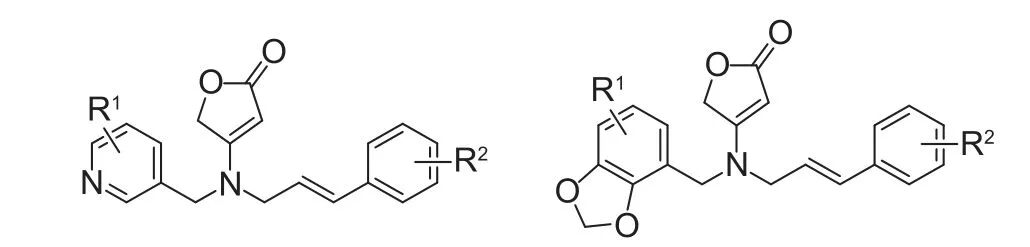
图式11 两类含取代苯乙烯基和丁烯内酯的氟吡呋喃酮结构类似物[143]Scheme 11 The two types of flupyradifurone analogues containing substituted styryl and butenolide[143]
以上结果显示,人们对氟吡呋喃酮的化学结构进行了多角度的修饰和优化,大多数化合物的杀虫活性不如对照药剂,即使少数化合物的活性略好于氟吡呋喃酮,也还缺少大田试验数据的支持,可见通过对氟吡呋喃酮的结构修饰来发现高活性杀虫剂仍需要通过科学家的大量研究工作来实现。
7 展望
氟吡呋喃酮以其结构新颖、对蜜蜂低毒、与现有新烟碱类杀虫剂无交互抗性等特点,自上市以来便成为新农药创制研究的热点。本文综述了氟吡呋喃酮的创制过程、生物活性、作用机理、残留代谢、对蜜蜂等非靶标生物的影响以及结构修饰及目前存在的抗性问题,重点对以氟吡呋喃酮为先导化合物进行的结构修饰进行了阐述。就目前文献中报道的结构修饰结果来看,主要是对丁烯内酯和二氟乙基进行的结构改造,例如在丁烯内酯上再引入其他取代基或把丁烯内酯替换为其他含氮、含硫的杂环,或者将二氟乙基替换为其他取代基等,虽然结构与氟吡呋喃酮差别较大,但低浓度下与氟吡呋喃酮相比,一些化合物具有更优的杀幼虫活性,但是这些结果仍缺少大田试验数据的支持。由此可见,氟吡呋喃酮的结构改造对发现新的先导化合物具有重要意义,但仍需要通过科学家的大量研究工作来实现这一目标。本文对氟吡呋喃酮的研究进展进行系统总结,希望可以为相关的研究者提供新的思路和参考,以期发现活性更好的新化合物,创制出具有中国自主知识产权的新农药。
