苦荞全基因组SSR位点挖掘及遗传多样性分析
2022-06-14左茜茜宋英杰马心妍杨云卉王轶菲郭泽光朱雄智刘越
左茜茜 , 宋英杰 , 马心妍 , 杨云卉 , 王轶菲 ,郭泽光, 朱雄智, 刘越*
(1.中央民族大学民族地区生态环境国家民委重点实验室,北京 100081;2.中央民族大学生命与环境科学学院,北京 100081)
苦荞(Fagopyrum tataricum L.Gaerth)又名鞑靼荞麦,属双子叶蓼科(Polygonaceae)荞麦属(Fagopyrum Mill),是一种典型的药食同源小宗作物[1-2]。我国苦荞种植历史悠久,种植面积和产量均位居世界前列,不仅是苦荞的集中分布区,也是该物种的扩散源[3]。苦荞因其生长快速、适应性强、抗逆性优异和活性成分丰富的优点,成为我国云贵川高原、青藏高原、甘肃甘南、鄂湘武陵山区丘陵山地等地区的重要粮食作物之一[4-6]。研究证实,苦荞含有大量对人体有益的物质[7],包括具有抗菌、保肝、抗癌等生物功能的蒽醌类[8-9]及对心血管系统、消化系统、内分泌系统等具有广泛调节作用的黄酮类[10]和醌类等化合物。
分子标记是遗传多样性研究的主要方法。随着苦荞全基因组[11]及相关组织转录组测序数据的公布,SSR(simple sequence repeat)标记[12]在苦荞种质资源研究中的应用非常广泛。但相比于其他植物,苦荞的分子标记技术起步较晚,所开发的SSR数量有限,无法满足其资源鉴定、分子育种和功能基因发掘等方面的需要,且目前对苦荞基因组染色体序列SSR位点挖掘有限[13],主要是通过转录组序列获得[14-18]。因此,本研究利用GenBank数据库中苦荞的8条染色体基因组序列对每条染色体特异性的SSR位点进行挖掘,并筛选SSR多态性高的引物对苦荞样品进行遗传多样性评价,以期为苦荞种质资源的鉴定分析以及苦荞分子标记辅助育种奠定基础。
1 材料与方法
1.1 试验材料
SSR引物开发序列来自苦荞全基因组8条染色体(SAMN07780272)[11]。序列数据以.fasta文件形式从NCBI数据库(https://www.ncbi.nlm.nih.gov/genome/38383)获取。第1到8号染色体长度分别为 68.03、61.24、57.71、56.66、53.88、52.29、51.55、49.98 Mb,GC含量在38%左右。
SSR多态性检测和苦荞遗传多样性分析材料共计42份,由本课题组于2019年8月野外调查时收集并保存,包括从四川凉山彝族自治州3个县收集到的苦荞地方品种32份,科研单位提供的苦荞品种10份,其中中国西南野生生物种质资源库提供3份(四川攀枝花、西藏、河北野生苦荞样品各1份)、云南滇台中心提供3份(山西、云南、重庆黑苦荞各1份)、贵州师范大学提供4份(贵州黑苦荞3份、湖南黑苦荞1份),样品编号详见表1。
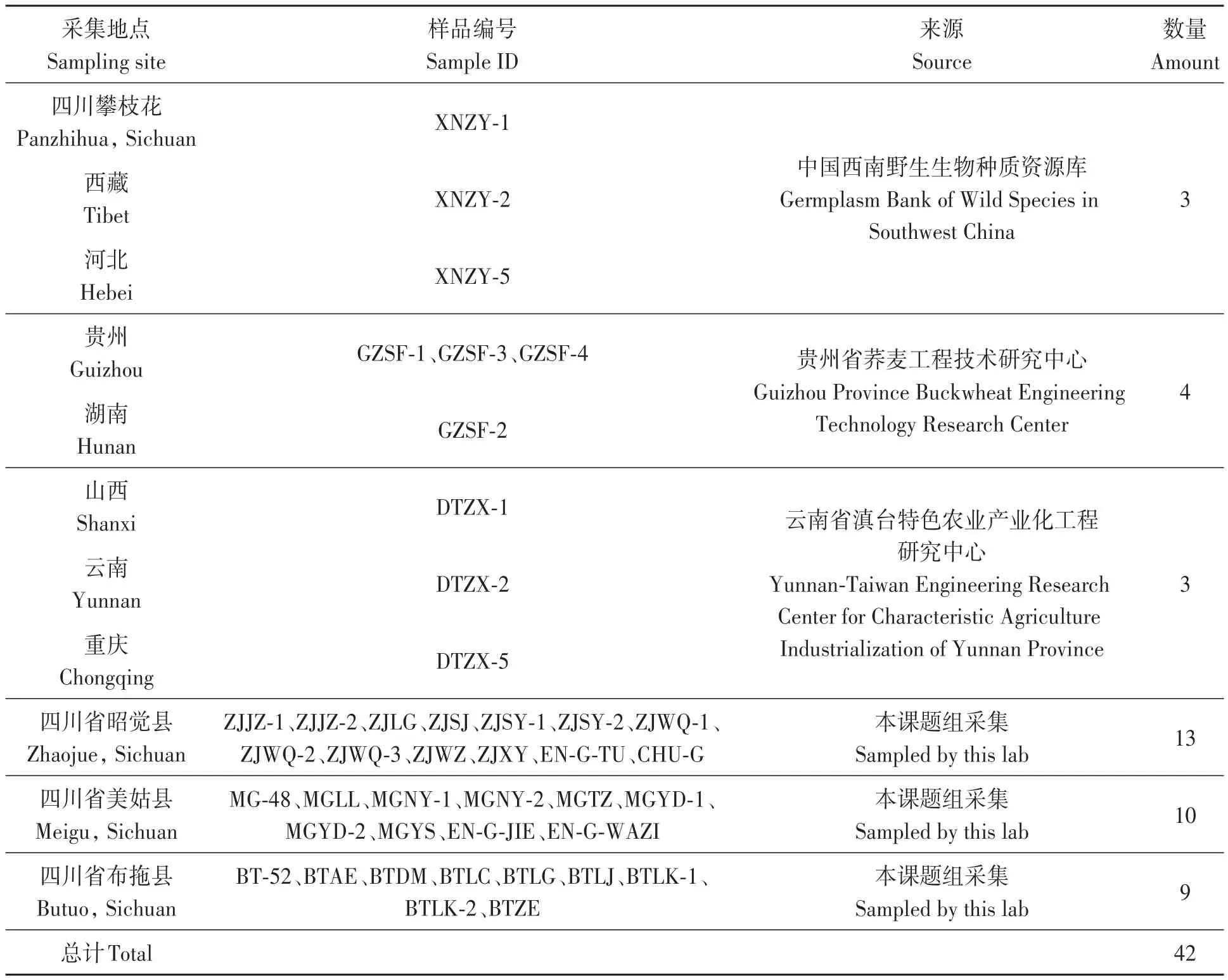
表1 42份样品来源Table 1 Origin of 42 samples
1.2 试验方法
1.2.1 DNA提取 2019年9月,42份材料恒温种植于中央民族大学民族植物学实验室培养箱(25℃,16 h光照,8 h黑暗)。每份材料在培养皿内种植20粒,于苗期收集鲜嫩叶片3~5片,利用剪刀剪碎,采用植物基因组DNA提取试剂盒(天根生化科技有限公司)提取DNA,利用Nano Drop 2000检测DNA质量,置于-20℃保存。
1.2.2 SSR开发 利用Perl语言环境下的MISA软件(http://pgrc.ipk-gatersleben.de/misa/)搜索苦荞8条染色体序列基因组的SSR位点,设置SSR检索标准:检索重复单元为2、3、4、5、6 bp,重复长度≥12 bp;二核苷酸最小重复次数≥6次(总长度不少于12个碱基),三至六核苷酸最小重复次数≥5次(总长度不少于15、20、25和30 bp)。利用Excel对二至六核苷酸重复基元SSR进行相关统计和比较分析。
1.2.3 SSR引物设计与筛选 采用Primer 3.0引物批量设计程序对二至六核苷酸重复类型以及复合的SSR位点两端序列设计特异性引物,目的产物大小在100~300 bp之间,引物由通用生物系统(安徽)有限公司合成。选取12份苦荞样品DNA混合建池用于筛选多态性引物。PCR反应体系20µL:DNA模板2µL,Taq0.2µL,正反引物各0.3 µL(20 µmol·L-1),0.4 µL dNTPs,2 µL Buffer和14.8µL ddH2O。PCR扩增反应程序:94℃预变性5 min;94℃变性30 s,54℃(退火温度在54℃上下波动)退火35 s,72℃延伸40 s,35个循环;72℃延伸3 min。每对引物的扩增产物随机抽取样品,取3µL进行1.5%琼脂糖凝胶电泳检测。将甲酰胺与分子量内标按100∶1的体积比混匀后,取15µL加入上样板中,再加入1µL稀释10倍的PCR产物,使用3730 XL测序仪(ABI)进行毛细管电泳。利用Genemarker中的Fragment(Plant)片段分析软件对测序得到的原始数据进行分析,将各泳道内分子量内标的位置与各样品峰值的位置做比较分析,得到片段大小。
1.2.4 数据处理与聚类分析 根据统计带型数据分析各个位点等位基因频率,利用PIC-CALC计算SSR位点的多态性信息含量PIC(polymorphism information content)。利用Popgene 3.2计算有效等位基因(Ne)、Nei’s指数(H)、Shannon-Weaver多样性指数(I)和遗传相似系数。利用软件NTSYS-pc 2.10进行UPGMA聚类分析。
2 结果与分析
2.1 苦荞基因组SSR位点特征分析
2.1.1 SSR出现的频率 苦荞8条染色体序列总长度约为451.34 Mb,共检出51 485个SSR,SSR位点平均发生率(检出的SSR个数与染色体总长度的比值)为114.07 Mb-1;苦荞基因组SSR种类较为丰富,二至六核苷酸重复类型均有,但各类型出现的频率相差较大。检出的苦荞SSR种类主要集中在二和三核苷酸重复,占总数的95.96%,且二核苷酸重复远大于三核苷酸重复,分别占78.20%和17.76%,四至六核苷酸重复所占比例较小,总计4.04%。各类型重复相对丰度(某类型重复SSR数量与染色体总长度比值)最大及最小者分别为二核苷酸(89.1 Mb-1)和六核苷酸(0.32 Mb-1)。逐条染色体分析可知,分布在每条染色体上SSR位点的数量和种类特征较为一致。1号染色体检出SSR数量最多(7 659个),其次是2号染色体(7 033个),检出数量较少的为7号(5 768个)和8号染色体(5 721个);SSR位点平均发生率最小的为4号染色体(116.24 Mb-1),最大的为7号染色体(111.89 Mb-1);二至四核苷酸重复基元数量最多者均为1号染色体,五核苷酸、六核苷酸重复基元数量最多的为2号染色体;二核苷酸、五核苷酸、六核苷酸重复基元数量最少的均为8号染色体,三核苷酸重复基元数量最少者为7号染色体998个,四核苷酸重复基元数量最少者为5号染色体。除了四核苷酸重复,其余重复类型的SSR数量在每条染色体上的趋势波动不大(图1)。

图1 8条染色体SSR各重复类型数量Fig.1 Number of SSR repeats on 8 chromosomes
2.1.2 SSR重复类型和比例 搜索到的苦荞基因组SSR共包含361种重复类型:二核苷酸重复类型有6种,三至六核苷酸重复类型分别有30、75、129和121种,每种类型的分布并不平均。从出现频率来看,二核苷酸重复类型中出现最多的为AT/TA,占SSR总数的69.60%,远远高于其他类型;其次,CT/GA的频率较高为4.29%;AG/TC、AC/TG、CA/GT出现的频率较低,所占比例较小。三核苷酸重复类型出现频率排名前3的为AAT/TTA、AGA/TCT和 ATA/TAT,分别占了 2.49%、2.10%和2.04%;其次AAG/TTC、CTT/GAA、ATT/TAA分别占1.67%、1.52%、1.51%;其他类型出现频率比较低。四核苷酸重复类型AAAT/TTTA(0.60%)和五核苷酸重复类型中AAAAT/TTTTA(0.06%)出现频率较高,六核苷酸重复类型出现频率都极低(表2)。

表2 苦荞基因组序列不同SSR的出现情况Table 2 Occurrence of different SSRs in tartary buckwheat genome sequence
逐条染色体分析可知,不同染色体上优势重复类型没有显著差异,数量上有一定变化。二核苷酸重复类型AT/TA在1号染色体数量最多(5 194个),在8号染色体数量最少(3 901个);三核苷酸重复类型AAT/TTA数量最多及最少分别为3号染色体(183个)及4号、6号和8号染色体(同为144个);四核苷酸重复类型AAAT/TTTA数量最多(60个)的为1号染色体,最少的为3号染色体(0个);五核苷酸重复类型AAAAT/TTTTA数量最多(9个)的为2号染色体,数量最少(0个)的为4号染色体;六核苷酸重复类型分布较为均匀,在每条染色上的数量变动较小。
2.1.3 SSR特异种类分布 对每条染色体上的重复基元类型、特异基元类型(唯一性)进行统计。各条染色体的特异基元类型主要集中在四至六核苷酸重复上,在二、三核苷酸重复上无分布(表3)。4号染色体可作为探究四核苷酸重复特异类型的最佳序列,特异类型包括AGTG/TCAC、ATAC、ATCA、CCAG、GGAG、GTTG和TAGG 7种;2号染色体可作为探究五核苷酸重复特异类型的最佳序列,包括AGAAA、ACATA、CCCAC、GTCCG和TATCT等14种;1号和2号染色体均可作为探究六核苷酸重复特异类型的最佳序列,每条染色体都有17种特异类型,其中1号染色体包括AATCTC、AGTGTA、 CAATAG、 CTTTCT、 GAGACT 和GGTTCG等,2号染色体包括ACCGCC、AGCAGA、CCAATC、CTTAGT、GGACGT和TCTCCC等。

表3 苦荞基因组SSR特异种类分布Table 3 Distribution of specific species of Tartary buckwheat genomic SSR
2.1.4 SSR重复次数和长度 随着重复次数的增加,所有类型的SSR数量均呈现减少趋势(图2)。5~15次为较低重复次数,分布有36 634个SSR,占总数的71.15%,说明低重复次数是苦荞基因组SSR的主要特点之一;大于15次为较高重复次数,分布有14 851个SSR,占总数的28.85%,其中14 388个为二核苷酸重复;最高重复次数是95次。
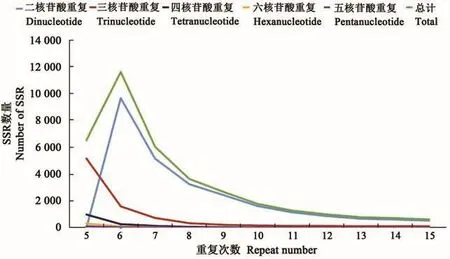
图2 苦荞基因组SSR重复次数分布Fig.2 Distribution of SSR motif repeat number in tartary buckwheat
苦荞全基因组SSR基序长度分布情况见图3。其SSR基序长度跨度较大,为12~228 bp;总的来说,基序长度在12~20 bp范围内的有29 827个,占57.93%;20~50 bp的SSR数量为11 715个,占22.75%,50~100 bp的SSR数量为9 033个,占17.54%,>100 bp的SSR数量为910个,占1.78%。检出的苦荞SSR基序长度主要集中在12~100 bp范围内(98.42%)。SSR基序的长度在每条染色体上呈现的变化趋势类似(数据未列出)。

图3 苦荞SSR基序长度分布范围Fig.3 Distribution range of SSR motif length of tartary buckwheat
2.2 苦荞基因组SSR引物的多态性检测
2.2.1 不同SSR引物类型分析 按照SSR在基因组中分布的比例共合成了156对引物(表4),其中,二核苷酸重复SSR引物119个,占76.28%,基序长度范围为12~128 bp,三核苷酸重复类型SSR引物26个,占16.67%,基序长度范围为15~69 bp,还有3个复合SSR引物。
通过毛细管电泳和DNA琼脂糖电泳对设计的156条特异性引物,从苦荞样品DNA分子材料中选取12份构建混合池对引物进行筛选。经检测,有120对引物可扩增出目的条带,有效比例为76.92%。保留扩增条带比较清楚明亮的引物,去除非特异性扩增的条带,共有17对引物具有较好的重复性和丰富的多态性(表4),多态性比率为10.90%。其中,二核苷酸重复SSR引物11个,占64.71%,基序长度范围为14~66 bp;三核苷酸重复类型SSR引物4个,占23.53%,基序长度范围为15、27、48和63 bp;还有2个复合SSR引物,基序长度为55和66 bp。

表4 不同SSR引物类型的统计Table 4 Statistics of different SSR primer types
2.2.2 引物多样性分析 用筛选的17对引物评价分析42份样品的遗传多样性,结果如表5所示。共产生114个等位基因,每个位点平均等位基因6.706个。引物P90等位基因数最高(14个),而引物P89最少,等位基因数为2个。所有扩增产物的片段在84 bp左右。每对引物的观察等位基因数(Na)和有效等位基因数(Ne)平均为6.706个(P90最高为14个,P89最低为2个)和2.718个(P91最高为5.188个,P89最低为1.214个)。各引物的Shannon多样性指数在0.397至2.101之间,平均值为1.155。P1的PIC值最高(0.794),P89的PIC值最低(0.161),17对引物的平均PIC值为0.499。观察杂合度(Ho)变化范围为0.048至1.000之间,平均值为0.881。

表5 17对引物遗传多样性信息Table 5 Genetic diversity information of 17 pairs of primers
2.3 苦荞遗传多样性分析
2.3.1 苦荞样品遗传多样性分析 根据42份样品的遗传相似系数,采用UPGMA进行聚类分析(图4)。在遗传相似系数为0.35时,可将42份样品划分为3类:第Ⅰ类只有1份样品,为四川省攀枝花市的野生苦荞(XNZY-1);第Ⅱ类共4份样品,包括2份野生苦荞样品(XNZY-2和XNZY-5,分别来自西藏和河北)、1份湖南样品(GZSF-2)及1份山西样品(DTZX-1);在凉山彝族自治州收集的苦荞地方品种(黑苦荞、普通黄苦荞)被聚为第Ⅲ类,共有37份样品,分为2个亚类(Ⅲa和Ⅲb)。Ⅲa包括3份黄苦荞样品(EN-G-TU、CHU-GE、ENG-WA-ZI)、3份美姑县黑苦荞样品、6份昭觉县样品和1份云南滇台中心样品(DTZX-2),共计13份样品;Ⅲb包括5份美姑县黑苦荞样品、5份昭觉县黑苦荞样品、9份布托县黑苦荞样品、3份贵州样品(GZSF-1、GZSF-3和 GZSF-4)、1份 重庆样 品(DTZX-5)和黄苦荞(EN-G-JIE),共计24份样品。

图4 苦荞资源遗传相似性聚类Fig.4 Clustering of genetic similarity of tartary buckwheat resources
2.3.2 苦荞样品群体多样性分析 根据苦荞地方品种的来源可将42个样品分为8个群体,主要包括3个凉山地区黑苦荞群体(Z群体、M群体、B群体)、2个凉山地区黄苦荞对照群体(E群体、C群体)和3个外地苦荞群体(D群体、X群体、G群体)。苦荞地方品种的群体遗传多样性如表6所示。观察等位基因数(Na)和有效等位基因数(Ne)的平均值分别为2.449个(Z群体昭觉县最高为3.471个,C群体CHU-GE最低为1.063个)和1.956个(M群体美姑县最高为2.406个,C群体CHU-GE最低为1.063个)。Shannon多样性指数(I)的平均值为0.630,8个群体中,M群体美姑县最高(0.899),C群体CHU-GE最低(0.043)。实际杂合度(Ho)、预期杂合度(He)和Nei指数分别为0.885、0.115和0.367。

表6 不同群体遗传分析统计Table 6 Statistics of genetic analysis of different populations
基于8个群体黑苦荞及苦荞地方品种的遗传距离(表7)进行UPGMA聚类分析(图5)。在遗传距离0.48处可将8个群体划分为3类,其中第Ⅰ类和第Ⅱ类都包含一个类群,分别为西南种子库野生苦荞和刺苦荞(CHU-GE);黑苦荞主要被聚为第Ⅲ类,该类包含了来自美姑、昭觉和布拖县的黑苦荞和黄苦荞。

表7 8个群体遗传距离Table 7 Genetic distance of 8 populations

图5 基于遗传相似性苦荞群体的聚类Fig.5 Clustering of tartary buckwheat populations based on genetic similarity
3 讨论
3.1 苦荞基因组SSR位点特征分析
常用多态性作为判定分子标记可用性的参考指标之一,SSR重复基元的长度对于其多态性具有重要影响[19]。通常重复基元长度在12 bp以下时SSR的多态性较低,长度在12~20 bp之间时多态性中等,长度>20 bp时具有高度多态性[20]。本研究从苦荞8条染色体序列中获得的SSR重复基元长度范围是12~228 bp,其中12~20 bp范围内的SSR占57.93%,>20 bp的SSR占42.07%。此外,一至三核苷酸重复属于低级重复基元,且低级重复基元类型的SSR多态性普遍要比高级重复基元类型高[21]。本研究检出的SSR重复基元类型以二、三核苷酸重复为主,占总数的95.96%。可以推断本研究开发的SSR位点具有潜在的高多态性。共设计合成156对引物,其中120对能扩增出条带,有效率约为77%,17对多态性较好的引物中不存在四碱基和五碱基重复基元,基序长度>20 bp的约占72%,与上述结果一致。
根据基因组序列数据,共获得51 485个SSR位点。SSR的分布频率为114.07 Mb-1,即相邻SSR位点的平均距离为8.76 kb。Hou等[22]预估苦荞基因组SSR出现频率为70.34 Mb-1;Fang等[23]挖掘苦荞基因组SSR频率为83.25 Mb-1;马名川等[13]对苦荞全基因组总长度为34.99 Mb的未组装序列进行SSR检测,平均每21.3 kb出现1个SSR位点。造成差异的原因为采用的基因组序列长度不同。此外,Fang等[23]同样基于苦荞8条染色体序列挖掘SSR,SSR分布频率为83.25 Mb-1,检索标准为一至六核苷酸重复次数最低为20、10、7、5、4、4,其结果差异可能与搜索标准有关[24]。苦荞基因组SSR分布频率低于同为双子叶的拟南芥[25]、喜马拉雅樱花[26]、向日葵[27],也低于单子叶植物益智[28],可能源于不同物种的基因组差异。苦荞基因组中SSR种类较为丰富,二至六核苷酸均有分布,但数量上有较大的差异,其主要类型为二核苷酸(78.20%)和三核苷酸(17.76%)重复,四至六核苷酸重复所占比例较小,总计4%左右,与光皮树[29]、杨梅[30]、玉米[31]和荞麦[32]的基因组序列开发SSR标记结果一致。同时以短重复基序为主要重复类型说明苦荞处于相对较高的进化水平。但与基于转录组序列进行SSR开发的结果不同,转录组序列SSR开发结果以三核苷酸重复类型数量居多[14-15,17]。此差异可能与基因组与转录组序列的特异性等有关,如三核苷酸在表达序列标签(expressed sequence tag,EST)里比较多,但其不会引起移码突变而影响基因功能。从基元类型来看,在苦荞基因组SSR中,二核苷酸基元以AT/TA为主,远远高于其他类型,碱基偏倚性明显,占SSR总数的69.60%,这与苦荞全基因组SSR[13]和普通荞麦种子EST微卫星标记[32]分析结果一致,也与枇杷[33]、丝瓜[34]基因组研究结果相同。三核苷酸重复基元种类较多,优势重复基元以AAT/TTA、AGA/TCT和ATA/TAT为主,与甘草[35]、灯盏花[36]、石榴[37]的全基因组SSR位点特征一致。但与苦荞EST-SSR[17]、普通荞麦EST-SSR[32]以AAG/TTC为主的研究结果有差异。不同物种重复基元优势类型的差异可能与物种基因组或序列的特异性等有关,也与其受到的选择压力不同有关。从重复次数来看,低重复次数是苦荞基因组SSR的主要分布特点,5~15次重复的SSR数量约占总数的71%,且随着重复次数的增加,每个重复类型SSR出现的频率减少。
从染色体层面看,分布在每条染色体上SSR位点的数量和种类特征较为一致。1号染色体检出SSR数量最多(7 659个,68.03 Mb),检出数量较少的为8号染色体(5 721个,49.98 Mb),通过对比染色体长度及SSR检出数量,发现SSR检出数量在一定程度上与染色体长度呈正相关;二至六核苷酸重复基元在每条染色体上的相对丰度差异不大,4号染色体SSR相对丰度(116.24 Mb-1)最大,7号染色体最小(111.89 Mb-1)。Fang等[23]研究表明,在苦荞基因组染色体中SSR在8号染色体上的相对丰度最高(81.19 Mb-1),其次是4号染色体(80.63 Mb-1)。1号染色体上的相对丰度最低(76.61 Mb-1),但1号染色体上的SSR标记数量最多(5 212个)。本研究结果与其有一定的一致性,但SSR的相对丰度在每条染色体上存在差异。仅四核苷酸重复基元在每条染色上的数量有较明显波动趋势,在对四核苷酸重复进行特异研究时可针对性地选择染色体;各优势重复基元数量在染色体的分布与也与染色体长度存在一定正相关,1号和2号可作为优势重复基元筛选的最佳序列材料;对每条染色体上的特异重复类型数量进行统计发现,特性重复类型主要存在于高级重复基元(四至六核苷酸重复)。本文对苦荞8条染色体序列上的特异性SSR进行分析,丰富了苦荞基因组SSR位点的信息,为之后育种筛选奠定基础。综合来看,无论从SSR出现频率、基元类型的丰度,还是重复次数及长度来说,1号、2号染色体可作为大量SSR开发的优质序列选择;通过对不同染色体所检出的SSR类型进行分析,发现不同染色体能检出的SSR种类具有特异性,研究者可根据不同科研需求,选择苦荞的不同染色体获得理想的SSR分子标记。
3.2 苦荞遗传多样性分析
本研究利用Primer 3.0软件设计了156对SSR引物,主要类型为二核苷酸重复。17对多态性较好平均等位基因为6.70个。比韩瑞霞[18]对不同地理来源的苦荞核心种质多样性研究时获得的平均3个等位基因数量高,也比Senthikumaran[38]对喜马拉雅地区荞麦多样性研究的平均6.5个等位基因高,造成的原因可能源于苦荞的来源地差异。PIC≥0.5时,该基因座位具有高度多态性;当0.25≤PIC<0.5时,为中度多态性;PIC<0.25时,为低度多态性[39]。17条多态性较好的引物扩增得到的PIC平均为0.499,具有较高的多态性。这一数据虽然较高帆等[40]获得的苦荞SSR标记的PIC平均值0.88低,但比杜伟等[14]获得的苦荞SSR标记的PIC平均值(0.4)高,为充分利用开发苦荞资源和完善苦荞遗传背景分析提供了参考。所有供试材料Shannon多样性指数为1.15,也表明在材料收集地苦荞地方品种具有较高的多样性。
利用17对引物对收集到的42份黑苦荞及苦荞样品进行多样性分析。结果发现,个体间普遍亲缘关系较近,且不止存在不同县的样品聚在一起的情况,同时其与云南、重庆、贵州的品种聚类也非常靠近,能与山西、湖南、西藏、河北的样品有明显区分。与云贵川的苦荞种质资源遗传多样性普遍高于其他区域苦荞遗传多样性,且普遍亲缘关系较近的结果一致[40-42]。基于不同群体遗传距离的聚类结果发现,不同群体苦荞种质资源没有明显的地理来源地分化。8个群体的聚类能将栽培苦荞与西南种质资源库提供的野生苦荞种质资源进行区分;美姑县的黑苦荞样品多样性最高,其次是昭觉县,布拖县的样品主要聚为同一分支,多样性显著低于另外2个县。结合课题组前期实地调查结果发现[43],美姑县和昭觉县种植的黑苦荞多于布拖县,而且在生活中,农民维持着以传统交换、购买等方式以获取苦荞种子,保持着频繁的种子交换,使得凉山彝族自治区内苦荞种子得以流动迁移;另外,美姑县提出了“四川美姑苦荞栽培系统”,高度重视苦荞栽培系统传统知识的挖掘与保护有关,鼓励当地人种植多种苦荞传统品种,一定程度上对苦荞地方品种多样性的维系具有良性作用。
本研究利用MISA软件对苦荞基因组8条染色体序列的二至六核苷酸重复的SSR位点进行挖掘并分析序列特征。挖掘的大量SSR特别是染色体特异性的SSR位点,对苦荞种质资源的鉴定分析以及苦荞分子标记辅助育种有重要意义。同时根据不同类型SSR位点设计合成引物进行多态性检测,获得了17对多态性较高的引物。用这17对引物对课题组前期收集的苦荞样品进行遗传多样性分析,也显示了SSR分子标记的可用性,以及黑苦荞的遗传多样性水平,对苦荞遗传多样性保护研究提供了新的途径。
