TiO2掺杂Cu-ZnO-Al2O3催化合成气制甲醇
2022-06-13蒋复国马琳鸽李永龙
韦 慧,张 凡,蒋复国,马琳鸽,李永龙
(北京低碳清洁能源研究院,北京 102211)
甲醇作为一种重要的化工产品广泛应用于多个领域,具有广阔的市场需求和发展前景。目前甲醇制备的“主流”合成工艺是以合成气(CO、H2、CO2)为原料,在一定温度、压力等条件下经过特定催化剂作用而制取。在甲醇合成反应中,研究最广泛的催化剂大致可分为两大类:即铜基甲醇催化剂和贵金属甲醇催化剂[1-5]。从较低成本和较高活性等优点考量,相对于贵金属催化剂,铜基甲醇合成催化剂(Cu-ZnO-Al2O3,缩写CZA)凭借其优点获得了更深入的研究及广泛的工业使用。在长期研究及使用中发现,尽管CZA基催化剂具有诸多优点,但因活性Cu组分易团聚、催化剂热稳定性差、失活较快等弱点制约了该催化剂的发展。为此,研究人员常常通过优化制备工艺和改性技术优化活性组分,进而提高催化剂的催化性能。此外,助剂改性也是影响催化剂活性的的重要因素。适宜的助剂掺杂可以通过调节活性金属的分散度、颗粒粒径、铜与载体的相互作用、催化剂的热稳定性和酸碱性等进而影响催化剂活性、选择性和寿命,因此对高效助剂的研究也被认为是科技工作者努力的方向之一。Meshkini F等[6]研究表明,向CZA中掺杂少量Mn、Mg和Zr等元素,能够影响催化剂活性组分Cu的分散状态、细化晶粒尺寸以及表面组成等,有利于催化剂活性和稳定性的提高。郝爱香等[7]以Zr、Ba和Mn助剂为研究对象,分别考察助剂对CZA基催化活性及热稳定性能的影响,研究发现,当以Ba或Zr作为助剂时能够极大地提高CZA基催化剂耐热前后的甲醇时空收率;而Mn的掺杂会降低CZA催化剂体系耐热前活性;Zr的掺杂有助于降低CZA催化剂最高活性的温度点,增强了CZA催化剂的催化稳定性。催化剂活性、选择性及稳定性是影响工业投资成本和生产周期等问题的重要因素,因此深入研究Cu基催化剂,制备出高活性、高选择性和低成本的催化剂依然是合成气制甲醇领域的重中之重。
TiO2作为一种应用广泛的光催化材料,不仅具有独特的物化性能,而且兼具无毒、成本较低等优点,也常被作为添加剂应用到众多领域。但在CZA催化体系中却鲜有文献报道TiO2掺杂CZA催化合成气制甲醇的研究[8]。一般认为,Cu/ZnO是CZA催化剂的活性组分,Al元素起结构助剂的作用。为了进一步调控催化剂的比表面积、酸碱性和活性组分的分散度,增强催化剂的催化性能及稳定性能,本文以TiO2为助剂,向CZA催化剂中加入不同量的TiO2,探究TiO2助剂以及添加量对催化剂表面结构、酸性能及催化性能的影响,分析催化剂的物化性质与催化性能的构效关系。目的在于寻找一种有效助剂,改善CZA催化和热稳定性能,为开发耐高热稳定性的铜基甲醇催化剂提供有价值的参考。
1 实验部分
1.1 材料与试剂
TiO2、Cu(NO3)2·3H2O、Zn(NO3)2·6H2O、Al(NO3)3·9H2O、Na2CO3,均为分析纯,国药集团化学试剂有限公司。
1.2 不同TiO2量改性的催化剂制备
实验室采用共沉淀法制备一系列TiO2掺杂改性的Cu-ZnO-Al2O3基甲醇催化剂(Cu∶Zn∶Al物质的量比为6∶3∶1),其中,每10 g的Cu-ZnO-Al2O3中按量分别加入0 g、0.5 g、1.0 g、2.0 g和3.0 g的TiO2助剂,对应标记为TiO2/CZA=0/10、0.5/10、1/10、2/10和3/10。按化学计量比,分别准确称取一定量的Cu(NO3)2·3H2O、TiO2、Zn(NO3)2·6H2O和Al(NO3)3·9H2O,将其共同溶解在去离子水中,标记为A溶液;再称取一定量的Na2CO3溶于去离子水中,配制成所需浓度的溶液,标记为B溶液。在70 ℃剧烈搅拌下,将A与B同时滴加,注意调节B的滴速以控制溶液pH=7.5~8.5;滴加结束后,在80 ℃继续搅拌老化2 h,待老化母液冷却至室温后,进行抽滤、反复洗涤,以达到去除沉淀剂所引入的钠离子的目的(判断的方式为:采用电导率仪测量洗涤水,确保沉淀物中几乎不含多余钠离子)。将洗净的沉淀置于马弗炉中,恒温110 ℃干燥12 h;之后以2 ℃·min-1的速率升温至350 ℃焙烧12 h。焙烧结束,样品自然降温至室温后,再经过压片、研磨和筛分等系统处理,最终获得(40~60)目的催化剂颗粒,分别用于后期的物化及性能评价测试。
1.3 催化剂结构表征
催化剂的形貌及颗粒大小采用德国布鲁克公司FEI Nova Nano 450扫描电镜(SEM)进行观察,将催化剂颗粒固定到导电胶上,在SEM模式下选定测试区域,调节测试电压为20 kV。
催化剂的比表面积、孔径和孔体积在美国麦克仪器公司Tristar II 3020多功能吸附仪上采用N2吸脱附法在液氮温度下(-196 ℃)表征。测试前,催化剂样品均在300 ℃真空脱气处理4 h[9]。
H2程序升温还原(H2-TPR)和NH3程序升温脱附(NH3-TPD)在美国麦克仪器公司Autochem 2920仪器上进行。(1)H2-TPR:装填量约为0.1 g,还原前先用氩气(Ar)在300 ℃预处理1 h,随后降温到50 ℃切换为10%H2-90%Ar(体积分数,下同)的还原气,流速保持为30 cm3·min-1;在升温还原阶段,初期先以2 ℃·min-1匀速升温速率至300 ℃,之后再以10 ℃·min-1升温至900 ℃,整个还原过程用热导池检测H2信号,最终得到H2-TPR图谱。(2)NH3-TPD:称取约0.1 g样品在He气氛中550 ℃热处理0.5 h,然后降温至50 ℃切换为10%NH3-90%He混合气,样品进行80 min的NH3吸附,再用He吹扫20 min去除物理吸附的NH3;最后,在He气氛中以10 ℃·min-1速率从50 ℃升温至600 ℃进行程序升温NH3脱附,整个升温脱附过程用热导池检测NH3信号,得到NH3-TPD图谱。
1.4 催化剂的催化活性评价
采用恒压固定床反应器进行催化剂评价实验。首先将相同目数的0.1 g催化剂颗粒与1 g石英砂(40~60)目按1∶10的质量比进行均匀混合。之后将以上混合物转移到不锈钢管式评价反应器中,通过管式炉进行程序升温加热,整个过程采用热电偶对反应器和管式炉的温度进行监测[10]。
在进行评价反应前,样品先在体积比为5∶95 的H2/N2混合气气氛下逐渐升温至230 ℃(常压下)完成预还原过程。在软件中设置好初始评价参数:温度230 ℃,压力5 MPa,空速10 000 h-1,选定反应物料,具体组分为(体积分数):80%H2、13%CO、2%CO2和5%N2(Air Liquide)的合成气。在进入反应器前,采用气体净化罐对原料气净化以除去可能残留的硫元素和氯元素。待催化剂样品结束预还原阶段,催化剂进入Stage Ⅰ评价环节:230 ℃,恒温45 h;Stage Ⅱ:提高反应器温度至320 ℃,恒温20 h,对催化剂进行热处理;Stage Ⅲ:将温度降至230 ℃,对热处理之后的催化剂活性再进行一次评价(25 h)。整个评价过程中,为了保持产物出口处的温度,在评价装置的末端均采用加热带进行包裹,随后通过冷凝器将甲醇和水分离到小瓶中;剩余气体由Agilent公司7890A型气相色谱仪在线检测。CO转化率采用内标法计算,甲醇收率和选择性通过碳平衡计算。
2 结果与讨论
2.1 SEM
图1为助剂掺杂前后Cu-ZnO-Al2O3催化剂的SEM形貌照片。由图1可知,在加入TiO2助剂前,TiO2/CZA比为0/10催化剂中的絮块状颗粒较多,且分散性较差。当加入少量TiO2助剂,即TiO2/CZA比为0.5/10催化剂呈现细小颗粒状,整体分布较为均匀,这有益于增大催化剂与合成气的有效接触面积,利于催化剂表面的活性位与反应气体的吸附和相互活化作用,进而促进催化反应的发生;同时小颗粒分散性增加,也有利于增强CuO和ZnO之间的相互作用[11-14]。据文献报道[11-14],高分散的CuO比大尺寸的CuO更容易还原,对甲醇合成的催化活性也较好。继续增大助剂含量发现(TiO2/CZA比大于0.5/10),过量助剂会使催化剂样品的微观形貌呈现出强烈明显的团聚现象。

图1 不同TiO2含量Cu-ZnO-Al2O3催化剂的SEM 照片Figure 1 SEM images oftheCu-ZnO-Al2O3 catalystwith different TiO2 content
2.2 H2-TPR
图2a为助剂TiO2改性前后Cu-ZnO-Al2O3催化剂在室温至900 ℃的H2-程序升温曲线。由图2a可知,所有催化剂样品的H2还原均出现在(100~200) ℃,整个还原过程表现出较为宽泛的氢气还原峰;图2b是相应5组样品在(120~200) ℃的局部放大曲线,对比发现在几组H2-TPR表征中部分样品出现多个还原峰或有明显的肩峰情况。由于Al2O3和ZnO较难还原,通常不会在低于200 ℃发生还原反应,因此可认为该处的H2消耗(还原峰)应归属于活性物种CuO的还原,与文献报道相符[15]。对于CZA基催化剂在H2-TPR表征中出现的多峰或肩峰的解释有较多的说法,其中有两类讨论得到更多的支持。一种解释是由于存在由外至内渐进还原过程,即先表面Cu2+、后体相Cu2+分步还原的结果;另一种解释是认为Cu元素先从Cu2+价还原到Cu+价,然后再从Cu+价还原到Cu0价的分步式还原结果[16-17]。由此可见,不管是单峰还是肩峰,在CuO-ZnO-Al2O3催化剂的H2-TPR曲线中都是较为常见的现象。对比助剂TiO2改性前后的H2-TPR曲线可以看出,助剂TiO2对CZA催化剂还原性能影响较大;随着TiO2加入量逐渐增加,催化剂中的CuO还原峰温度逐渐向低温方向移动,由改性前TiO2/CZA比为0/10催化剂的还原峰温158.2 ℃,逐渐降低至TiO2添加量为2.0 g时的147.1 ℃。但是当TiO2加入量达到3.0 g时,CuO还原峰温反而向高温方向回移。一般来说,相较于较大尺寸的CuO颗粒,细化、高分散的CuO比其更易还原,对合成气制甲醇反应的催化活性也更高[18-20]。结合SEM结果分析,认为适量TiO2助剂掺杂可以抑制样品烧结,提高CZA催化剂活性组分的分散性,改善其与合成气CO/CO2/H2的有效接触,同时有益于调变催化剂中CuO和ZnO之间的相作用,使得CuO变得更易于还原;但过量TiO2可能会覆盖活性Cu位点,使得催化剂表面暴露的CuO量减少,在氢气还原气氛下变得不易还原。
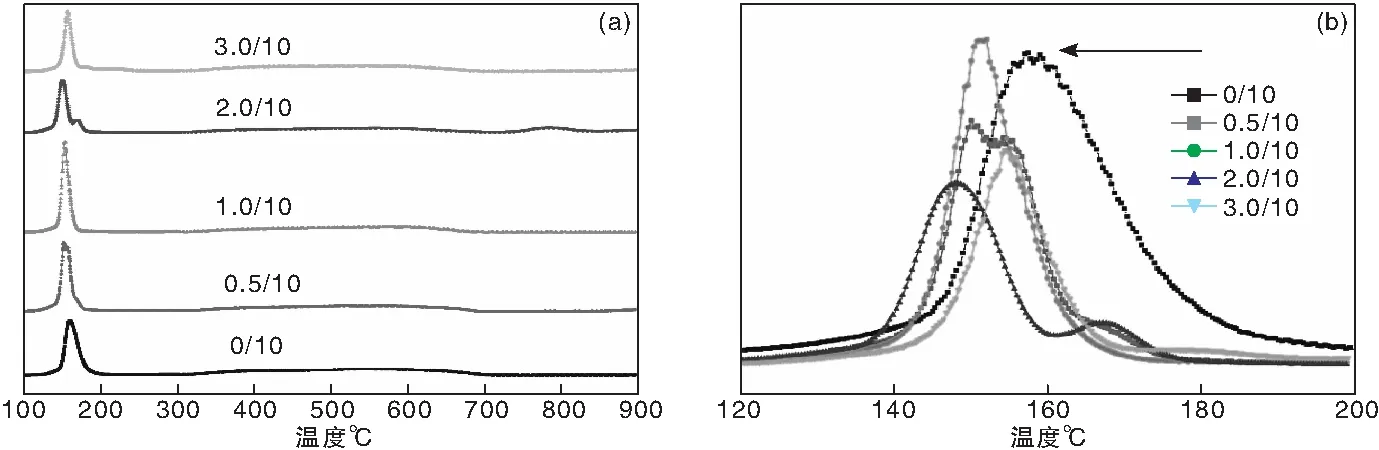
图2 不同TiO2含量CZA催化剂样品的H2-TPR曲线(a)和(120~200) ℃局部放大H2-TPR曲线(b)Figure 2 H2-TPR profiles ofthe CZA catalyst samples with different TiO2 contents(a)anddetailed patterns in the temperature range of (120-200) ℃(b)
2.3 NH3-TPD
催化剂载体表面酸度能直接影响金属与载体相互作用的程度和活性金属的分散状态[21-23],其中通过NH3-TPD可表征催化剂表面酸性位点分布情况。图3为助剂TiO2改性前后Cu-ZnO-Al2O3催化剂的NH3-TPD谱图。从图3可以看到,所有样品均存在3个酸中心位,即(100~200) ℃低温区的解吸峰peak 1归属为弱酸性位点的峰,在(300~400) ℃中温区的解吸峰对应中强酸中心的peak 2峰,在(500~600) ℃高温区的解吸峰对应强酸中心的peak 3峰。随着助剂TiO2加入量的逐渐增加,催化剂表面弱酸强度和酸量变化不明显,这可能与探测分子NH3在催化剂表面的物理吸附有关,它与样品表面的结合力较弱,在(低温~100) ℃时均容易脱附;但对中强酸和强酸中心(peak 2和peak 3)影响较大,说明助剂TiO2在一定程度上具有调变CZA催化剂表面酸中心的作用。其中,中强酸中心脱附峰位peak 2略向高温偏移,即中强酸中心强度略有增强,这可能是NH3与Al2O3及TiO2表面相互作用有所加强;而对比强酸位点,前3组助剂加入量为(0.5~2.0) g时,强酸中心强度无明显变化,但酸量(峰面积)明显均低于未加助剂的CZA催化剂,尤其是TiO2添加量为0.5 g的TiO2/CZA=0.5/10催化剂表面酸强度和酸量最小,有利于CO气体吸附和活化,进而和H2反应生成甲醇[24-25],这与后述发现TiO2/CZA=0.5/10的催化剂能得到最高甲醇收率的结果是一致。
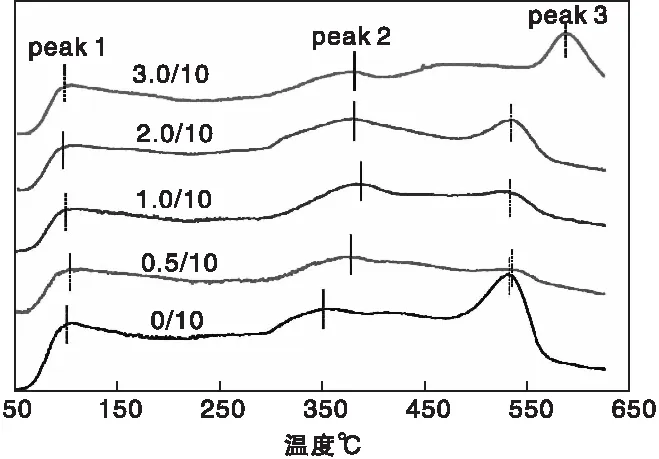
图3 不同TiO2含量CZA催化剂样品的NH3-TPD曲线Figure 3 NH3-TPD profiles of the CZA catalyst samples with different TiO2 content
2.4 比表面积与孔分布
催化剂的比表面和孔结构对优化催化剂的质量和选择性,提高产品收率具有重要意义。通常,比表面积越大对应颗粒的粒径越小,反之越大。表1列出助剂改性前后Cu-ZnO-Al2O3催化剂的比表面积、孔容及平均孔径。
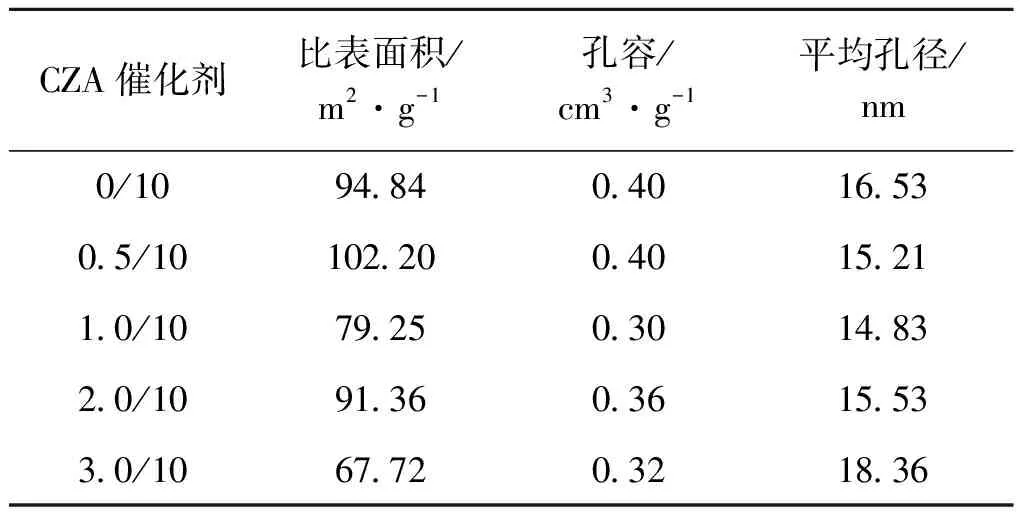
表1 不同CZA催化剂的织构参数
从表1可以看出,未添加助剂时,TiO2/CZA=0/10催化剂的比表面积为94.84 m2·g-1,孔容为0.40 cm3·g-1,平均孔径为16.53 nm;而添加0.5 g助剂之后,即TiO2/CZA=0.5/10催化剂的孔容不变,比表面积和平均孔径有不同程度的变化,说明少量助剂可增大催化剂的比表面积,有利于活性组分的分散,增强催化剂表面的活性位点;而过量助剂可能导致TiO2氧化物更易游离于载体表面,从而降低活性金属组分的分散度,并生成较大颗粒的聚集体。结合SEM和BET结果分析可知,适量TiO2助剂掺杂(如0.5 g)所获得的均匀细小颗粒及分布状态不仅提高了CZA催化剂的比表面积,又易于形成适当的孔径分布;而且还有利于提高催化剂的活性和稳定性。这主要是得益于催化剂母粒中微小颗粒的良好分散性,这种分散性的提高一方面可提高催化剂中活性组分的比表面积,另一方面可影响氧化物CuO和ZnO间的相互作用,进而影响催化剂的其他性能。
2.5 CZA催化剂的活性性能评价
催化剂的评价实验大致分为3个阶段,活化后的样品通过温控变化先匀速升温至230 ℃(Stage Ⅰ保温45 h),然后继续升温到320 ℃(Stage Ⅱ,保温20 h),最后又降至230 ℃(Stage Ⅲ,保温25 h),整个过程由GC在线记录CO转化率数据。由于CZA催化剂体系的甲醇选择性高,不同催化剂之间的甲醇选择性差别较小,这里主要以CO转化率为指标对催化剂的性能进行比较,通过比较320 ℃热处理前后的CO转化率,衡量TiO2的添加对催化剂热稳定性的影响。助剂TiO2对CZA催化性能随时间的影响见图4,催化剂在各阶段的CO转化率如表2所示。
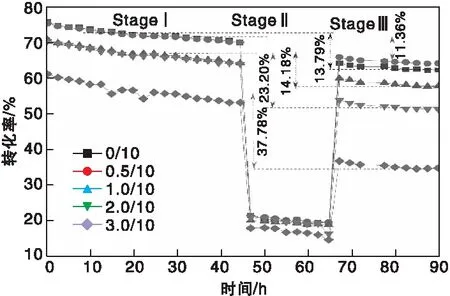
图4 不同TiO2含量CZA催化剂在评价实验中的CO转化率随时间变化曲线Figure 4 Time dependence of CO conversionover the CZA catalystswith different TiO2 content
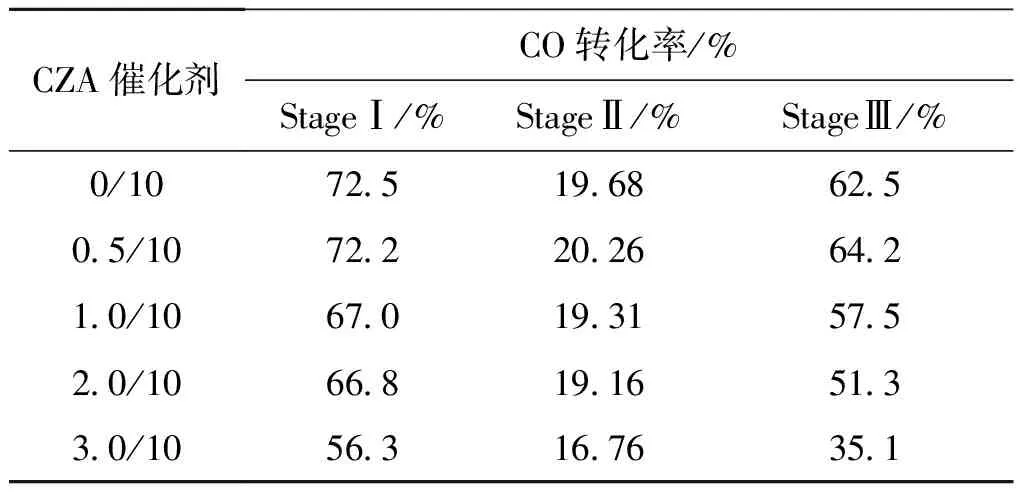
表2 各实验阶段CZA催化剂样品的平均CO转化率
由图4和表2可见,第一阶段(Stage I),当TiO2添加量为0.5 g时,与未添加助剂的0/10催化剂相比,表现出相当的CO转化率;随着助剂TiO2添加量的增大,CO转化率明显降低。由于合成气制甲醇(CO+H2/CO+H2)反应为放热过程,当评价温度升高至320 ℃时,反应朝着有利于副反应方向进行(如生成乙醇和二甲醚),但由于催化剂种类的受限,副产物的生成量较低,这部分增加的CO消耗量又不能够完全弥补甲醇生成速率降低带来CO消耗量的下降,因此各催化剂样品的CO转化率均有所下降。在Stage II热处理之后,5组催化剂样品的CO转化率相比Stage I阶段有不同程度的降低。由图4可知,5组样品的CO转化率在热处理后分别下降了13.79%、11.36%、14.18%、23.20%和37.78%;添加量为0.5 g的CZA=0.5/10催化剂样品下降幅度最小,说明TiO2在一定程度上提高了催化剂的耐热性;尤其在经历320 ℃、20 h的热处理,CZA=0.5/10催化剂样品仍然表现出优异的催化性能,甚至略微高于未掺杂助剂的CZA=0/10催化剂。这些结果表明,添加适量助剂的CZA=0.5/10催化剂表现出比其他4组样品具有更高的催化活性和热稳定性,而过量助剂CZA=3.0/10催化剂催化性能相对较差。可能是由于负载适量TiO2助剂的Cu-ZnO-Al2O3结构稳定性有所提高,助剂TiO2与有效组分的作用有利于催化剂活性的发挥;而过量负载反而导致催化剂表面金属聚集,覆盖活性位,进而影响催化剂对合成气CO/CO2和H2的吸附能力,导致转化率降低。
3 结 论
以TiO2为助剂,采用共沉淀法制备不同掺杂量的Cu-ZnO-Al2O3催化剂,通过SEM、N2物理吸附-脱附、H2-TPR以及 NH3-TPD等技术对催化剂进行表征,并进行催化剂催化性能评价,研究结论如下:
(1)TiO2助剂能影响Cu-ZnO-Al2O3催化剂的微观形貌和分布状态,其中适量TiO2助剂有助于细化催化剂的晶粒尺寸,提高了有效活性组分的分散性;同时提高了比表面积和总孔体积,进而影响其催化性能和热稳定性;
(2)随着TiO2添加量的逐渐增大,催化剂中的CuO还原峰温由改性前的158.2 ℃降低至147.1 ℃,当TiO2加入量达到3.0 g时,CuO还原峰温向高温方向回移;
(3)TiO2可调变催化剂表面酸性,尤其对中强酸和强酸中心影响较大。随着TiO2添加量增大,前者即中强酸中心强度略有增强,后者[前3组TiO2加入量为(0.5~2.0) g时]的强酸酸量(峰面积)明显均低于未加助剂的CZA=0/10催化剂,尤其是加入量为0.5 g的CZA=0.5/10催化剂表面酸强度和酸量最小,有利于反应气体吸附和活化;
(4)TiO2助剂掺杂能明显改变催化合成甲醇的性能,随着助剂添加量增大,相对应的催化剂上CO转化率呈现先升后降的趋势。当TiO2加入量为0.5 g时,即CZA=0.5/10催化剂表现出较优异的催化性能和热稳定性,尤其在经过320 ℃,20 h高温热处理后,依然保持约64%的CO转化率。
由于合成气制甲醇是强放热反应,所用Cu-ZnO-Al2O3基催化剂热稳定性受影响,严重时会直接造成催化剂失活。因此,下一步工作应加强对老化反应前后催化剂织构的变化及失活机理的探讨,为改性掺杂的优化工艺提供有价值的数据支持。
