长链非编码RNA变异性浆细胞瘤异位1通过调控微小RNA-214-3p/人凋亡抑制蛋白X轴影响皮肤黑色素瘤细胞的顺铂耐药性
2022-06-11胡珍吴庭孙弦刘睿
胡珍,吴庭,孙弦,刘睿
皮肤黑色素瘤(cutaneous malignant melanoma,CMM)是来源于黑色素细胞的皮肤恶性肿瘤,发病隐匿且易转移,近年来其发病率呈逐年上升趋势,给人类健康带来严重威胁[1]。目前,CMM的主要治疗手段是手术、放化疗等。顺铂(DDP)是一线化疗药物,抗肿瘤作用已被广泛认可,但由于黑色素细胞易形成耐药性,极大地影响了CMM的治疗效果及DDP的应用[2-3]。因此,深入探讨CMM化疗耐药相关基因及其分子调控相关机制,对寻找新型CMM化疗耐药分子靶点有较大意义。长链非编码RNA(long noncoding RNAs,lncRNAs)是一种反义RNA分子,不具有蛋白编码能力,能与靶基因非编码区特异性结合,调节基因转录和表达而发挥促癌或抑癌作用[4]。变异性浆细胞瘤异位1(plasmacytoma variant translocation 1,PVT1)是lncRNAs家族一员,既往研究显示,其在CMM病人癌组织中异常高表达,且体外研究表明抑制其表达后能显著抑制CMM细胞活性,促进细胞凋亡[5]。抑制PVT1可显著抑制结直肠癌耐药细胞株LoVo/DDP的增殖,增加其化疗敏感性[6]。微小RNA(microRNA,miRNA/miR)是一类非编码RNA,调节基因转录、表达,参与多种生理活动[7]。miR-214-3p作为常见的miRNA,被证实参与调控癌细胞活性[8],PVT1在乳腺癌组织中特异性高表达,降低miR-214的表达可增加乳腺癌细胞化疗耐药性。研究显示,过表达miR-214-3p可显著抑制肺癌细胞存活能力及多药耐药性[9]。目前,有关PVT1、miR-214-3p对CMM细胞DDP耐药性的影响及相关机制研究鲜有报道,因此本研究于2020年3—9月探讨PVT1与miR-214-3p对CMM耐药细胞生物学行为的影响,以期为临床寻找新型CMM化疗耐药分子靶点提高化疗效果提供一定参考。
1 材料与方法
1.1材料人皮肤黑色素瘤SK-MEL-1细胞株(BNCC100491)购自北纳创联(北京)生物技术研究院。RPMI培养基(3-2001)、蛋白提取试剂盒(BC3711-50T)、转染试剂盒(LipofectamineTM3000,EF010-E)购自美国艾美捷;3-2(4,5-二甲基噻唑-2)-2-四甲基偶氮噻唑蓝(MTT)(CS2905)、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)凋亡检测试剂盒(WK304)、核酸分离试剂(Trizol Reagent,YT526)、双荧光素酶报告基因检测试剂盒(KFS303-HUV)购自北京百奥莱博;兔抗人凋亡抑制蛋白X(XIAP)(201477-T36)、Bcl-2相关X蛋白(Bax)(ATA25287)、细胞增殖相关核抗原Ki-67(100130-MM21)、B细 胞 淋巴 瘤-2(Bcl-2)(FT-B3598S)、β肌动蛋白(β-actin)(ABP57456)一抗、辣根过氧化物酶(HRP)(羊抗兔,SE12-0.1)二抗均购自武汉益普生物;注射用顺铂(冻干型)(货号C14330-100mg,规格10 mg)购自山东齐鲁制药。PVT1-inhibitor及miR-214-3p-inhibitor购自上海吉玛。BBD6220培养箱购自美国ThermoFisher Scien‐tific;ELx800酶标仪、C1000定量PCR仪购自美国Bio-rad;CytoFLEX流式细胞仪购自美国Beckman。
1.2方法
1.2.1细胞培养 细胞株解冻后复苏,加入含10%胎牛血清的RPMI培养基中,培养箱中培养(5%二氧化碳,37℃,饱和湿度),每2~3天换液,传代培养,利用DDP浓度梯度法建立DDP耐药细胞株SK-MEL-1/DDP细胞,以5.33 mg/L DDP溶液维持细胞耐药性,在正式实验前1周更换不含DDP的培养液培养。
1.2.2细胞分组及处理 取对数生长期细胞株重悬,接种于24孔板(2.5×105个/孔),分为四组。(1)空白对照组(NG组):只含SK-MEL-1/DDP细胞,用含10%灭活胎牛血清+90%RPMI培液培养48 h;(2)阴性转染组(NC组):加入5μL LipofectamineTM3000和50μmol/L PVT1-inhibitor-NC,用含10%灭活胎牛血清+90%RPMI培液培养48 h;(3)抑制PVT1表达组(PVT1-inhibitor组):加入5μL LipofectamineTM3000和50μmol/L PVT1-inhibitor序列,用含10%灭活胎牛血清+90%RPMI培液培养48 h;(4)共转染组(PVT1-inhibitor+miR-214-3p-inhibitor组):加入5 μL LipofectamineTM3000和50μmol/L PVT1-inhibitor及miR-214-3p-inhibitor序列共转染后,用含10%灭活胎牛血清+90%RPMI培液培养48 h。严格按照转染试剂盒说明书操作,收集各组细胞用于后续实验。PVT1-inhibitor序列:5′-ACTTTAAGTGGAG‐GCTGAATCATCT-3′,miR-214-3p-inhibitor序 列:5′-ACUGCCUGUCUGUGCCUGCUGU-3′。
1.2.3实时荧光定量逆转录聚合酶链反应(qRTPCR)检测lncRNA PVT1、miR-214-3p、XIAPmRNA水平 TRIzol法提取培养48 h的细胞株总RNA,测定浓度。按照试剂盒说明书方法逆转录合成互补DNA(cDNA)。引物由苏州泓迅生物设计合成。2−ΔΔCt方法计算PVT1、miR-214-3p、XIAPmRNA水平相对表达量。
1.2.4MTT法检测细胞增殖能力及耐药性 取转染48 h后的细胞株接种于24孔板(2.5×104个/孔),每组6个复孔。细胞增殖能力检测:各组细胞均继续培养48 h后向各孔加入MTT 20μL,加入150μL二甲基亚砜振荡。在酶标仪490 nm处测定各孔细胞光密度。计算细胞增殖抑制率(%)=(1−实验组光密度值/对照组光密度值)×100%。耐药性检测:各组细胞分别加入0、2、4、8、16、32、64μg/L DDP溶液[10],100毫升/孔,继续培养48 h,其余操作同细胞增殖能力测定方法。计算细胞增殖抑制率且用线性回归法计算药物半数抑制浓度(IC50)值。
1.2.5流式细胞术检测细胞凋亡率 取转染48 h后的细胞株接种于24孔板(2.5×105个/孔),按照试剂盒说明书处理细胞,磷酸缓冲盐溶液(PBS)清洗后离心弃上清,PBS混匀沉淀,70%乙醇4℃固定24h。PBS清洗,加5μL PI+5μL AnnexinV‐FITC混匀,染色30 min、稀释后上机检测。
1.2.6蛋白质印迹法(Western blotting)检测蛋白表达 裂解细胞并提取总蛋白,电泳分离蛋白后转膜,以脱脂牛奶(5%)封闭,加入一抗Ki-67、Bcl-2、Bax、XIAP(1∶500),4℃过夜,清洗,加入二抗(1∶1 000)孵育1 h。显色、成像。分析蛋白含量。
1.2.7双荧光素酶报告基因检测PVT1对miR-214-3p的转录调控 TargetScan预测PVT1与miR-214-3p存在结合位点,扩增序列后构建含miR-214-3p结合位点的PVT1基因克隆载体,构建PVT1野生型质粒(PVT1-WT)和突变型质粒(PVT1-MT)。将PVT1-WT、PVT1-MT分别与miR-214-3p-inhibitor-NC、miR-214-3p-inhibitor共转染于SK-MEL-1/DDP细胞,分别为miR-214-3p-inhibitor-NC-PVT1-WT组、miR-214-3p-inhibitor-PVT1-WT组、miR-214-3p-inhibitor-NCPVT1-MT组、miR-214-3p-inhibitor-PVT1-MT组,具体转染步骤按“1.2.2”中进行;培养48 h后按照试剂盒方法,检测荧光素酶相对活性。
1.3统计学方法软件SPSS19.0分析数据。数据以±s表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,多组间的两两比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1各组SK-MEL-1/DDP细胞PVT1、miR-214-3p、XIAPmRNA水平比较与NG组、NC组比较,PVT1-inhibitor组SK-MEL-1/DDP细胞PVT1、XIAP mRNA水平显著降低(P<0.05),miR-214-3p显著升高(P<0.05);与PVT1-inhibitor组比较,PVT1-inhibi‐tor+miR-214-3p-inhibitor组SK-MEL-1/DDP细胞PVT1水平差异无统计学意义(P>0.05),miR-214-3p水平显著降低(P<0.05),XIAPmRNA水平显著升高(P<0.05)。见表2。
表2 各组人皮肤黑色素瘤SK-MEL-1/DDP细胞PVT1、miR-214-3p、XIAPmRNA水平比较/±s
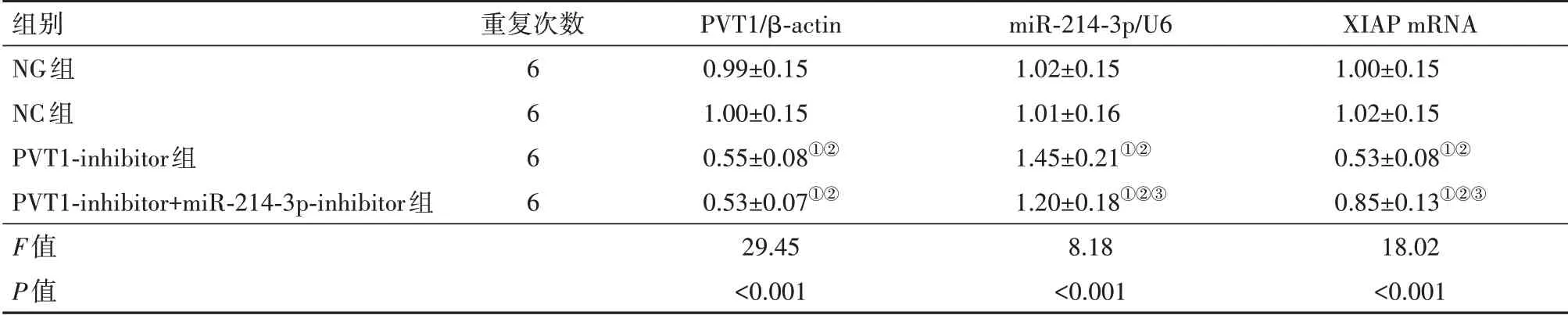
表2 各组人皮肤黑色素瘤SK-MEL-1/DDP细胞PVT1、miR-214-3p、XIAPmRNA水平比较/±s
注:PVT1为变异性浆细胞瘤异位1,β-actin为β-肌动蛋白,XIAP为人凋亡抑制蛋白X。①与NG组比较,P<0.05。②与NC组比较,P<0.05。③与PVT1-inhibitor组比较,P<0.05。
组别NG组NC组PVT1-inhibitor组PVT1-inhibitor+miR-214-3p-inhibitor组F值P值重复次数6 6 6 6 PVT1/β-actin 0.99±0.15 1.00±0.15 0.55±0.08①②0.53±0.07①②29.45<0.001 miR-214-3p/U6 1.02±0.15 1.01±0.16 1.45±0.21①②1.20±0.18①②③8.18<0.001 XIAPmRNA 1.00±0.15 1.02±0.15 0.53±0.08①②0.85±0.13①②③18.02<0.001
2.2各组SK-MEL-1/DDP细胞增殖情况比较NG组[(0.00±0.00)%]、NC组[(0.08±0.01)%]、PVT1-in‐hibitor组[(22.87±3.43)%]及PVT1-inhibitor+miR-214-3p-inhibitor组[(15.12±2.27)%]SK-MEL-1/DDP细胞增殖抑制率比较,F=184.10,P<0.001;与NG组、NC组比较,PVT1-inhibitor组显著升高(P<0.05);与PVT1-inhibitor组比较,PVT1-inhibitor+miR-214-3pinhibitor组显著降低(P<0.05)。
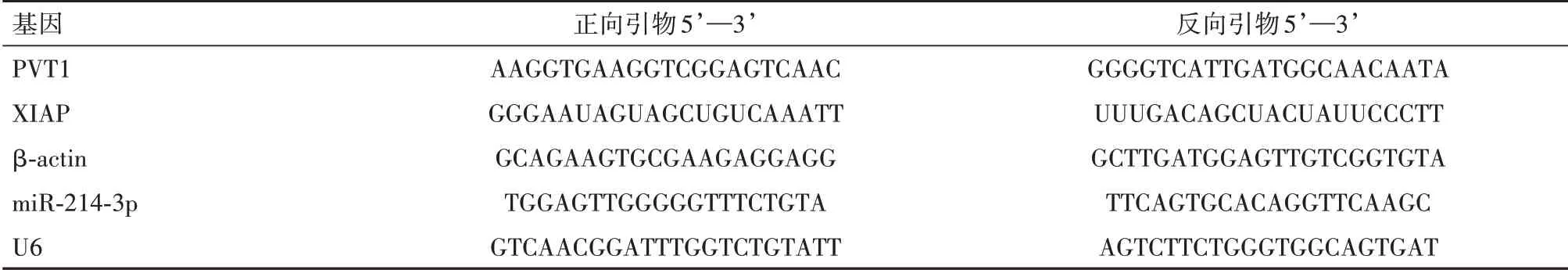
表1 实时荧光定量逆转录聚合酶链反应(qRT-PCR)引物序列
2.3各组SK-MEL-1/DDP细胞对DDP耐药性比较NG组[(45.03±1.35)μg/L]、NC组[(47.81±1.33)μg/L]、PVT1-inhibitor组[(15.13±0.45)μg/L]及PVT1-inhibitor+miR-214-3p-inhibitor组[(23.98±0.72)μg/L]SK-MEL-1/DDP细胞IC50比较,差异有统计学意义(F=1 418.74,P<0.001);与NG组、NC组比较,PVT1-inhibitor组显著降低(P<0.05);与PVT1-in‐hibitor组比较,PVT1-inhibitor+miR-214-3p-inhibitor组显著升高(P<0.05)。
2.4各组SK-MEL-1/DDP细胞凋亡情况比较NG组[(15.69±2.35)%]、NC组[(17.01±2.55)%]、PVT1-inhibitor组[(40.05±6.06)%]及PVT1-inhibitor+miR-214-3p-inhibitor组[(27.88±4.19)%]SK-MEL-1/DDP细胞凋亡率比较,F=46.48,P<0.001;与NG组、NC组比较,PVT1-inhibitor组显著升高(P<0.05);与PVT1-inhibitor组比较,PVT1-inhibitor+miR-214-3p-inhibi‐tor组显著降低(P<0.05)。
2.5各组SK-MEL-1/DDP细胞增殖、凋亡相关蛋白表达比较与NG组、NC组比较,PVT1-inhibitor组SK-MEL-1/DDP细胞Ki-67、Bcl-2蛋白显著降低(P<0.05),Bax显著升高(P<0.05);与PVT1-inhibitor组比较,PVT1-inhibitor+miR-214-3p-inhibitor组SKMEL-1/DDP细胞Ki-67、Bcl-2蛋白显著升高(P<0.05),Bax显著降低(P<0.05)。见图1,表3。
表3 各组人皮肤黑色素瘤SK-MEL-1/DDP细胞增殖、凋亡相关蛋白表达比较/±s
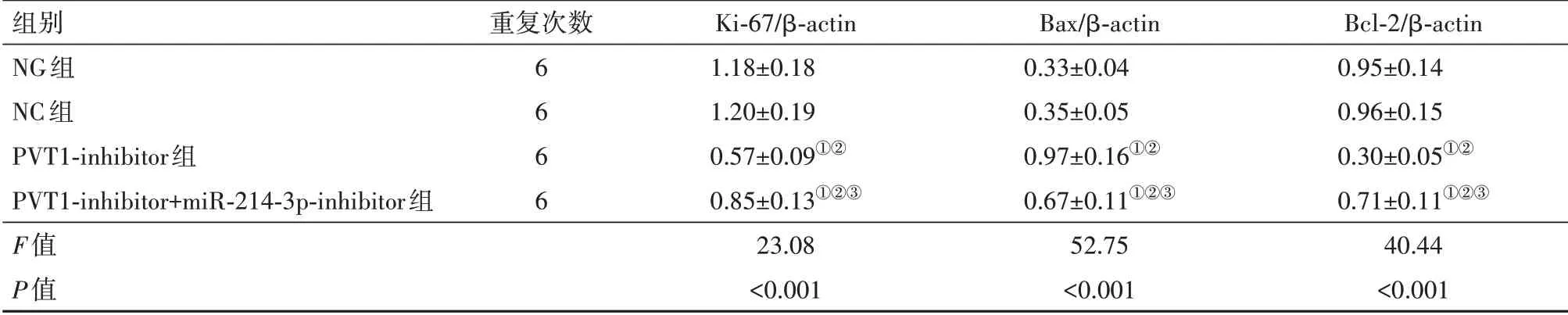
表3 各组人皮肤黑色素瘤SK-MEL-1/DDP细胞增殖、凋亡相关蛋白表达比较/±s
注:Ki-67为细胞增殖相关核抗原,Bax为Bcl-2相关X蛋白,β-actin为β-肌动蛋白,Bcl-2为B细胞淋巴瘤-2。①与NG组比较,P<0.05。②与NC组比较,P<0.05。③与PVT1-inhibitor组比较,P<0.05。
组别NG组NC组PVT1-inhibitor组PVT1-inhibitor+miR-214-3p-inhibitor组F值P值重复次数6 6 6 6 Ki-67/β-actin 1.18±0.18 1.20±0.19 0.57±0.09①②0.85±0.13①②③23.08<0.001 Bax/β-actin 0.33±0.04 0.35±0.05 0.97±0.16①②0.67±0.11①②③52.75<0.001 Bcl-2/β-actin 0.95±0.14 0.96±0.15 0.30±0.05①②0.71±0.11①②③40.44<0.001
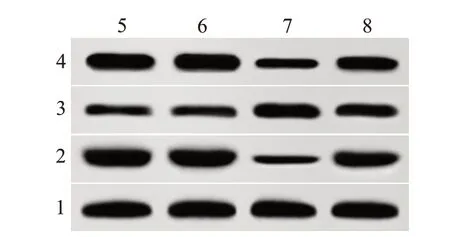
图1 各组人皮肤黑色素瘤SK-MEL-1/DDP细胞增殖、凋亡相关蛋白表达比较
2.6双荧光素酶报告基因检测miR-214-3p对PVT1的转录调控Targetscan(http://www.tar‐getscan.org/)预测结果显示,PVT1与miR-214-3p基因序列存在结合位点,见图2。荧光素酶报告基因实验结果显示,转染PVT1 WT的实验中,miR-214-3pinhibitor-PVT1-WT组荧光素酶活性(1.37±0.21)显著高 于miR-214-3p-inhibitor-NC-PVT1-WT组(1.03±0.15)(t=3.23,P=0.009)。

图2 miR-214-3p与变异性浆细胞瘤异位1(PVT1)基因靶向关系
NG组(0.38±0.06)、NC(0.35±0.05)、PVT1-inhib‐itor组(1.15±0.17)及PVT1-inhibitor+miR-214-3p-in‐hibitor组(0.80±0.12)PVT1蛋白表达比较,F=70.25,P<0.001;与NG组、NC比较,PVT1-inhibitor组显著升高(P<0.05);与PVT1-inhibitor组比较,PVT1-in‐hibitor+miR-214-3p-inhibitor组显著降低(P<0.05)。见图3。
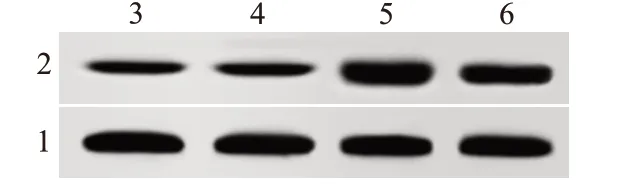
图3 各组人皮肤黑色素瘤SK-MEL-1/DDP细胞XIAP蛋白表达比较
3 讨论
CMM是具有较强侵袭及转移能力的皮肤恶性肿瘤之一,发病率及病死率高[11]。目前CMM病人主要以化疗作为术后辅助治疗手段,DDP是临床常用一线化疗药,其半衰期短,需持续给药以维持药物有效浓度,使得肿瘤细胞易产生原发或继发耐药性,以致化疗效果极不理想[12]。因此研究CMM生物治疗靶标增强DDP耐药细胞敏感性,已成为临床研究热点。
lncRNA为一种非编码RNA,在基因水平调控、细胞分化和发展等过程中发挥重要作用,其表达异常可导致癌症发生[13]。Chen等[14]研究显示,抑制PVT1表达可显著抑制黑色素瘤细胞增殖、侵袭及转移等,可能成为黑色素瘤潜在治疗靶点。Wang等[15]研究显示,PVT1在耐DDP的口腔鳞状细胞癌组织和细胞系中表达上调,增加癌细胞顺铂耐药性。目前认为化疗是通过多种途径介导肿瘤细胞凋亡来杀死癌细胞[16]。ki-67蛋白是细胞增殖相关基因蛋白,在癌变组织中呈高表达,Bcl-2是一种原癌基因,能抑制细胞凋亡,Bax是人体主要的促凋亡基因[17]。本研究以SK-MEL-1/DDP细胞为研究对象,成功转染后,结果显示,与NG组、NC组比较,PVT1-inhibi‐tor组SK-MEL-1/DDP细胞PVT1水平、Ki-67、Bcl-2蛋白表达均显著降低,细胞增殖抑制率、凋亡率、miR-214-3p及Bax表达均显著升高。说明抑制PVT1表达可能通过上调miR-214-3p表达抑制SKMEL-1/DDP细胞增殖并诱导细胞凋亡。与NG组、NC组比较,PVT1-inhibitor组SK-MEL-1/DDP细胞IC50显著降低。与既往肿瘤相关研究[18]中表达模式一致,提示抑制PVT1表达可能提高SK-MEL-1/DDP细胞对DDP的化疗敏感性。miR-214-3p是长度为20-23个核苷酸的单链RNA分子,是基因表达的重要调节剂,能够介导肿瘤发生[19]。Chen等[20]研究显示,过表达PVT1可靶向下调miR-214表达促进卵巢癌细胞增殖及转移。XIAP是凋亡抑制基因家族成员之一,能够拮抗多种凋亡诱导因素,抑制细胞凋亡[21]。蔡松涛等[22]研究显示,过表达微小RNA-23b-3p可靶向下调XIAP表达抑制类风湿关节炎滑膜成纤维细胞增殖并促进其凋亡。Yang等[23]研究显示,过表达miR-214-3p可靶向下调XIAP表达促进视网膜母细胞瘤细胞凋亡以降低细胞对多种化学药物敏感性。本研究预测到PVT1与miR-214-3p存在结合位点,且进一步证实,miR-214-3p-inhibitor-PVT1-WT组荧光素酶活性显著高于miR-214-3p-inhibitor-NC-PVT1-WT组,与NG组、NC组比较,PVT1-inhibi‐tor组SK-MEL-1/DDP细胞miR-214-3p水平显著升高、XIAP mRNA及其蛋白表达显著降低;当转染miR-214-3p-inhibitor后,发现下调PVT1表达抑制SK-MEL-1/DDP细胞增殖并促进细胞凋亡能力显著降低,细胞IC50明显回升,且miR-214-3p水平显著降低、XIAPmRNA和蛋白表达显著升高。说明下调PVT1表达提高SK-MEL-1/DDP细胞对DDP的化疗敏感性,可能是通过靶向上调miR-214-3p,抑制XIAP表达实现的。
综上所述,过表达PVT1可能通过靶向下调miR-214-3p表达,进而上调XIAP表达降低SK-MEL-1/DDP细胞对DDP的化疗敏感性。CMM发生及耐药机制复杂,关于PVT1与miR-214-3p/XIAP轴在SK-MEL-1/DDP细胞化疗耐药中的具体作用机制仍需深入探索。
