芍药苷调控环磷酸腺苷/蛋白激酶A/环磷酸腺苷反应元件结合蛋白通路对脑卒中大鼠的影响
2022-06-11陈敬君马贤聪杨泉赵雯王日升
陈敬君,马贤聪,杨泉,赵雯,王日升
脑卒中是一种急性脑血管疾病,病死率和致残率较高,是由于血流不能流入大脑而引起的脑组织受损的一种疾病,常与脑部血管阻塞有关,脑部缺血后,脑组织中肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6等炎性因子大量释放,引起神经突起的缩短、损伤甚至断裂,导致突触联系及神经联系减少,最终引发神经功能损伤,因此病人常有口眼歪斜、半身不遂、神志迷茫等不良表现,严重影响病人的生活质量及生命安全[1-2]。芍药苷是提取于芍药科植物芍药干燥根中的活性成分,为单萜糖苷类中药单体,具有抗炎、神经保护、抗氧化、免疫调节等多种生物学功能,Zhang等[3]研究发现芍药苷可改善血管性痴呆大鼠的局部脑血流量并抑制脑组织中TNFα、IL-6等炎性因子的释放,Zhang等[4]研究发现芍药苷可显著降低脑缺血大鼠的神经功能缺损评分,对大鼠神经细胞具有一定的保护作用,并认为其可能是通过上调磷酸化环磷酸腺苷(cAMP)反应元件结合蛋白(p-CREB)等蛋白发挥作用。cAMP是cAMP/蛋白激酶A(PKA)/CREB通路的重要组成部分,近年来的研究表明该通路与缺血性脑损伤联系密切,激活该通路对于脑缺血再灌注损伤具有一定的保护作用[5-6],因此,本研究自2019年12月至2020年12月,在前人研究的基础上探究芍药苷调控cAMP/PKA/CREB通路对脑卒中大鼠的影响,为临床治疗脑卒中提供新思路。
1 材料与方法
1.1动物SPF级SD大鼠40只,雌雄各半,由广东省医学实验动物中心提供,平均体质量约225 g,6~8周龄,生产许可证号为SCXK(粤)2018-0002。动物房温度25℃左右,相对湿度50%左右,实验期间自由进食、饮水,保持动物房环境及鼠笼清洁、透气。在实验过程中按照动物使用的“3R”原则给予人道主义关怀。本研究符合一般动物实验伦理学原则。
1.2主要试剂及仪器芍药苷、H89(PKA抑制剂)(编号T2230、T11524)购于陶素生化;苏木精-伊红(HE)染色试剂盒、TNF-α、IL-6、IL-2、IL-1β酶联免疫吸附测定(ELISA)试剂盒、高效RIPA组织裂解液、BCA蛋白测定试剂盒(货号:G1120、SEKR-0009、SEKR-0005、SEKR-0003、SEKR-0002、R0010、PC0020)购于北京索莱宝科技有限公司;兔源cAMP、PKA、CREB、甘油醛-3-磷酸脱氢酶(GAPDH)一抗、羊抗兔免疫球蛋白G(IgG)二抗(货号ab76238、ab32390、ab32515、ab8245、ab6721)购 于Abcam。酶标仪(型号AMR-100)购于杭州奥盛仪器有限公司;组织切片机(型号MA752)购于英国Campden公司;自动组织脱水机(型号HY-1050)购于浙江金华惠友仪器;凝胶成像仪(型号SmartGel 6000)购于北京赛智创业科技有限公司;光学显微镜(型号DMD108)购于德国徕卡。
1.3方法
1.3.1动物模型制备及分组给药 脑卒中大鼠模型的制备参考文献[7]并稍作改动,40只SD大鼠,分为假手术组(8只)和造模组(32只),将大鼠麻醉后持仰卧位固定,颈部备皮并做常规消毒,于颈部正中行切口,钝性分离大鼠颈部肌肉,暴露左侧颈外动脉、颈内动脉主干及分支,结扎颈外动脉及近心端颈总动脉,将颈总动脉结扎处远端3 mm处剪开并插入直径为0.28 mm的线栓,由颈内动脉插入约20mm,到达左侧大脑中动脉分支处,造成局灶性脑缺血后结扎颈内动脉,随后逐层缝合切口,假手术组大鼠仅分离动脉,不做结扎处理。待大鼠苏醒后进行Zea Longa神经功能缺损评分[8],无神经功能损伤症状记为0分,对侧前爪无法充分伸展记为1分,行走时向两侧旋转记为2分,行走时向两侧倾倒记为3分,意识丧失、无法行走记为4分;0分认为动脉未阻塞,4分认为模型构建失败,1~3分认为脑卒中模型构建成功。实验过程中若出现不符合标准的现象,及时选取备用大鼠进行造模。
将模型构建成功的大鼠按随机数字表法分为模型组、芍药苷组、H89组(PKA抑制剂)、芍药苷+H89组,每组8只。芍药苷组灌胃30 mg/kg芍药苷[9],H89组腹腔注射1 mg/kg H89[10],芍药苷+H89组灌胃芍药苷后腹腔注射H89,持续给药2周,模型组、假手术组以生理盐水代替。
1.3.2大鼠神经功能缺损评分及记忆行为学评估分别在给药第1、7、14天根据Zea Longa评分法对各组大鼠进行[8]神经功能缺损评分,评分标准同“1.3.1”。
大鼠记忆行为学评估采用Morris水迷宫实验测定,将水池分为Ⅰ、Ⅱ、Ⅲ、Ⅳ象限,将直径为6 cm的圆形平台置于第Ⅰ象限中央(低于水面2 cm),前4天进行定向巡航实验:将大鼠从第Ⅱ、Ⅲ、Ⅳ象限区域投入水中,记录其爬上平台所需要的时间,记为潜伏期,潜伏期越小表明大鼠学习能力越好,若120 s内大鼠仍未找到平台,指引其爬上平台并停留20 s,此时潜伏期记为120 s。第5天进行空间探索试验:将平台撤去,记录大鼠在120 s内穿越平台位置的次数,次数越多表明大鼠记忆能力越强。
1.3.3大鼠血清TNF-α、IL-6、IL-2、IL-1β水平检测 将大鼠麻醉后腹主动脉取血,室温静置20 min后,4℃、1 000g离心10 min,分离血清,采用TNF-α、IL-6、IL-2、IL-1βELISA试剂盒进行测定,具体步骤参考相关试剂盒要求。
1.3.4大鼠脑组织获取及HE染色 将大鼠麻醉后处死,剪开大鼠头部皮肤,切开肌肉、骨膜后钝性分离颅骨,取大鼠脑组织,一部分用于HE染色观察,一部分用于测定cAMP/PKA/CREB通路相关蛋白的表达。
取适量大鼠脑组织,在4%的多聚甲醛中固定48 h,将固定好的大鼠脑组织用生物组织脱水机进行脱水及透明处理,将脑组织浸入石蜡中制成包埋有脑组织的蜡块,冷却凝固后将其切成约4μm厚的切片,将切片贴附在载玻片上,用二甲苯溶液脱蜡、梯度乙醇水化、蒸馏水洗、苏木素染色、分化液分化、返蓝液返蓝、二甲苯透明、中型树胶封片,在显微镜下观察并分析。具体操作方法参考HE染色试剂盒的要求。
1.3.5大鼠脑组织cAMP/PKA/CREB通路蛋白表达检测 取大鼠脑组织适量,用眼科剪剪碎,加入高效RIPA组织裂解液(1 mg∶10μL),用组织匀浆机进行匀浆处理,将匀浆后的样品离心取上清液,根据BCA蛋白测定试剂盒的要求测定其中蛋白含量,将各组蛋白浓度调至相同并加热变性,冷却后取20μL进行电泳分离蛋白,用湿转法将所有蛋白转移到硝酸纤维膜上,将纤维膜用5%的脱脂奶粉溶液进行封闭约2 h,根据分子量将目的蛋白截取下来置于孵育盒中,加入cAMP、PKA、CREB、p-CREB、GAP‐DH一抗(1∶1 000),4℃冰箱中孵育过夜后用洗膜缓冲液漂洗3次,加入辣根过氧化物标记的羊抗兔IgG二抗,室温孵育1 h后用洗膜缓冲液漂洗3次,经过显色、定影后于凝胶成像仪中观察并分析。
1.4统计学方法采用SPSS22.0软件对实验中的数据进行统计并分析。定量数据采用±s的方式进行描述,采用单因素方差分析对多组间进行比较,采用重复测量方差分析进行多时间点观测资料的比较,采用LSD法进一步进行多组间的两两比较。P<0.05认为差异有统计学意义。
2 结果
2.1各组大鼠神经功能缺损评分与假手术组相比,模型组大鼠神经功能缺损评分显著升高(给药第1天、第7天、第14天)(P<0.05);与模型组相比,芍药苷组大鼠神经功能缺损评分显著降低(给药第7天、第14天)(P<0.05);与芍药苷组相比,芍药苷+H89组大鼠神经功能缺损评分显著升高(给药第7天、第14天)(P<0.05);与H89组相比,芍药苷+H89组大鼠神经功能缺损评分显著降低(给药第7天、第14天)(P<0.05)。见表1。
表1 各组大鼠神经功能缺损评分比较/(分,±s)

表1 各组大鼠神经功能缺损评分比较/(分,±s)
注:①与同时间点假手术组比较,P<0.05。②与同时间点模型组比较,P<0.05。③与同时间点芍药苷组比较,P<0.05。④与同时间点H89组比较,P<0.05。⑤与同组给药第1天比较,P<0.05。⑥与同组给药第7天比较,P<0.05。
组别假手术组模型组芍药苷组H89组芍药苷+H89组组间F,P值时间F,P值交互F,P值鼠数8 8 8 8 8给药第1天0.05±0.01 2.69±0.56①2.58±0.53①2.65±0.62①2.60±0.52①27.56,<0.001 141.74,<0.001 10.02,<0.001给药第7天0.10±0.02 2.26±0.43①1.24±0.25①②⑤2.90±0.58①②③1.86±0.43①②③④⑤给药第14天0.03±0.01 2.25±0.46①0.72±0.14①②⑤⑥2.93±0.68①②③1.05±0.38①②③④⑤⑥
2.2各组大鼠记忆行为学评估与假手术组相比,模型组大鼠潜伏期显著升高(P<0.05),穿台次数[(15.20±2.08)次比(8.70±1.79)次]显著减少(P<0.05);与模型组相比,芍药苷组大鼠潜伏期显著降低(P<0.05),穿台次数[(8.70±1.79)次比(13.06±1.86)次]显著升高(P<0.05);与芍药苷组相比,芍药苷+H89组大鼠潜伏期显著升高(P<0.05),穿台次数[(13.06±1.86)次比(11.08±1.64)次]显著减少(P<0.05);与H89组相比,芍药苷+H89组大鼠潜伏期显著 降 低(P<0.05),穿 台 次 数[(6.30±1.33)次 比(11.08±1.64)次]显著升高(P<0.05)。其中潜伏期数据见表2。
表2 各组大鼠记忆行为学评估中的潜伏期比较/(s,±s)
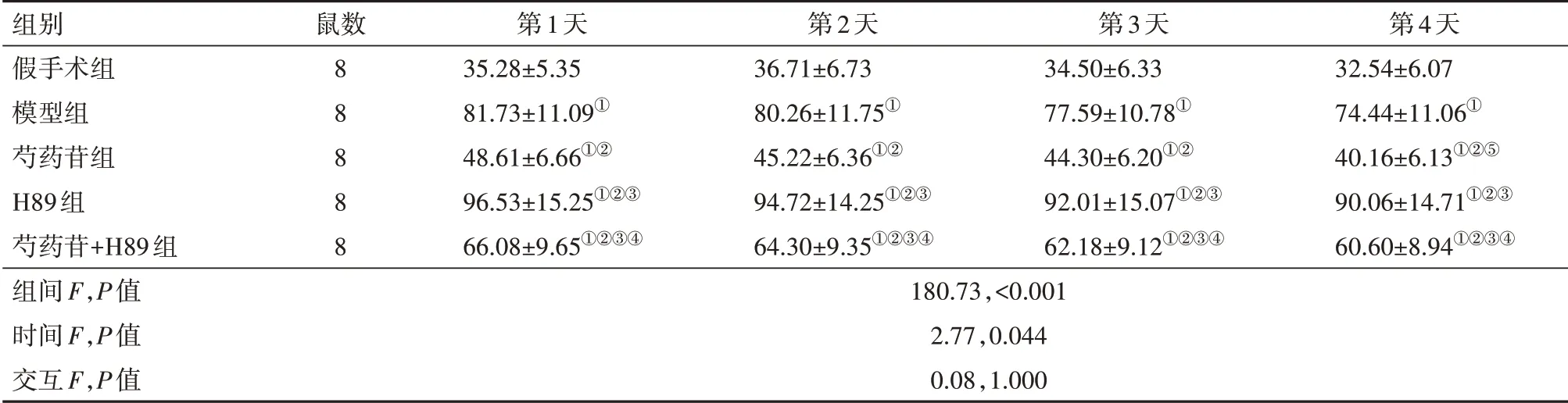
表2 各组大鼠记忆行为学评估中的潜伏期比较/(s,±s)
注:①与假手术组比较,P<0.05。②与模型组比较,P<0.05。③与芍药苷组比较,P<0.05。④与H89组比较,P<0.05。⑤与第1天相比,P<0.05。
组别假手术组模型组芍药苷组H89组芍药苷+H89组组间F,P值时间F,P值交互F,P值鼠数8 8 8 8 8第1天35.28±5.35 81.73±11.09①48.61±6.66①②96.53±15.25①②③66.08±9.65①②③④180.73,<0.001 2.77,0.044 0.08,1.000第2天36.71±6.73 80.26±11.75①45.22±6.36①②94.72±14.25①②③64.30±9.35①②③④第3天34.50±6.33 77.59±10.78①44.30±6.20①②92.01±15.07①②③62.18±9.12①②③④第4天32.54±6.07 74.44±11.06①40.16±6.13①②⑤90.06±14.71①②③60.60±8.94①②③④
2.3各组大鼠血清TNF-α、IL-6、IL-2、IL-1β水平比较与假手术组相比,模型组大鼠血清TNF-α、IL-6、IL-2、IL-1β水平显著升高(P<0.05);与模型组相比,芍药苷组大鼠血清TNF-α、IL-6、IL-2、IL-1β水平显著降低(P<0.05);与芍药苷组相比,芍药苷+H89组大鼠血清TNF-α、IL-6、IL-2、IL-1β水平显著升高(P<0.05);与H89组相比,芍药苷+H89组大鼠血清TNF-α、IL-6、IL-2、IL-1β水平显著降低(P<0.05)。见表3。
表3 各组大鼠血清TNF-α、IL-6、IL-2、IL-1β水平比较/(ng/L,±s)

表3 各组大鼠血清TNF-α、IL-6、IL-2、IL-1β水平比较/(ng/L,±s)
注:TNF-α为肿瘤坏死因子-α,IL-6为白细胞介素-6,IL-2为白细胞介素-2,IL-1β为白细胞介素-1β。①与假手术组比较,P<0.05。②与模型组比较,P<0.05。③与芍药苷组比较,P<0.05。④与H89组比较,P<0.05。
组别假手术组模型组芍药苷组H89组芍药苷+H89组F值P值鼠数8 8 8 8 8 TNF-α 75.32±5.69 120.13±10.07①86.25±7.85①②132.68±11.14①②③106.19±9.45①②③④54.43<0.001 IL-6 40.41±5.41 64.86±9.56①47.12±6.75①②77.33±13.22①②③55.13±8.07①②③④20.96<0.001 IL-2 33.13±5.90 58.86±10.12①40.20±7.11①②71.66±12.58①②③48.68±8.12①②③④22.54<0.001 IL-1β 5.01±1.04 12.19±1.54①6.46±1.44①②15.28±2.58①②③8.12±1.24①②③④52.41<0.001
2.4各组大鼠脑组织病理学观察假手术组大鼠脑组织形态正常、结构紧密,神经细胞结构完整;与假手术组相比,模型组大鼠脑组织损伤严重,神经细胞排列紊乱,细胞体积增大,出现细胞核偏移、空泡化等现象;与模型组相比,芍药苷组大鼠脑组织受损得到缓解;与芍药苷组相比,芍药苷+H89组大鼠脑组织受损较重;与H89组相比,芍药苷+H89组大鼠脑组织受损得到缓解。见图1。

图1 各组大鼠脑组织病理学观察(HE染色×200):A为假手术组;B为模型组;C为芍药苷组;D为H89组;E为芍药苷+H89组
2.5各组大鼠脑组织cAMP/PKA/CREB通路蛋白表达比较与假手术组相比,模型组大鼠cAMP/PKA/CREB通路蛋白表达显著降低(P<0.05);与模型组相比,芍药苷组大鼠cAMP/PKA/CREB通路蛋白表达显著升高(P<0.05);与芍药苷组相比,芍药苷+H89组大鼠cAMP/PKA/CREB通路蛋白表达显著降低(P<0.05);与H89组相比,芍药苷+H89组大鼠cAMP/PKA/CREB通路蛋白表达显著升高(P<0.05)。见表4,图2。
表4 各组大鼠脑组织cAMP/PKA/CREB通路蛋白表达比较/±s
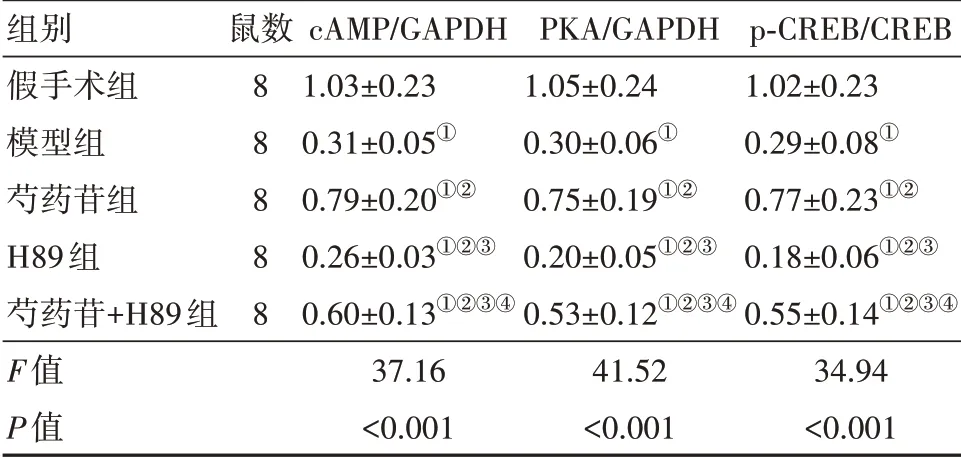
表4 各组大鼠脑组织cAMP/PKA/CREB通路蛋白表达比较/±s
注:cAMP为环磷酸腺苷,PKA为蛋白激酶A,CREB为环磷酸腺苷反应元件结合蛋白,GAPDH为甘油醛-3-磷酸脱氢酶,p-CREB为磷酸化环磷酸腺苷反应元件结合蛋白。①与假手术组比较,P<0.05。②与模型组比较,P<0.05。③与芍药苷组比较,P<0.05。④与H89组比较,P<0.05。
组别假手术组模型组芍药苷组H89组芍药苷+H89组F值P值鼠数8 8 8 8 8 cAMP/GAPDH 1.03±0.23 0.31±0.05①0.79±0.20①②0.26±0.03①②③0.60±0.13①②③④37.16<0.001 PKA/GAPDH 1.05±0.24 0.30±0.06①0.75±0.19①②0.20±0.05①②③0.53±0.12①②③④41.52<0.001 p-CREB/CREB 1.02±0.23 0.29±0.08①0.77±0.23①②0.18±0.06①②③0.55±0.14①②③④34.94<0.001

图2 各组大鼠脑组织cAMP/PKA/CREB通路蛋白表达情况
3 讨论
脑卒中又称中风,是位于癌症、心脏病之后的第三大死因,是许多国家成人残疾的主要原因,主要有缺血性脑卒中和出血性脑卒中。其中缺血性脑卒中发病率占80%以上,脑中动脉闭塞是缺血性脑卒中常见的病因,具有较高的病死率和致残率,偏瘫是脑卒中病人幸存者常见的不良症状,严重影响病人的心理健康及生活质量[11-12]。多项研究表明脑部缺血后,机体会释放大量炎性因子并激活小胶质细胞,激活的小胶质细胞可与浸润的白细胞结合产生更多的炎性介质,从而引起脑组织水肿、神经元凋亡、血脑屏障破坏等,最终导致脑神经功能受损[12-13]。本研究结果显示,模型组大鼠的神经缺损评分及血清炎性因子显著升高,大鼠记忆行为学能力显著下降,脑神经细胞受损严重,提示急性脑缺血可导致大鼠机体炎症反应加剧,引发神经突起的断裂、损伤,进而影响神经、突触之间的联系,导致脑部神经功能受损,最终出现认知功能障碍、神经功能缺损等表现,表明脑卒中大鼠模型构建成功。
芍药苷是芍药根中的主要活性成分,是一种水溶性糖苷,具有镇痛、抗炎、神经保护、免疫调节、抗氧化等多种生物学功能,广泛用于神经系统疾病、神经退行性疾病等的临床治疗及基础研究[14-15]。Wu等[16]研究发现芍药苷可减轻急性脑梗死大鼠的脑损伤并提高大鼠的神经状况,对脑缺血表现出一定的保护作用。Gu等[17]研究结果显示芍药苷可显著改善阿尔茨海默病小鼠的认知功能,降低小鼠机体炎症反应,对脑神经具有一定的保护作用。本研究结果显示,经过芍药苷治疗的脑卒中大鼠的神经功能缺损评分及血清炎性因子显著降低,记忆行为学能力显著提高,脑组织受损得到缓解,提示芍药苷可显著抑制脑卒中大鼠机体炎症反应,有效发挥神经保护功能。
近年来的研究表明,cAMP/PKA/CREB通路与脑缺血疾病联系密切,当细胞受到缺血、缺氧等刺激时,可催化ATP脱去一个焦磷酸形成cAMP,cAMP可进一步激活PKA,促使亚基PKAc进入细胞核,从而促进CREB磷酸化形成p-CREB,从而激活cAMP/PKA/CREB通路,该通路的激活对于脑缺血造成的神经损伤、轴突再生、神经元保护具有积极作 用[18-19]。Jiang等[20]研 究 发 现 激 活cAMP/PKA/CREB通路可促进脑卒中大鼠行为恢复并发挥神经保护作用,本研究结果显示,经过芍药苷治疗的脑卒中大鼠脑组织中cAMP、PKA、p-CREB蛋白表达显著高于模型组,提示芍药苷可能激活cAMP/PKA/CREB通路缓解大鼠脑组织受损情况。H89为PKA抑制剂,可显著抑制PKA表达,从而阻断该通路的激活,本研究结果显示,芍药苷+H89组大鼠脑组织中cAMP、PKA、p-CREB蛋白表达显著显著低于芍药苷组,进一步提示芍药苷缓解脑卒中的作用可能与激活cAMP/PKA/CREB通路有关。
综上所述,芍药苷可显著改善脑卒中大鼠的神经功能及机体炎症反应,对大鼠脑组织具有一定的保护作用,可能是通过激活cAMP/PKA/CREB通路发挥作用,但本研究未设置相应的通路激活剂进行对比实验,因此仍须深入研究。
