肝癌经导管动脉栓塞化疗后并发肝脓肿2例
2022-06-11胡知峰汪国祥黄新宇汪和平王勇
胡知峰,汪国祥,黄新宇,汪和平,王勇
介入治疗目前成为肝癌治疗的重要手段,甚至首选治疗方案,肝癌介入后并发肝脓肿(PLA)的比例逐步上升。肝癌经导管动脉栓塞化疗(TACE)后并发PLA发生率约0.2%~4.5%,Lv等[1]并指出转移性肝癌肝脓肿的发生率较原发性肝细胞癌更高。Meloni等[2]报道肝癌射频后PLA发生率约0.2%~0.6%。PLA的形成严重影响了病人的预后,本研究通过2例病例报告,加强临床医生对肝癌介入前的术前评估、脓肿的处理及不良预后因素的认识。
1 临床资料
本研究2例病人所有治疗均签署医患沟通及病人知情同意书,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
病例1:女,47岁,2019年3月21日行胆总管癌根治术,术后肝转移。9月4日行首次TACE,术前磁共振成像(MRI)示少许胆管积气(图1A),术后感染。9月16日复查CT示肝右后叶脓肿形成(图1B),9月18日CT下穿刺抽吸,抽出10 mL浓稠咖啡色液体,并用庆大霉素冲洗,9月25日复查CT示肝脓肿病灶范围增大,肝内胆管扩张、积气明显(图1C)。11月6日复查MRI示脓肿缩小,脓壁形成(图1D)。2020年1月6日复查CT示病灶明显进展(图1E)。抗生素早期根据经验性使用,后根据血培养或脓液培养(大肠埃希菌)。
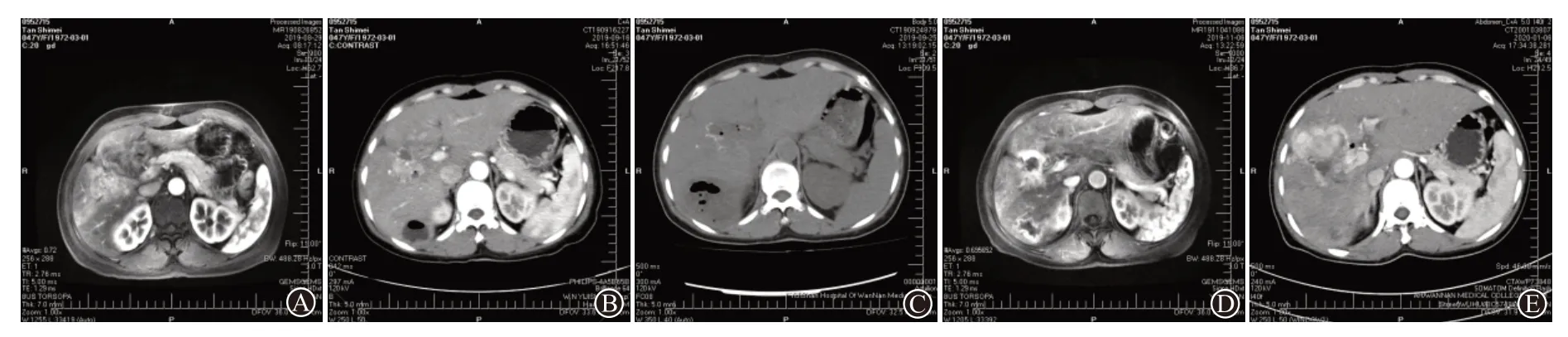
图1 肝癌经导管动脉栓塞化疗后并发肝脓肿病例1影像学图片:A为磁共振成像(MRI)示肝内多发占位,少许肝内胆管积气;B为CT示肝脓肿形成;C为CT示脓肿扩大,胆管扩张、积气;D为MRI示脓腔缩小,脓壁形成;E为CT示脓肿基本消失,肿瘤病灶进展明显
病例2:女,47岁,2019年1月8日行胆管癌根治术,术后肝转移。3月11日行首次TACE,术前CT示肝内胆管略扩张,术后感染。4月19日行第2次TACE,术前CT示肝内胆管轻度扩张,少许积气(图2A)。7月26日行第3次TACE,术前MRI示肝右叶胆管扩张(图2B),术后感染。8月5日复查MRI示多发感染灶,考虑小脓肿形成。9月9日在B超下行肝穿刺引流,抽出300 mL脓性液体,带管引流。9月29日复查CT示:肝脏多发脓肿逐步吸收,提示腹腔转移(图2C)。11月1日复查CT示脓肿基本吸收,腹腔转移明显(图2D)。抗生素根据经验性使用。
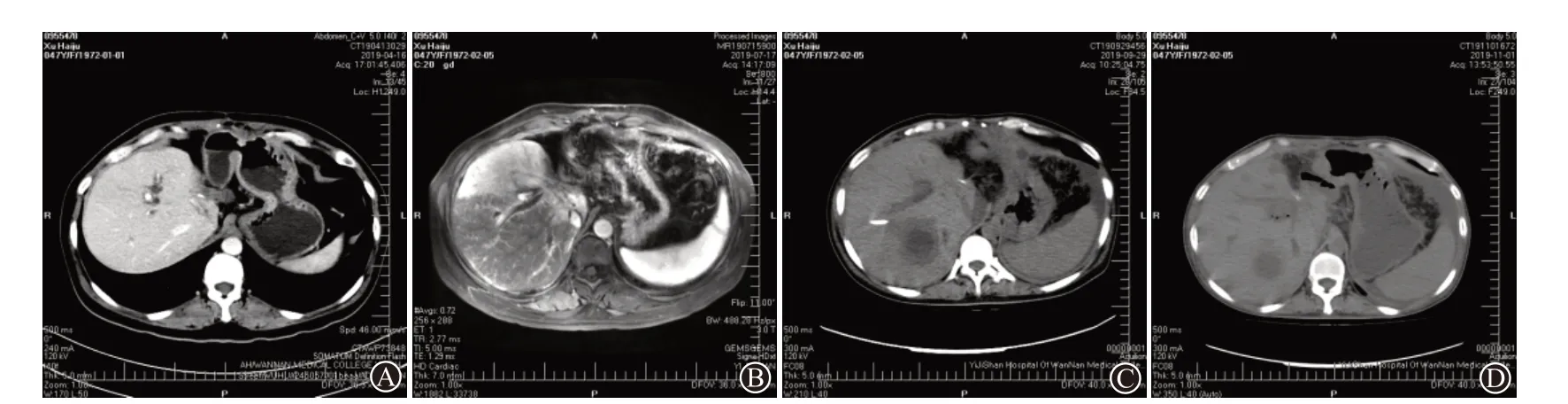
图2 肝癌经导管动脉栓塞化疗后并发肝脓肿病例2影像学图片:A为CT示肝内胆管扩张、积气;B为磁共振成像(MRI)示肝内胆管扩张,管壁增厚、强化,并见多发异常强化影,沿胆管分布,炎症可能;C为CT示脓肿逐步吸收,见网膜浑浊、结节样增厚,腹腔积液;D为CT示脓肿缩小,网膜增厚、浑浊更加明显
2 结果
病例1经治疗后感染控制,并行再次介入治疗,2个月后肝内病灶显著进展。病例2感染反复,脓肿形成后肿瘤多发转移,4个月后死亡。
3 讨论
肝癌介入后肝脓肿的发生与多种因素密切相关。如男性、高龄、营养不良、糖尿病、胆道疾病史(尤其是胆道阻塞性病变、胆管细胞癌)、肝内积气及是否转移性肝癌等基础因素更易发生肝脓肿[1,3-4]。其他特殊因素,如Sch等[5]、姜敏霞等[6]指出颗粒性栓塞剂的使用、腹水、术前有肝癌破裂出血、肝脓肿史或既往TACE术后感染史与TACE术后发生感染显著相关。周颜等[7]指出转移性肝肿瘤TACE后发生肝脓肿的危险因素与原发肿瘤的部位、消化道手术有关。研究指出肿瘤位置是否邻近周围重要脏器、肝功能Child-Pugh分级为射频消融(RFA)治疗后肝脓肿形成的危险因素[8-9]。
为求降低肝脓肿发病率,应及时行并发肝脓肿的风险评估。对拟行肝癌介入治疗的病人,Shin等[10]制定了一项术前肝脓肿发病风险评分系统,如经风险评分≥71分者,其肝脓肿的发生率是对照组(风险评分≤55分)的50倍。姜敏霞等[6]也制定TACE术后感染风险评分系统,TACE术后感染高风险因素越多,感染发生率越高,对评分≥15分,予抗菌药物预防感染。针对高风险病人,是否行预防性抗生素治疗仍存争议,介入放射科抗菌药物使用指南(草案)指出风险高及以梗死为目的的肿瘤和(或)实体脏器栓塞治疗时,可预防性使用抗菌药物。而有资料显示TACE预防性应用抗生素并不能减少肝脓肿的发生率[11]。该2例皆为胆管癌、手术史、术前胆道积气,病例2既往多次TACE术后感染史,3次TACE术前复查影像学均示肝内胆管扩张,并逐步明显。本团队认为对术前风险评估十分必要,同时应重视风险的叠加。即第一次风险评估为高风险,但未发生肝脓肿,那么后期风险就会逐步增加。
肝癌介入后肝脓肿的诊断主要依靠临床表现、影像学及实验室检查。需指出糖尿病病人及老年病人合并隐源性肝脓肿临床表现较轻。TACE术后化疗栓塞综合征极易掩盖并发肝脓肿的症状及血象,一般多为低中热,20 d内自行消退。肝癌热消融后也可出现发热,一般在术后数日内达高峰,多为低热,之后逐渐消退。TACE及热消融均可形成胆汁瘤,再合并肝脓肿。同时早期肝脓肿影像学改变与早期肿瘤液化坏死不易鉴别。
肝癌并发肝脓肿时,脓肿处理优先。目前多在抗生素的基础上,联合介入或外科手术。早期抗生素的选择应针对可疑细菌,后根据血液或脓液药敏调整,对尚未液化的肝脓肿可取得满意效果。肝脓肿致病菌目前以肺炎克雷伯菌、大肠埃希菌等为主,多发脓肿和脓肿起源于胆道呈相关性[12-13]。目前早期经验性采用甲硝唑+第三代头孢菌素或喹诺酮类,大多是有效的。为了提高局部抗生素浓度,可采用肝总动脉置管给药等方式。B超或CT引导下穿刺抽吸或引流是目前介入治疗的主要方法。苏秀峰[3]统计发现消融联合无水乙醇治疗肝癌显著降低肝脓肿的发生率。也有外文报道无水乙醇成功治疗肝脓肿病例[14]。外科手术目前认为用于保守或介入治疗失败的补救、脓肿型肝癌或胆道疾病需行手术治疗等情况。本研究2例病人均行穿刺抽吸或引流,本团队认为针对脓肿早期液化不良或脓壁未形成者,不建议行穿刺抽吸或引流,可能扩大脓腔。
本团队认为肝癌早期肿瘤内部发生脓肿的预后与液化坏死程度有关,完全液化坏死可能提示预后良好。而肿瘤周围部位脓肿的预后较差,本研究2例提示肝脓肿期间或治疗后多伴有癌灶进展。参照肝脓肿,对于存在不良预后因素和全身性并发症的病人,应积极治疗,可显著降低因脓肿导致的病死率,延长肿瘤病人生存期。Cho等[15]报道感染性休克常发生在最初病情稳定的病人中,并与高龄、恶性肿瘤、低血压、呼吸急促和乳酸浓度升高有关。相关文献指出独立危险因素(恶性肿瘤、肝移植术后、大脓肿、产气脓肿、脓毒症、急性生理学和慢性健康状况评价Ⅱ(APACHEⅡ)评分≥15分)、糖尿病、多药耐药菌、厌氧感染、血尿素氮>7.86 mmol/L和单纯使用抗生素与病死率显著相关,并认为APACHEⅡ评分可以作为预后的预测因子[13,16-18]。同时注意多重感染,本研究2例皆合并肺部感染,有学者指出肝脓肿合并肺部感染的病人病死率高[18]。
总之,临床医生应重视肝癌介入前的风险评估。同时认识预后因素或危险因素的重要作用,肝脓肿后多伴有癌灶明显进展,为防止病情进一步恶化,不能忽视发生不良预后因素的处理。
