长链非编码RNA FOXD2相邻相反链RNA 1靶向调控微小RNA-760对前列腺癌细胞增殖和凋亡的影响
2022-06-11贾龙江郝斌许长宝赵永立冯国亮
贾龙江,郝斌,许长宝,赵永立,冯国亮
前列腺癌是男性泌尿生殖系统恶性肿瘤,其易发生骨转移,靶向治疗是其新型治疗方式[1]。潜在特异作用靶点是研发靶向药物和临床治疗的难点。长链非编码RNA(lncRNA)可在表观遗传、转录水平及转录后水平参与调控细胞生理过程,研究报道多种lncRNA的异常表达与前列腺癌的进展密切相关[2]。FOXD2相邻相反链RNA 1(FOXD2-AS1)是FOXD2的反义RNA1,一种lncRNA,研究发现FOXD2-AS1可通过调节EMT和Notch信号通路促进结肠癌的进展[3]。FOXD2-AS1在鼻咽癌组织和细胞中高表达,与病人预后不良相关[4]。微小RNA(miRNA)参与细胞周期调控、凋亡和分化等过程,与前列腺癌的发生和发展密切相关[5]。研究发现过表达miR-760可通过整合素β3/细胞周期蛋白D1(integrinβ3/cyclin D1)信号抑制肺癌细胞增殖、迁移和侵袭[6];过表达miR-760还可以抑制胃癌MGC-803细胞的迁移和侵袭[7]。然而FOXD2-AS1和miR-760在前列腺癌细胞中的表达及相互关系目前尚未可知。本实验研究FOXD2-AS1和miR-760对前列腺癌细胞增殖、凋亡的分子机制,为前列腺癌的分子靶向治疗提供参考。实验于2019年1—11月进行。
1 材料与方法
1.1材料正常前列腺上皮细胞株RWPE-1和前列腺癌细胞株DU145、LNCaP、22Rv1由中国科学院上海细胞库提供;胎牛血清、RPMI-1640培养基、胰蛋白酶由美国Gibico公司提供;RNA提取试剂盒、PCR试剂盒、LipofectamineTM2000转染试剂盒由美国ABI公司提供;噻唑蓝(MTT)、二甲基亚砜(DMSO)、BCA试剂盒由Sigma公司提供;聚偏二氟乙烯(PVDF)膜、电化学发光(ECL)液、放射免疫沉淀法(RIPA)蛋白裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒由上海碧云天生物技术有限公司提供;双荧光素酶报告基因检测试剂盒由上海美轩生物科技有限公司提供;载体质粒由上海基屹生物科技有限公司提供;抗体均由北京博奥森生物科技有限公司提供。
1.2方法
1.2.1细胞培养 将正常前列腺上皮细胞株RWPE-1和前列腺癌细胞株DU145、LNCaP、22Rv1接种于含10%胎牛血清的RPMI-1640培养基中,并常规在37℃、5%二氧化碳培养箱中培养、传代。
1.2.2细胞转染与分组 取对数生长期细胞DU145无血清培养12 h后,将空载体质粒(pcDNA)、FOXD2-AS1过表达质粒(pcDNA-FOXD2-AS1)、小干扰RNA阴性对照(si-NC)、FOXD2-AS1小干扰RNA(si-FOXD2-AS1)、miR-760阴 性 对 照(miRNC)、miR-760及si-FOXD2-AS1+抗miR-760阴性对照(anti-miR-NC)、si-FOXD2-AS1+抗miR-760(antimiR-760)质粒转染至细胞DU145中,于转染48 h进行实时荧光定量逆转录聚合酶链反应(qRT-PCR)验证无误后再进行后续相关实验。
1.2.3qRT-PCR检测miR-760和FOXD2-AS表达水平 收集转染验证后的DU145细胞,严格按照RNA抽提及逆转录相关试剂盒说明书提取总RNA,并快速将其逆转录为互补DNA(cDNA)。严格依据qRT-PCR说明书分别以U6和GAPDH为内参进行miR-760和FOXD2-AS1检测。每个样品设3个复孔,反应体系终体积为20μL,其中逆转录产物2μL,SYBR Green Mix 10μL,正反向引物各1μL,水6μL;反应条件为95℃30 s,60℃30 s;72℃45 s,共40个循环;72℃延长5 min。采用2−ΔΔCt法计算miR-760和FOXD2-AS1的相对表达量。miR-760正向引物序列:5'-GTCGAGCGGCTCTGGGTCTGTG-3',反向引物序列:5'-TCCAGTGCAGGGTCCGAGGT-3';FOXD2-AS1正 向 引 物 序 列:5'-CCGCGTA‐AGCCTCATAGAAG-3',反向引物序列:5'-GGGAG‐TAGGGTGAGGAAAGG-3';U6正向引物序列:5'-TACGAGTGCTCACTTCGGCAGC-3',反向引物序列:5'-GTCCTTCCTGCCGAGTG-3';GAPDH正向引物序列:5'-GGTGAAGGTCGGAGTCAACG-3',GAPDH反向引物序列:5'-CAAAGTTGTCATGGATGCACC-3'。
1.2.4荧光素酶报告实验检测FOXD2-AS1对miR-760的靶向调控 根据“1.2.2”方法完成DU145细胞培养及转染。FOXD2-AS1野生型和突变型荧光素酶表达载体WT-FOXD2-AS1和MUT-FOXD2-AS1,设计扩增WT-FOXD2-AS1和MUT-FOXD2-AS1片段的引物序列,分别在结合位点的上游和下游设计引物并添加酶切位点,其中,FOXD2-AS1野生型引物中序列包含GGUGCAGAGCC,突变型引物序列中将GGUGCAGAGCC替换为TGTGACAGCGT,通过PCR扩增片段并酶切回收,而后添加到双荧光素酶报告载体中,由上海基屹生物科技有限公司构建合成。将WT-FOXD2-AS1和MUT-FOXD2-AS1载体分别与miR-NC和miR-760对DU145细胞进行共转染。严格按照相关说明书进行荧光素酶和Renilla活性的检测。重复实验3次。
1.2.5蛋白质印迹法检测蛋白表达 按试剂使用说明常规进行各蛋白的提取、电泳、封闭、一抗及二抗孵育、显色;成像后用Image J软件进行数字化信息转化,分析各蛋白条带的灰度水平,各蛋白样品均设3个复孔,并重复实验3次。
1.2.6MTT法检测细胞增殖 于各组细胞培养24、48、72 h时,每孔分别加入MTT(5 g/L)溶液20μL,继续在培养箱中孵育4 h后去除上清液,并在每孔中加入150μL DMSO,常温振荡10 min以溶解沉淀,用酶标仪检测490 nm处吸光度。细胞增殖活力(%)=实验组吸光度/空白对照组吸光度×100%。
1.2.7流式细胞术检测细胞凋亡 各组DU145细胞培养48 h后用PBS清洗2次,与500μL的结合缓冲液混匀。先加入10μL的膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC),再加入5μL的碘化丙啶(PI),混匀后避光孵育10 min。用流式细胞仪严格依据凋亡检测试剂盒说明书进行细胞凋亡率检测。每组设3个复孔,并重复实验3次。
1.3统计学方法用SPSS 20.00软件进行统计。计量资料以±s表示,两组间比较采用两独立样本t检验,多组间比较用单因素方差分析及多组间两两比较的SNK法。以P<0.05为差异有统计学意义。
2 结果
2.1FOXD2-AS1和miR-760在前列腺癌细胞和正常前列腺上皮细胞中的表达与正常前列腺上皮细胞RWPE-1相比,前列腺癌细胞DU145、LNCaP、22Rv1中FOXD2-AS1表达水平显著升高(P<0.001),miR-760表达水平显著降低(P<0.001)(表1)。
表1 FOXD2-AS1和miR-760在前列腺癌细胞和正常前列腺上皮细胞中的表达/±s
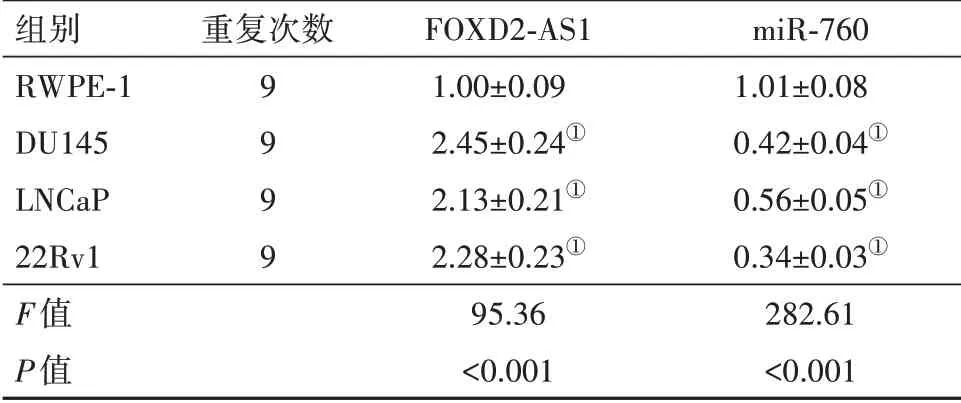
表1 FOXD2-AS1和miR-760在前列腺癌细胞和正常前列腺上皮细胞中的表达/±s
注:FOXD2-AS1为FOXD2相邻相反链RNA 1。①与RWPE-1组比较,P<0.001。
组别RWPE-1 DU145 LNCaP 22Rv1 F值P值重复次数9 9 9 9 FOXD2-AS1 1.00±0.09 2.45±0.24①2.13±0.21①2.28±0.23①95.36<0.001 miR-760 1.01±0.08 0.42±0.04①0.56±0.05①0.34±0.03①282.61<0.001
2.2FOXD2-AS1靶向调控miR-760的表达通过TargetScan数据库预测到FOXD2-AS1与miR-760存在结合位点(图1)。荧光素酶报告结果显示,转染野生型和突变型FOXD2-AS1基因表达载体WTFOXD2-AS1、MUT-FOXD2-AS1后,与miR-NC组相比,miR-760组WT-FOXD2-AS1前列腺癌细胞DU145荧光素酶活性显著降低[(0.42±0.03)比(1.04±0.09)](t=19.606,P<0.001);而MUT-FOXD2-AS1前列腺癌细胞DU145的荧光素酶活性[(1.02±0.09)比(1.03±0.08)]差异无统计学意义(t=0.249,P=0.806)。qRT-PCR检测结果显示,与pcDNA组相比,pcDNA-FOXD2-AS1组DU145细胞中miR-760的表达水平显著降低[(0.45±0.04)比(1.02±0.09)](t=17.362,P<0.001);与si-NC组相比,si-FOXD2-AS1组DU145细胞中miR-760表达水平显著升高[(2.34±0.23)比(1.01±0.08)](t=16.385,P<0.001)。可见,FOXD2-AS1可靶向调控miR-760的表达。
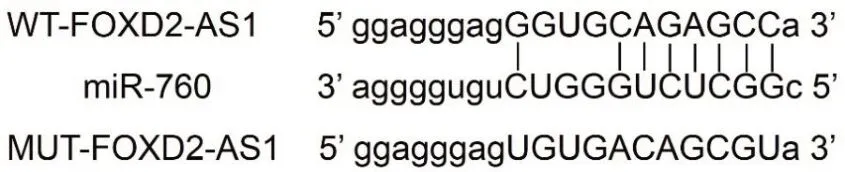
图1 FOXD2相邻相反链RNA 1(FOXD2-AS1)的序列中含有与miR-760互补的核苷酸序列
2.3抑制FOXD2-AS1表达对前列腺癌DU145细胞增殖和凋亡的影响与si-NC组相比,si-FOXD2-AS1组FOXD2-AS1、cyclin D1、B细胞淋巴瘤-2(Bcl-2)表达水平显著降低,周期素依赖激酶抑制剂p21(P21)、Bcl-2相关X蛋白(Bax)表达水平显著升高,细胞活性显著降低,细胞凋亡率显著升高(P<0.001)(表2)。可见,抑制FOXD2-AS1表达抑制前列腺癌DU145细胞增殖,促进细胞凋亡。
表2 抑制FOXD2相邻相反链RNA 1(FOXD2-AS1)表达对前列腺癌DU145细胞增殖和凋亡的影响/±s

表2 抑制FOXD2相邻相反链RNA 1(FOXD2-AS1)表达对前列腺癌DU145细胞增殖和凋亡的影响/±s
注:cyclin D1为细胞周期蛋白D1,P21为周期素依赖激酶抑制剂p21,Bcl-2为B细胞淋巴瘤-2,Bax为Bcl-2相关X蛋白。
组别si-NC si-FOXD2-AS1 t值P值重复次数9 9 FOXD2-AS1 1.00±0.08 0.39±0.04 20.46<0.001 490 nm处吸光度(增殖)24 h 0.41±0.04 0.38±0.03 1.80 0.091 48 h 0.76±0.06 0.49±0.04 11.23<0.001 72 h 1.14±0.09 0.62±0.06 14.42<0.001凋亡率/%7.42±0.73 21.56±2.08 19.24<0.001 cyclin D1蛋白0.63±0.06 0.24±0.03 17.44<0.001 P21蛋白0.33±0.03 0.74±0.07 16.15<0.001 Bcl-2蛋白0.69±0.06 0.29±0.03 17.89<0.001 Bax 0.21±0.03 0.59±0.05 19.55<0.001
2.4miR-760过表达对前列腺癌DU145细胞增殖和凋亡的影响与miR-NC组相比,miR-760组cy‐clin D1、Bcl-2表达水平显著降低,miR-760、P21、Bax表达水平显著升高,细胞活性显著降低,细胞凋亡率显著升高(P<0.001)(图2,表3)。可见,miR-760过表达抑制DU145细胞增殖,促进细胞凋亡。
表3 miR-760过表达对前列腺癌DU145细胞增殖和凋亡的影响/±s
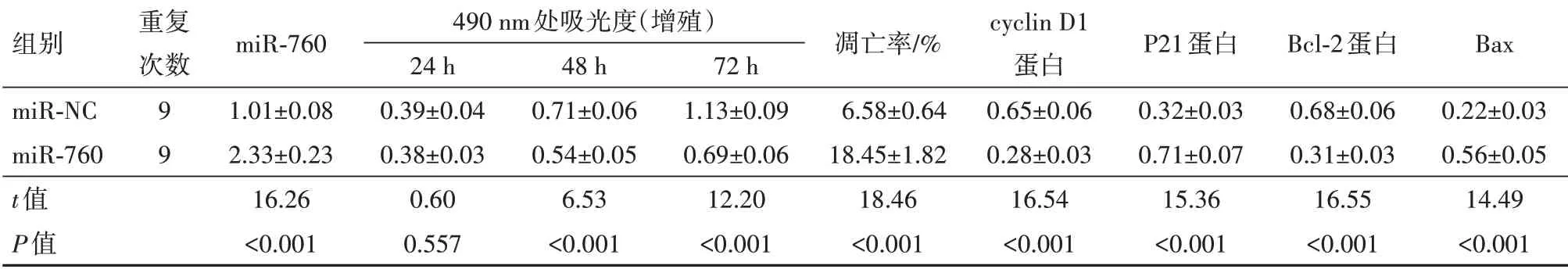
表3 miR-760过表达对前列腺癌DU145细胞增殖和凋亡的影响/±s
注:cyclin D1为细胞周期蛋白D1,P21为周期素依赖激酶抑制剂p21,Bcl-2为B细胞淋巴瘤-2,Bax为Bcl-2相关X蛋白。
组别miR-NC miR-760 t值P值重复次数9 9 miR-760 1.01±0.08 2.33±0.23 16.26<0.001 490 nm处吸光度(增殖)24 h 0.39±0.04 0.38±0.03 0.60 0.557 48 h 0.71±0.06 0.54±0.05 6.53<0.001 72 h 1.13±0.09 0.69±0.06 12.20<0.001凋亡率/%6.58±0.64 18.45±1.82 18.46<0.001 cyclin D1蛋白0.65±0.06 0.28±0.03 16.54<0.001 P21蛋白0.32±0.03 0.71±0.07 15.36<0.001 Bcl-2蛋白0.68±0.06 0.31±0.03 16.55<0.001 Bax 0.22±0.03 0.56±0.05 14.49<0.001

图2 miR-760过表达对前列腺癌DU145细胞增殖、凋亡相关蛋白的影响
2.5下调miR-760表达逆转了抑制FOXD2-AS1表达对前列腺癌DU145细胞增殖和凋亡的作用与si-NC组相比,si-FOXD2-AS1组cyclin D1、Bcl-2表达水平显著降低,miR-760、P21、Bax表达水平显著升高,细胞活性显著降低,细胞凋亡率显著升高(P<0.001);与si-FOXD2-AS1+anti-miR-NC组相比,si-FOXD2-AS1+anti-miR-760组cyclin D1、Bcl-2表达水平显著升高,miR-760、P21、Bax表达水平显著降低,细胞活性显著升高,细胞凋亡率显著降低(P<0.001)(表4)。可见,下调miR-760表达逆转了抑制FOXD2-AS1表达对DU145细胞增殖抑制和凋亡促进的作用。
表4 下调miR-760表达逆转了抑制FOXD2-AS1表达对前列腺癌DU145细胞增殖和凋亡的作用/±s
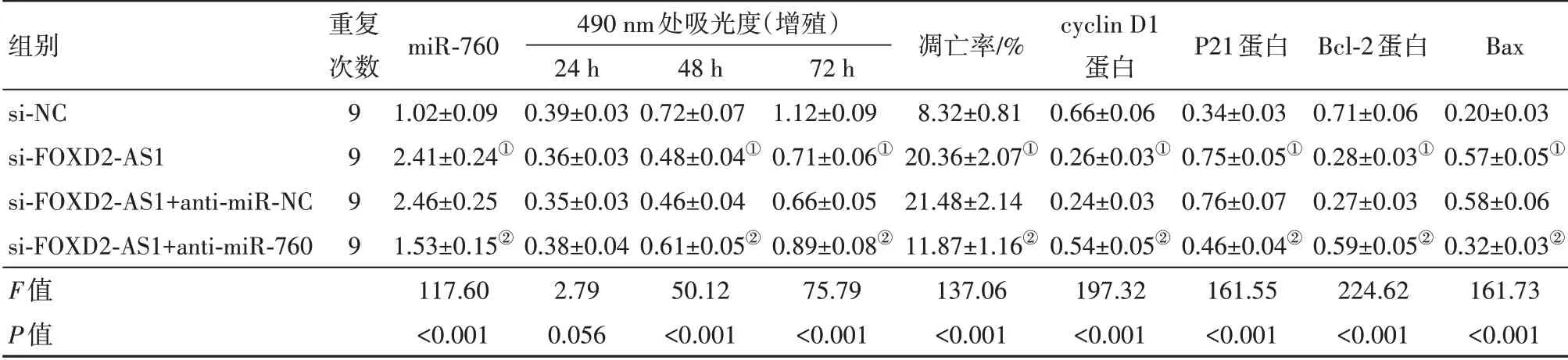
表4 下调miR-760表达逆转了抑制FOXD2-AS1表达对前列腺癌DU145细胞增殖和凋亡的作用/±s
注:cyclin D1为细胞周期蛋白D1,P21为周期素依赖激酶抑制剂p21,Bcl-2为B细胞淋巴瘤-2,Bax为Bcl-2相关X蛋白。①与si-NC组比较,P<0.05。②与si-FOXD2-AS1+anti-miR-NC组比较,P<0.05。
组别si-NC si-FOXD2-AS1 si-FOXD2-AS1+anti-miR-NC si-FOXD2-AS1+anti-miR-760 F值P值重复次数9 9 9 9 miR-760 1.02±0.09 2.41±0.24①2.46±0.25 1.53±0.15②117.60<0.001 490 nm处吸光度(增殖)24 h 0.39±0.03 0.36±0.03 0.35±0.03 0.38±0.04 2.79 0.056 48 h 0.72±0.07 0.48±0.04①0.46±0.04 0.61±0.05②50.12<0.001 72 h 1.12±0.09 0.71±0.06①0.66±0.05 0.89±0.08②75.79<0.001凋亡率/%8.32±0.81 20.36±2.07①21.48±2.14 11.87±1.16②137.06<0.001 cyclin D1蛋白0.66±0.06 0.26±0.03①0.24±0.03 0.54±0.05②197.32<0.001 P21蛋白0.34±0.03 0.75±0.05①0.76±0.07 0.46±0.04②161.55<0.001 Bcl-2蛋白0.71±0.06 0.28±0.03①0.27±0.03 0.59±0.05②224.62<0.001 Bax 0.20±0.03 0.57±0.05①0.58±0.06 0.32±0.03②161.73<0.001
3 讨论
前列腺癌恶性度高,发病机制复杂,研究前列腺癌发病机制对其诊断及治疗、预后及疗效评价具有重要临床意义[8-10]。研究发现lncRNA调节前列腺癌生物学过程,与前列腺癌的复发、转移和预后密切相关[11-12]。有研究报道FOXD2-AS1通过靶向miR-206增强了肝细胞癌细胞的活力和转移,在肝细胞癌中发挥致癌作用[13]。FOXD2-AS1在卵巢癌中高表达,下调FOXD2-AS1通过调控miR-150-5p表达抑制卵巢癌细胞的增殖和迁移[14]。本研究结果显示,前列腺癌细胞中FOXD2-AS1表达水平显著升高,抑制FOXD2-AS1表达能使DU145细胞活性降低,细胞凋亡率显著升高;说明通过抑制FOXD2-AS1表达可以抑制DU145细胞增殖,并促进细胞凋亡。此外,抑制FOXD2-AS1表达还能抑制Bcl-2、cyclin D1蛋白的表达,促进Bax、P21蛋白的表达。
研究表明miRNA参与肿瘤的增殖、迁移、侵袭和凋亡等过程[15-17]。有报道显示miR-760在结直肠癌中低表达,可通过靶向上调EphB3表达,促进结直肠癌细胞增殖、迁移[18]。还有研究发现过表达miR-760可抑制人乳腺癌细胞增殖与迁移[19]。miR-760还能抑制非小细胞肺癌的增殖和转移[20]。本研究显示,前列腺癌细胞中miR-760表达水平显著降低,过表达miR-760,DU145细胞活性降低,细胞凋亡率显著升高;说明miR-760过表达能抑制DU145细胞增殖,并促进细胞凋亡。此外,过表达miR-760还抑制Bcl-2、cyclin D1蛋白的表达,促进Bax、P21蛋白的表达。本研究还发现FOXD2-AS1靶向调控miR-760的表达,抑制miR-760过表达逆转了抑制FOXD2-AS1对前列腺癌细胞DU145增殖抑制和凋亡促进作用。说明FOXD2-AS1可能通过调控miR-760影响前列腺癌细胞的增殖和凋亡。
综上所述,lncRNA FOXD2-AS1可能通过靶向miR-760抑制前列腺癌细胞DU145的增殖、促进其凋亡,可为前列腺癌的预防和治疗提供新靶点。
