肾功能衰竭并发医院获得性感染患者致病菌的分布和耐药特点及患者血清白细胞介素10基因多态性与细菌耐药的相关性▲
2022-06-09黄诗斯廖晓梅彭玉凤
黄诗斯 李 芬 廖晓梅 彭玉凤
(湖南省郴州市第一人民医院检验医学中心,郴州市 423000,电子邮箱:hssjhmb@163.com)
肾功能衰竭是各种肾脏疾病的终末期表现形式,主要表现为生化水平及内分泌代谢严重紊乱。据调查,近20年来,我国肾功能衰竭的发病率为0.01%[1-2]。肾功能衰竭的内科治疗方式主要为透析治疗,以改善患者清除能力及防止并发症发生,治疗目的是代替肾脏的排泄功能 ,清除体内的各种毒素。肾功能衰竭患者常见的并发症包括心血管并发症及医院获得性感染等,其中并发感染患者的病死率达15%~38%,为患者死亡的第二大原因[3-4]。据报道,肾功能衰竭患者医院获得性感染的病原菌主要以革兰阴性菌为主[5],多表现为肺部感染及泌尿系统感染,但是不同研究中主要的病原菌分布及耐药性分析的结果不一[6-7]。医院获得性感染的危险因素包括高龄、低蛋白血症、透析时间等,但目前关于医院获得性感染与患者基因多态性相关性的研究报道较少。有研究显示,白细胞介素10(interleukin 10,IL-10)作为常用的炎症指标,其基因多态性与终末期肾病患者的肺部感染的发生有关[8],而IL-10的基因多态性是否与细菌多重耐药相关尚不可知。本研究探讨肾功能衰竭并发医院获得性感染患者的病原菌分布特点,并分析其血清IL-10的rs1800871、rs1800872及rs1800896基因位点与细菌多重耐药的相关性,为肾功能衰竭并发医院获得性感染患者的治疗提供参考。
1 资料与方法
1.1 临床资料 选取2019年1月至2020年6月就诊于我院肾内科的165例肾功能衰竭患者作为研究对象。纳入标准:(1)患者确诊为肾功能衰竭且年龄≤75岁;(2)无其他严重合并症;(3)在入院之前未发生感染;(4)自愿同意参加本研究并签署知情同意书。排除标准:(1)终末期肾功能衰竭、急性肾功能衰竭患者;(2)合并其他肾脏疾病患者。165例患者中男性109例、女性56例,年龄(48.6±8.37)岁。本研究获得我院医学伦理委员会批准。
1.2 标本采集 按照《全国临床检验操作规程》[9]中的标准规范采集并发医院获得性感染患者的标本,其中疑似呼吸道感染患者采集晨起痰液标本,疑似泌尿系统感染患者采集中段尿标本,皮肤感染患者采集皮肤分泌物标本,其余感染或疑似感染患者采集前臂静脉血。采集完毕之后送至检验科微生物实验室进行细菌培养及耐药性分析。治疗期间,根据需要可多次采集标本进行检验。
1.3 细菌培养及耐药性分析 血液标本采用全自动血培养仪进行菌株鉴定,其余标本接种至培养皿中培养,对培养出的病原菌选择纯菌落后使用全自动细菌检定仪(法国生物梅里埃公司,型号:VITEK®2Compact)进行菌株测定,质控菌株(来自国家卫生健康委员会临床检验中心)为铜绿假单胞菌ATCC27853、金黄色葡萄球菌ATCC25923、大肠埃希菌ATCC25922,每周作标准菌株质控校核1次,保证结果的准确性。药敏实验采用全自动微生物药敏分析仪(德国西门子公司,型号:MicroScan WalkAway 96 Plus)及配套的药敏卡进行检测,头孢哌酮/舒巴坦使用纸片扩散法进行验证,根据美国临床实验室标准委员会推荐的药敏试验操作方法和判断标准对药物的敏感性进行划分[10]。细菌耐药率=(耐药+中介)株数/总株数×100%。多重耐药主要是对临床使用的三类或三类以上抗菌药物同时出现耐药的细菌。
1.4 基因多态性分析
1.4.1 血样标本的采集及保存:采集并发医院获得性感染患者的外周静脉血5 mL于枸橼酸钠抗凝管中,颠倒混匀后填写编号,于-80℃下冷冻保存。
1.4.2 标本DNA提取:按照QIAamp DNA Blood Mini Kit试剂盒(荷兰Qiagen公司,批号:51104)说明书的使用方法,首先将血液标本低温融化后,取0.1 mL标本至离心管中,加入蛋白酶K 20 μL,混匀后加入磷酸缓冲盐溶液(phosphate buffered saline,PBS),加入试剂盒中的Buffer AL 0.2 mL,混匀后56℃消化10 min裂解样本,充分裂解后加入0.2 nL乙醇,8 000 r/min离心1 min洗脱。将滤液放置于新的制备管中,加入0.5 mL的Buffer AW1震荡30 s,8 000 r/min离心1 min;将滤液放置于新的制备管中,再加入0.5 mL的Buffer AW2震荡30 s,14 000 r/min离心1 min;将滤液放置于新的制备管中,最后加入80 μL Buffer AE,静置5 min后8 000 r/min离心1 min,留取收集管中的DNA洗脱液。吸取5 μL DNA提取物,再用蒸馏水稀释至1 mL,移至分光光度计(杭州奥盛仪器有限公司,型号:Nano-300)的比色槽中,读取吸光度260/吸光度280处的比值,比值在1.8~2.0之间表示DNA纯度较好。
1.4.3 基因分型检测:使用高通量单核苷酸多态性(single nucleotide polymorphism,SNP)分型技术对IL-10基因进行分型检测,在 NCBI 数据库(https://www.ncbi.nlm.nih.gov/)中查找IL-10基因的全长序列,根据文献[11-12]筛选IL-10与感染相关的多态性位点,分别为rs1800871、rs1800872及rs1800896。采用 Primer 3软件特异性连接引物,由上海生工生物股份有限公司合成。3个SNP位点的引物序列如下:rs1800871上游引物序列为5′-TCATTCTATGGTGGAGATGG-3′,下游引物序列为5′-TGGGGGAAGTGGCTAAGAGT-3′;rs1800872上游引物序列为5′-CCTCAGCACTACCTGACTAGC-3′,下游引物序列为5′-GGTGAGCACTACCTGACTAGC-3′; rs1800896上游引物序列为:5′-CCAAGACAACACTACTAAGGCTCCTTT-3′,下游引物序列为5′-GCTTCTTATATGCTAGTCAGGTA-3′。
1.4.4 PCR扩增:使用PCR扩增仪(美国Bio-Rad公司,型号:Bio-Rad S1000)进行扩增,PCR总反应体系为50 μL,其中PCR Master Mix 25 μL、模板DNA 2.5 μL、上下游引物各0.25 μL,剩余的用无酶水补齐。rs1800896扩增条件为:94℃,5 min,预变性;94℃,20 s变性;56℃,30 s退火;72℃,30 s延伸;共35个循环;最后72℃末端延伸3 min。rs1800871扩增条件为:94℃,5 min预变性;94℃,20 s变性;62℃,30 s退火;72℃,50 s延伸;共35个循环;72℃末端延伸3 min。rs1800872扩增条件为:94℃,5 min预变性;94℃,20 s变性;60℃,30 s退火;72℃,50 s延伸;共35个循环;72℃末端延伸3 min。
1.4.5 PCR 产物的酶切:使用限制性内切酶对PCR产物进行酶切:将0.2 μL的PCR扩增产物、1 μL缓冲液、0.1 μL限制性内切酶及6.9 μL无酶水加入EP管中,充分混匀后放入37℃的恒温恒湿箱中,反应30 min。rs1800871、rs1800872及rs1800896的限制性内切酶分别为MaeⅢ、RsaⅠ、BseRⅠ。
1.4.6 SNP位点的基因型分型:配制6%聚丙烯酰胺凝胶,加入电泳缓冲液,在加样孔中加入5 μL DNA Marker、1 μL 6×DNA上样缓冲液和5 μL DNA酶切产物,在其余加样孔中依次加入上述缓冲液和DNA酶切产物,调节电压300 V,电泳30 min后取出凝胶。将凝胶放于1‰硝酸银溶液中,待充分染色后收集硝酸银溶液,清洗凝胶后加入氢氧化钠显色溶液至DNA条带显色。观察显色的条带数目并依次记录DNA分型结果。
1.5 医院获得性感染的诊断标准 住院患者在住院期间发生的感染或医院内获得出院后发生的感染,不包括入院前已开始或已存在的感染。
1.6 统计学分析 采用SPSS 16.0统计软件进行统计分析。计数资料以例数和百分比表示,组间比较采用χ2检验或校正χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 肾功能衰竭并发医院获得性感染患者的一般情况 本研究中,肾功能衰竭患者并发医院获得性感染的比例为54.55%(90/165),其中男性63例、女性27例,年龄38~75(54.3±8.65)岁,感染部位多发生在呼吸道及泌尿系统,其他感染部位有消化道、腹膜及导管处皮肤等,具体情况见表1。

表1 肾功能衰竭并发医院获得性感染患者的一般情况
2.2 肾功能衰竭并发医院获得性感染患者的病原菌分布 90例肾衰竭并发医院获得性感染患者共计送检样本134份,送检样本包括痰样本、血样本及分泌物等,同一患者仅保留相同细菌第一株(剔除重复菌株),共培养出108株病原菌,检出阳性率为80.60%。病原菌分布以革兰阴性菌为主,共计64株,占比为59.26%,其中以铜绿假单胞菌、肺炎克雷伯、大肠埃希菌为主。革兰阳性菌共计32株,占比为29.63%,以金黄色葡萄球菌为主。少数患者先后培养出不同病原菌,如铜绿假单胞与白色假丝酵母菌、鲍曼不动杆菌与铜绿假单胞菌等。见表2。

表2 肾功能衰竭并发医院获得性感染患者的病原菌分布情况(n)
2.3 革兰阴性菌对常用抗生素的耐药性分析 细菌耐药性分析结果显示:铜绿假单胞菌中多重耐药菌为4株,占比为10.53%(4/38);铜绿假单胞菌对头孢曲松、亚胺培南及头孢他啶的耐药率较高,对阿米卡星、头孢哌酮/舒巴坦及庆大霉素的敏感性较高。肺炎克雷伯多重耐药菌为2株,占比20.00%(2/10);肺炎克雷伯对头孢他啶、头孢曲松及左氧氟沙星的耐药率较高。大肠埃希菌多重耐药菌为1株,占比12.50%(1/8);大肠埃希菌对头孢曲松、左氧氟沙星及头孢他啶的耐药率较高。见表3。
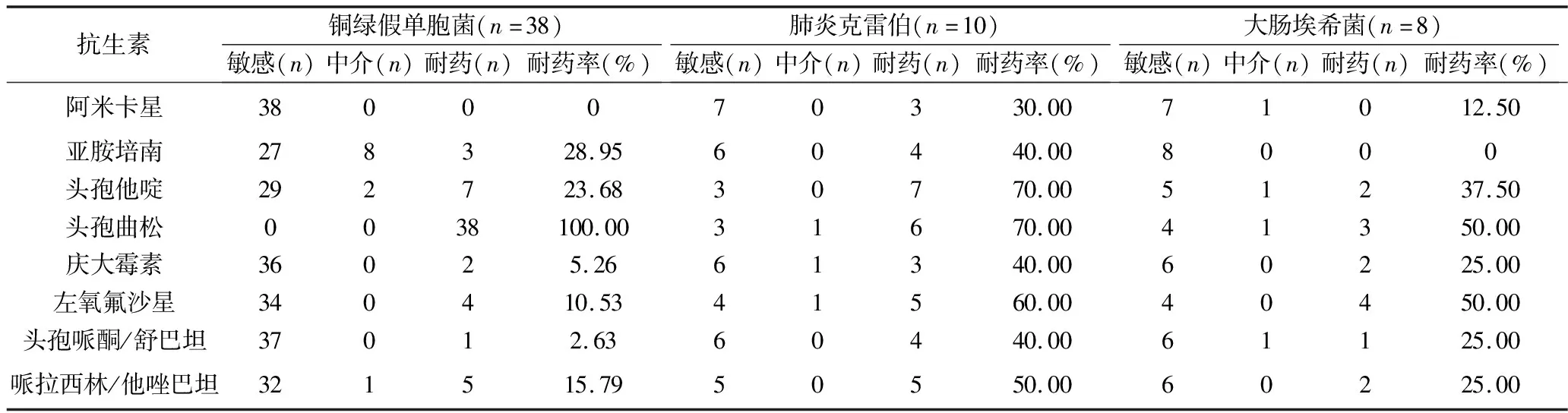
表3 革兰阴性菌对常用抗生素的耐药情况
2.4 革兰阳性菌对常用抗生素的耐药性分析 细菌耐药性分析结果显示:金黄色葡萄球菌中多重耐药菌为6株,占比25.00%(6/24),其中金黄色葡萄球菌对苯唑西林的耐药率较高,对万古霉素的敏感度较高。肺炎链球菌未检出多重耐药菌株,其对阿米卡星的耐药率最高。溶血葡萄球菌未检出多重耐药菌株,其对阿米卡星、苯唑西林、庆大霉素的耐药率较高。见表4。

表4 革兰阳性菌对常用抗生素的耐药情况
2.5 肾功能衰竭并发医院获得性感染患者血清IL-10基因多态性与细菌耐药的相关性分析 根据细菌多重耐药的分析结果,将菌株分为多重耐药组(n=13)及非多重耐药组(n=95),分析血清IL-10基因多态性与细菌多重耐药的相关性。结果显示:rs1800896位点的AA基因型在非耐药组中的比例明显升高,而GG基因型在非耐药组中的比例明显降低(均P<0.05);rs1800871位点及rs1800872位点各基因型与细菌多重耐药无明显相关性(均P>0.05)。见表5。
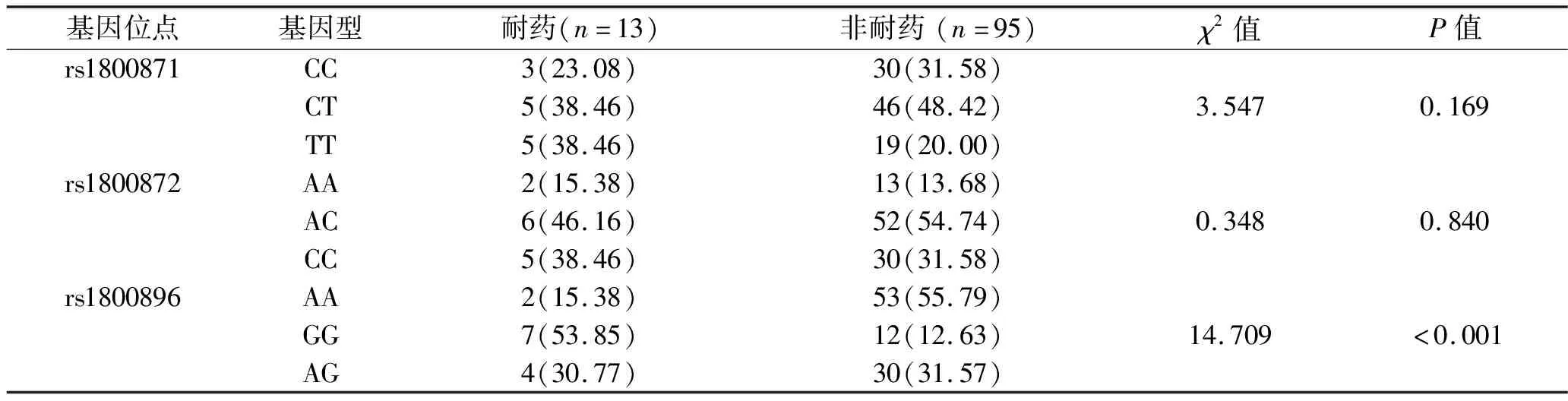
表5 肾功能衰竭并发院内获得性感染患者血清IL-10基因多态性与细菌耐药的相关性[n(%)]
3 讨 论
肾功能衰竭患者由于内环境紊乱,毒素无法及时排出体外,加之蛋白摄入量有限,营养状况欠佳,容易发生感染等并发症[13]。由于肾功能衰竭患者的肾功能减退,极大地限制了其对临床常用抗生素的使用,探讨患者感染的发生原因并分析病原菌的耐药特点,对经验性治疗肾功能衰竭并发感染患者具有重大意义。Laranjinha等[14]研究结果表明,终末期慢性肾功能衰竭患者由于营养不良、机体免疫力下降、肾功能严重损害等导致患者透析耐受性下降,如此恶性循环使患者容易发生肺部感染。吴丽英等[15]研究表明,呼吸道感染是慢性肾功能衰竭血液透析患者合并感染的首要类型,与本研究结果相似。泌尿系统感染是医院获得性感染的常见类型,肾功能衰竭患者由于肾脏过滤功能减退,在少尿或无尿状态下,尿液冲洗作用减退,使定植于泌尿道中的细菌发生逆行感染,从而导致泌尿系统感染发生[16]。本研究发现,泌尿系统感染的症状较呼吸道感染症状隐匿,患者肾衰竭的原发症状与泌尿系统感染症状时常混淆,容易被忽略。尿常规检查简单易行且可判断感染发生情况,因此临床医师应提高肾功能衰竭患者尿常规的检测频率,尽早发现泌尿系统感染的迹象,尽快治疗。
本研究细菌培养及药敏结果显示,患者感染的病原菌以革兰阴性菌为主,其中铜绿假单胞菌占59.38%(38/64),多重耐药菌占10.53%(4/38)。在临床上,医务人员在监测到多重耐药菌后,应当及时下隔离医嘱,并落实消毒隔离等措施,加强院感防控。本研究细菌耐药性分析结果显示,铜绿假单胞菌对头孢曲松、亚胺培南及头孢他啶的耐药率较高,对阿米卡星、头孢哌酮/舒巴坦及庆大霉素的敏感性较高。但是由于患者肾功能减退,选择抗菌药物时应参考患者的内生肌酐清除率[17],若确实需要使用影响肾功能的抗生素时,一定要密切监测患者肾功能。虽然铜绿假单胞菌感染患者对阿米卡星、庆大霉素等氨基糖苷类抗生素的敏感性较高,但由于这两类药物具有肾毒性,应尽量避免使用[18];头孢哌酮/舒巴坦在轻中度肾功能损害时可按原剂量使用,重度肾脏损害时需减量使用,敏感度较高的左氧氟沙星则均需减量使用[19]。本研究结果显示,肺炎克雷伯菌感染时宜选择头孢哌酮/舒巴坦抗感染,大肠埃希菌感染时则可选用亚胺培南、头孢哌酮/舒巴坦及哌拉西林/他唑巴坦抗感染。
本研究中,革兰阳性菌感染病原菌以金黄色葡萄球菌为主,金黄色葡萄球菌对万古霉素的敏感度较高,因此万古霉素可作为甲氧西林耐药金黄色葡萄球菌感染的首选,但是在肾功能衰竭患者中应用万古霉素应当十分小心,如确需使用,应先计算患者的肌酐清除率,根据患者的肌酐清除率确定给药间隔及给药剂量,当肌酐清除率为40~110 mL/min时,建议每12 h给药1次;20~40 mL/min时,每24 h给药1次;小于20 mL/min时,每48 h给药1次;若患者正在进行血液透析,则注意监测患者的血液浓度,使患者的血药谷浓度维持在15 mg/L以上[20]。
IL-10作为炎症反应的关键调控因子,其基因多态性与多种感染性疾病相关[21-23]。研究表明,IL-10参与并调控肾功能衰竭患者的肺部感染,IL-10基因rs1554286位点中的G等位基因和rs1518111位点中的C等位基因可促进肺部感染的发生[24-26]。本研究细菌多重耐药性分析结果显示,IL-10基因rs1800896位点的AA基因型在非耐药组中的比例明显升高,而GG基因型在非耐药组中的比例明显降低(均P<0.05),这提示rs1800896位点的AA基因型为抗生素治疗的有利因素,而GG基因型为抗生素治疗的不利因素。有关溃疡性结肠炎及儿童肠道病毒性感染的研究结果均显示IL-10基因的rs1800871和rs1800872位点的基因多态性与细菌感染或病毒感染的严重程度无关[11,27],本研究结果也显示,rs1800871和rs1800872位点的基因多态性与细菌耐药无明显相关性,提示在IL-10参与的感染中,rs1800871和rs1800872位点可能与感染过程和治疗效果无关。
综上所述,肾功能衰竭患者并发医院获得性感染的概率较高,病原菌以铜绿假单胞菌和金黄色葡萄球菌为主,且多重耐药率较高,选择治疗方案时应以患者的药敏结果及肾功能指标为参考,合理选择抗菌药物,且患者血清IL-10的rs1800896基因多态性与细菌多重耐药相关。但由于本研究样本量有限,今后尚需扩大样本量对患者IL-10基因多态性与不同细菌多重耐药的相关性进行分析,进一步明确IL-10的基因多态性与细菌耐药的关系。
