Toll样受体4及其调控的信号通路关键因子在HIV合并马尔尼菲篮状菌感染患者单核巨噬细胞中的表达水平及临床意义▲
2022-06-09罗朝莲韦吴迪陈荣凤蒋俊俊
陈 洁 罗朝莲,2 韦吴迪 陈荣凤 梁 浩 蒋俊俊,3
(1 广西医科大学再生医学与医用生物资源开发应用省部共建协同创新中心&广西艾滋病防治研究重点实验室,南宁市 530021,电子邮箱:1527692073@qq.com;2 四川省妇幼保健院妇幼健康管理部,成都市 610045;3 广西南宁市第四人民医院,南宁市 530023)
AIDS由HIV感染所致,是全球重大的公共卫生问题之一。2020年全球有3 770万人感染HIV,约有68万人死于AIDS相关疾病[1]。马尔尼菲篮状菌(Talaromycesmarneffei,T.marneffei)感染是好发于AIDS患者的机会性真菌感染之一[2]。研究表明Toll样受体(Toll-like receptor,TLR)4信号通路可以抵抗真菌感染[3]。TLR4识别抗原后通过激活宿主免疫细胞的两大受体蛋白,即髓样分化因子88(myeloid differentiation factor 88,MyD88)和β干扰素TIR结构域衔接蛋白,从而被招募到巨噬细胞等免疫细胞膜表面,引起早期核因子κB(nuclear factor κB,NF-κB)的活化或晚期干扰素的产生[4]。但是TLR4信号通路是否在HIV合并T.marneffei感染患者中发挥抗T.marneffei的作用,目前尚未可知。本研究通过检测HIV合并T.marneffei感染患者与单纯HIV感染患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中巨噬细胞(单核巨噬细胞)的TLR4及其调控的信号通路关键分子的表达水平,探讨TLR4信号通路与HIV合并T.marneffei感染的相关性。
1 资料与方法
1.1 临床资料 遵循知情同意的原则,选取在南宁市第四人民医院确诊为HIV感染但未经抗病毒治疗的35例住院患者作为研究对象,其中男性23例、女性12例。纳入标准:(1)18周岁以上;(2)HIV抗体阳性;(3)知情并同意参加本研究。排除标准:(1)曾接受抗病毒治疗;(2)近期曾接受抗真菌治疗。T.marneffei感染的诊断标准:具有T.marneffei感染相应的症状和体征、影像学表现,以及血液和/或痰液、肺泡灌洗液、脑脊液等体液经真菌培养证实为T.marneffei感染或组织病理学检查发现T.marneffei。根据是否合并T.marneffei感染将患者分为合并T.marneffei感染组(15例)和单纯HIV感染组(20例)。本研究获得广西医科大学医学伦理委员会批准。
1.2 资料收集 收集研究对象的电子病历资料,包括年龄、性别、吸毒情况、合并症情况、CD4+T淋巴细胞计数和病毒载量等信息。其中CD4+T淋巴细胞计数、病毒载量由南宁市第四人民医院检验科分别应用流式细胞仪(美国BD公司,型号:CytoFLEX2)和BD PharmingenTMAPC Mouse anti-Human CD4试剂盒(美国BD公司,生产批号:555349 )、全自动病毒载量分析仪(美国Roche公司,型号:COBAS TaqMan 48)和COBAS TaqMan HIV-1 Test v2.0核酸定量检测试剂盒(美国Roche公司,生产批号:T01352)进行检测。
1.3 相关蛋白表达情况的检测
1.3.1 标本的采集与PBMC的分离:采集研究对象外周静脉血20 mL,运用Ficoll梯度密度法分离PBMC[5],采用细胞计数板法计数后以磷酸缓冲盐溶液(武汉博士德生物工程有限公司,生产批号:PYG0021)将细胞稀释至1×104个/μL备用。
1.3.2 流式细胞术检测单核巨噬细胞中相关蛋白的表达情况:(1)取1×106个/100 μL 1.3.1中的PBMC悬液分装6管,用于细胞内蛋白流式抗体染色。先将CD68抗体(FITC Mouse anti-Human CD68;美国BD公司,生产批号:562117)加入检测管用于标记人PBMC中的巨噬细胞,然后分别加入TLR2抗体(FITC anti-Human CD282 TLR2 Antibody;美国BD公司,生产批号:392308)、TLR4抗体(PE Mouse anti-Human CD284 TLR4 Antibody;美国BD公司,生产批号:564215)、TLR9抗体(APC Rat anti-Human TLR9 Antibody;美国BD公司,生产批号:560428)、TANK结合激酶1(TANK-binding kinase 1,TBK1)抗体(PE Mouse anti-TBK1;美国BD公司,生产批号:558696)。设立空白组,只破膜,不做其他处理。(2)另取1.25×107个/100 μL 1.3.1中的PBMC悬液分装5管,用于细胞外分泌蛋白流式抗体染色。于检测管中分别加入γ干扰素抗体(PerCP-CyTM5.5 Mouse anti-Human IFN-γ;美国BD公司,生产批号:560742)、白细胞介素6(interleukin 6,IL-6)抗体(APC Rat anti-Human IL-6 Clone MQ2-13A5;美国BD公司,生产批号:561441)、MyD88抗体(MyD88 Recombinant Rabbit Monoclonal Antibody SC65-04;美国Thermo Fisher Scientific公司,生产批号:560431)、干扰素调节因子7(interferon regulatory factor 7,IRF7)抗体(Alexa Fluor 488 Mouse anti-IRF-7;美国BD公司,生产批号:558707),空白管不加抗体,4℃避光孵育30 min。(3)CD68抗体的浓度是0.5 mg/mL,加入量为5 μL;TLR2抗体的浓度是1.0 mg/mL,加入量为5 μL;TLR4抗体的浓度是0.5 mg/mL,加入量为5 μL;TLR9抗体的浓度是2.0 mg/mL,加入量为20 μL;TBK1抗体的浓度是1.0 mg/mL,加入量为20 μL;γ干扰素抗体的浓度是0.25 mg/mL,加入量为5 μL;IL-6抗体的浓度是0.25 mg/mL,加入量为5 μL;MyD88抗体的浓度是1 mg/mL,加入量为2 μL;IRF7抗体的浓度是1.0 mg/mL,加入量为20 μL。加入相应的抗体后应用CytoFLEX流式细胞仪(美国Beckman Coulter公司,型号:CytoFLEX2)上机检测。相关蛋白的表达量以平均荧光强度(mean fluorescent intensity,MFI)表示。
1.4 统计学分析 采用Excel 2013与SPSS 23.0软件包建立数据库并进行统计分析。计数资料以例数和百分率(%)表示,组间比较采用χ2检验或Fisher确切概率法;正态分布的计量资料以(x±s)表示,组间比较采用两独立样本t检验;偏态分布的计量资料以[M(P25,P75)]表示,组间比较采用Wilcoxon符号秩和检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者基本信息的比较 两组患者的性别、吸毒情况、合并肺炎的比例、合并肺结核的比例、口腔念珠菌感染率、合并慢性肝炎(HBV或HCV)的比例、巨细胞病毒感染率、疱疹病毒感染率、合并脑膜炎的比例比较,差异均无统计学意义(均P>0.05),而单纯HIV感染组患者的年龄大于合并T.marneffei感染组(P<0.05),提示两组年龄不具备可比性,这可能是因为纳入的样本量太小。合并T.marneffei感染组的CD4+T淋巴细胞计数低于单纯HIV感染组(P<0.05);合并T.marneffei感染组的HIV病毒载量高于单纯HIV感染组,但差异无统计学意义(P>0.05)。见表1。
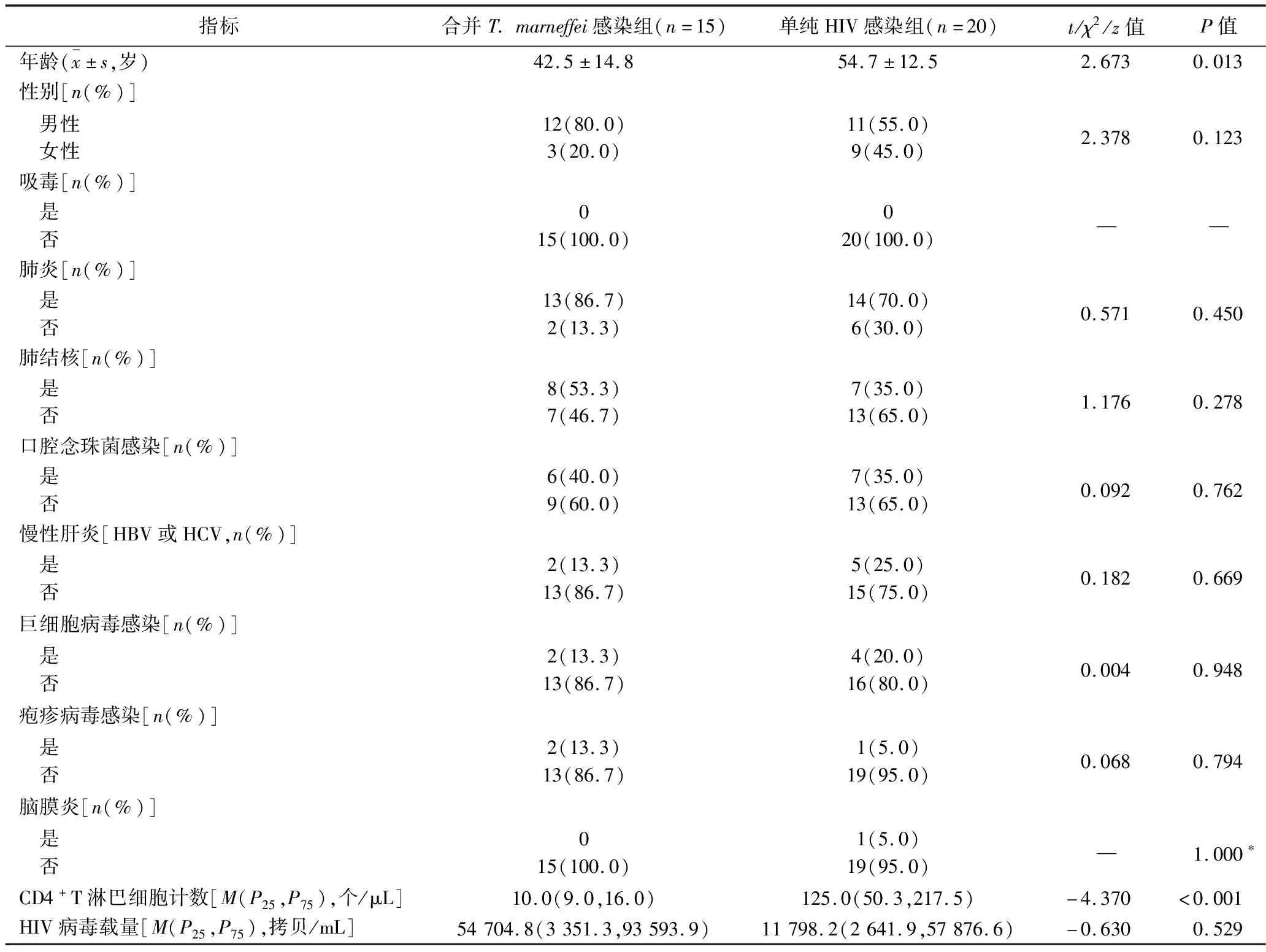
表1 两组研究对象的基本信息的比较
2.2 两组患者单核巨噬细胞中TLR2、TLR4、TLR9蛋白表达水平的比较 合并T.marneffei感染组患者单核巨噬细胞中TLR4蛋白的表达水平高于单纯HIV感染组患者(P<0.05);而两组患者单核巨噬细胞中TLR2和TLR9蛋白的表达水平差异均无统计学意义(均P>0.05)。见表2。
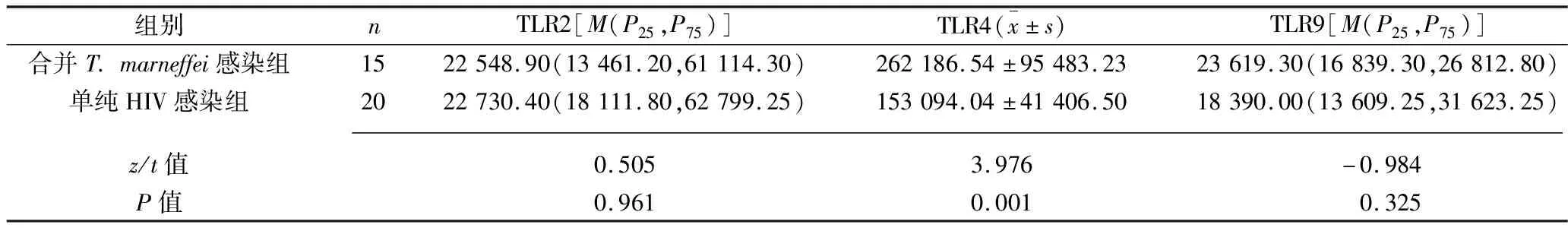
表2 两组单核巨噬细胞中TLR2、TLR4、TLR9蛋白表达水平的比较(MFI)
2.3 两组患者单核巨噬细胞中MyD88、TBK1、IRF7、IL-6、γ干扰素蛋白表达水平的比较 合并T.marneffei感染组患者单核巨噬细胞中TLR4信号通路中间因子MyD88、TBK1、IRF7蛋白及下游炎症因子IL-6、γ干扰素蛋白的表达水平均高于单纯HIV感染组患者(均P<0.05)。见表3。

表3 两组单核巨噬细胞中MyD88、TBK1、IRF7、IL-6、γ干扰素蛋白表达水平的比较(MFI)
2.4 两组不同CD4+T淋巴细胞计数患者单核巨噬细胞中TLR4、TBK1、MyD88、IRF7、IL-6、γ干扰素蛋白表达水平的比较 合并T.marneffei感染组中有14例患者的CD4+T淋巴细胞计数<200个/μL且均<100个/μL;单纯HIV感染组中有16例患者的CD4+T淋巴细胞计数<200个/μL,其中9例患者的CD4+T淋巴细胞计数<100个/μL。在CD4+T淋巴细胞计数<200个/μL的患者中和CD4+T淋巴细胞计数<100个/μL的患者中,合并T.marneffei感染组的TLR4蛋白表达水平,TLR4信号通路中间因子TBK1、MyD88、IRF7的蛋白表达水平均高于单纯HIV感染组,且在CD4+T淋巴细胞计数<200个/μL的患者中,合并T.marneffei感染组的γ干扰素蛋白表达水平高于单纯HIV感染组,在CD4+T淋巴细胞计数<100个/μL的患者中,合并T.marneffei感染组的IL-6蛋白表达水平高于单纯HIV感染组(均P<0.05)。见表4、表5。
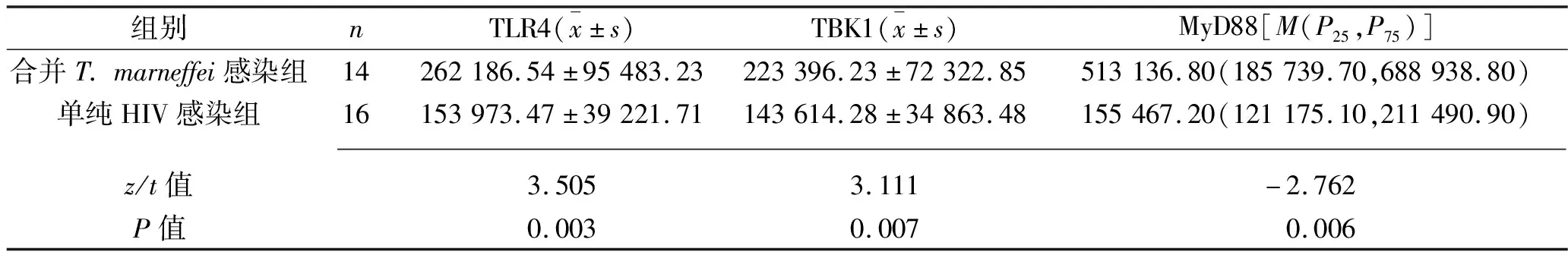
表4 两组CD4+T淋巴细胞计数<200个/μL患者单核巨噬细胞中TLR4、TBK1、MyD88、IRF7、IL-6、γ干扰素蛋白表达水平的比较(MFI)
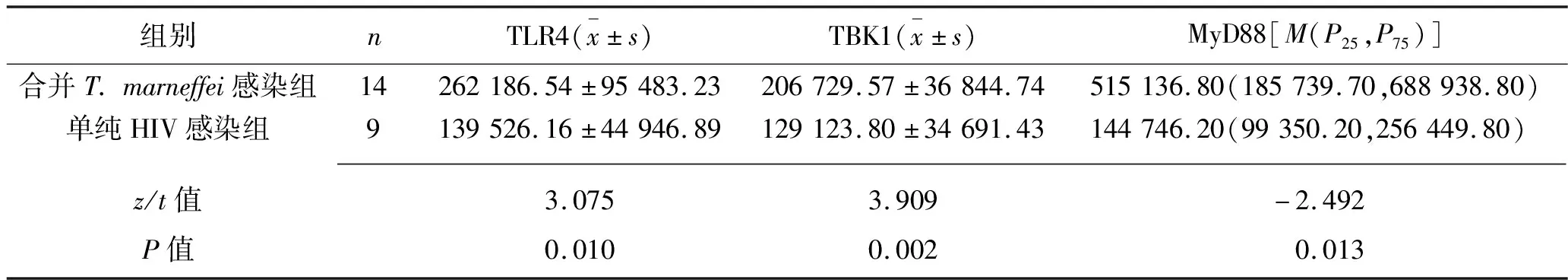
表5 两组CD4+T淋巴细胞计数<100个/μL患者单核巨噬细胞中TLR4、TBK1、MyD88、IRF7、IL-6、γ干扰素蛋白表达水平的比较(MFI)
3 讨 论
已有学者发现,CD4+T淋巴细胞水平低的AIDS患者更容易发生机会性感染, 其中CD4+T淋巴细胞计数<200个/μL的AIDS患者更容易发生T.marneffei感染,而抗病毒治疗不能显著降低AIDS患者感染T.marneffei的风险[6]。由此可见,AIDS患者发生T.marneffei感染等机会性感染的主要原因可能是CD4+T淋巴细胞计数降低,尤其当CD4+T淋巴细胞计数<200个/μL时。本研究结果也显示,合并T.marneffei感染组患者的CD4+T淋巴细胞计数低于单纯HIV感染组(P<0.05),并且合并T.marneffei感染组患者的CD4+T淋巴细胞计数大部分小于100个/μL,这与Chen等[7]的研究结果相似,提示HIV合并T.marneffei感染患者的CD4+T淋巴细胞计数更低。
研究显示,TLR家族能增强宿主对致病性真菌的免疫应答反应[8],TLR4和CD14可作为宿主对新生隐球菌、白色念珠菌等真菌产生免疫应答的受体[9]。本研究结果显示,HIV合并T.marneffei感染患者单核巨噬细胞中TLR4蛋白表达水平明显高于单纯HIV感染的患者(P<0.05),这可能与T.marneffei感染单核巨噬细胞后激活细胞表面的TLR4受体而产生免疫应答有关。
MyD88是除TLR3之外的其余TLR信号通路中的关键转接分子,是TLR4信号通路中信号传向下游必不可少的靶分子[10-11]。有研究显示,免疫重建不良的HIV合并结核病患者的细胞因子失调是由TLR4/MyD88信号通路介导的[12],可见在免疫重建不良的患者中TLR4/MyD88信号通路介导机体免疫的过度激活。本研究结果也显示HIV合并T.marneffei感染患者的MyD88蛋白表达水平高于单纯HIV感染患者(P<0.05),原因可能是TLR4/MyD88信号通路在T.marneffei感染后过度激活,使下游炎症因子IL-6释放增加,从而增强机体对T.marneffei感染的免疫应答,而持续的慢性免疫激活是引起免疫失衡的重要原因。当病毒核酸或其中间代谢产物与模式识别受体结合,可募集相应的接头蛋白、线粒体抗病毒信号蛋白、干扰素基因刺激因子和β干扰素TIR结构域衔接蛋白来活化TBK1,从而促进IRF3和IRF7磷酸化,进一步诱导Ⅰ型干扰素合成[13]。而我们也发现HIV合并T.marneffei感染患者单核巨噬细胞中TBK1蛋白表达水平高于单纯HIV感染者(P<0.05),提示HIV合并T.marneffei感染患者的TBK1处于过度激活状态,可引起单核巨噬细胞的持续激活,使得机体免疫失衡,从而引起机会性感染的发生。IRF7是抗病毒天然免疫中调控Ⅰ型干扰素产生的主要因子,也是TLR通路的中间因子,当TLR识别HIV-1后,肿瘤坏死因子受体相关因子6激活TBK1,同时IRF3、IRF7、NF-κB也被激活,启动天然免疫通路[14-15]。本研究结果显示,HIV合并T.marneffei感染患者单核巨噬细胞中IRF7蛋白表达水平高于单纯HIV感染者(P<0.05),这提示IRF7可在过度激活状态下促进机会性T.marneffei感染的发生,并促进AIDS的疾病进展。
研究表明,IL-6水平与AIDS和AIDS相关免疫重建不良的发生率,以及AIDS相关的病死率呈正相关[16]。本研究结果也显示在CD4+T淋巴细胞计数<100个/μL的患者中,HIV合并T.marneffei感染患者单核巨噬细胞中IL-6蛋白表达水平高于单纯HIV感染者(P<0.05),由此推测IL-6可能与HIV合并T.marneffei感染有关,IL-6 表达水平越高,HIV合并T.marneffei感染的概率可能越大。γ干扰素是单核巨噬细胞最重要的内源性炎症介质之一,在促进单核巨噬细胞的激活和宿主防御中发挥重要作用[17]。本研究结果也显示在CD4+T淋巴细胞计数<200个/μL的患者中,γ干扰素在HIV合并T.marneffei感染患者单核巨噬细胞中的表达水平较单纯HIV感染患者更高(P<0.05),提示γ干扰素的表达水平可能与机体单核巨噬细胞抵抗T.marneffei感染的能力有关。
由于本研究中两组患者之间的CD4+T淋巴细胞计数差异较大,并且不同CD4+T淋巴细胞水平可能会影响不同TLR4及其信号通路相关因子的表达,因此我们分别对CD4+T淋巴细胞计数<200个/μL和CD4+T淋巴细胞计数<100个/μL这两类患者的TLR2、TLR4、TLR9、TBK1、MyD88、IRF7、IL-6、γ干扰素的蛋白表达水平进行分析。本研究结果显示,在CD4+T淋巴细胞计数低于100个/μL的患者中,两组γ干扰素的表达水平差异无统计学意义(P>0.05),提示在免疫状态更差的患者中,γ干扰素可能不会增强机体对T.marneffei的防御能力。而在CD4+T淋巴细胞<200个/μL的患者中,合并T.marneffei感染组γ干扰素的蛋白表达水平高于单纯HIV感染组(P<0.05),提示γ干扰素可能有助于机体抵抗T.marneffei感染。同时,在CD4+T淋巴细胞<100个/μL的患者中,合并T.marneffei感染组IL-6的蛋白表达水平高于单纯HIV感染组(P<0.05),提示IL-6表达的增加可能有助于免疫状态更差的机体抵抗T.marneffei感染。本研究发现,在CD4+T淋巴细胞<200个/μL的患者和CD4+T淋巴细胞计数<100个/μL的患者中,TLR2和TLR9的蛋白表达水平在合并T.marneffei感染组和单纯HIV感染组中的差异均无统计学意义(均P>0.05)。本研究还发现,CD4+T淋巴细胞计数<200个/μL的患者和CD4+T淋巴细胞计数<100个/μL的患者中,合并T.marneffei感染组的TLR4、TBK1、MyD88、IRF7的蛋白表达水平均高于单纯HIV感染组(均P<0.05)。原因可能是T.marneffei通过激活单核巨噬细胞表面的TLR4受体,影响TLR4/MyD88和TLR4/TBK1信号通路,引起中间因子MyD88、TBK1、IRF7表达上调,使免疫处于过度激活状态,导致机体免疫失衡,从而引起机会性感染的发生。
综上所述,TLR4及其信号通路相关因子在HIV合并T.marneffei感染患者单核巨噬细胞中异常表达,这可能是促进HIV合并T.marneffei感染、影响HIV的病程进展的因素之一。其通过以下两个方面起作用:一方面是通过激活MyD88依赖性信号转导路径,促进IL-6等炎症因子的表达,从而参与单核巨噬细胞的炎症免疫反应;另一方面,TLR4通过激活TBK1等激酶,导致转录因子IRF7被激活并入核,并诱导γ干扰素的分泌,提示HIV患者在合并T.marneffei感染后开启了免疫应答反应,这为基于天然免疫模式识别受体开发新的药物靶点和治疗方案提供了依据。但本研究纳入的样本量过少,研究结论尚需扩大样本量进一步研究验证。
