丙酸钠对脂多糖诱导的急性肺损伤大鼠氧化应激和炎症的影响
2022-06-09张婷婷向小琴钟江姗桂雪梅范贤明
张婷婷,向小琴,钟江姗,桂雪梅,范贤明
西南医科大学附属医院 呼吸与危重症医学科,四川泸州,646000
急性肺损伤(acute lung injury,ALI)有着高发病率和高死亡率的特点,其特征是弥漫性肺浸润、毛细血管通透性增加、气体交换受损和肺部炎症,导致一种以低氧为主的急性呼吸衰竭综合征[1]。目前针对ALI 的治疗除了一般支持疗法外,还有一些抗炎药、抗氧化剂、抗凝剂、表面活性剂和神经肌肉阻滞剂等,这些并不能显著提高ALI 患者的生存率和生活质量[2]。ALI 的病理生理基础多种多样,包括免疫细胞过度激活、“细胞因子风暴”、氧化应激、炎症、缺氧、电解质紊乱等[3],其中氧化应激和炎症反应至关重要。脂多糖(lipopolysaccharide,LPS)可与细胞表面的Toll样受体4(toll-like receptor 4,TLR4)结合,经过一系列的反应,最终激活以NF-κB 为主的核内因子,进而产生级联放大效应,形成复杂的系统炎症反应[4],与此同时氧化应激信号可以通过激活Nrf2 而调节LPS 所诱导的炎症反应[5]。最近的研究表明,肠道微生物组可能在肠道以外其他疾病的发病机制中发挥重要作用[6]。这与肠道微生物群产生的短链脂肪酸(short chain fatty acids,SCFAs)有关,这些脂肪酸可以在远处器官引起免疫调节变化[7]。其中,丙酸盐具有抗炎和抗氧化的作用[8],丙酸盐可以显著调节体外和体内肺免疫反应,肠道微生物组丙酸盐产生增加与肺部炎症减少有关[9],此外研究还发现丙酸钠(sodium propionate,SP)对LPS 诱导的肺损伤具有抗炎作用[10]。然而,目前尚不清楚丙酸盐如何在内毒素相关的肺部疾病中发挥作用。因此,本研究的目的是探讨丙酸盐减轻LPS 诱导的ALI 大鼠肺损伤具体机制,为ALI 的治疗提供新的思路。
材料与方法
1 实验动物 20 只健康8 周龄雄性SD 大鼠,体质量(200±20) g,购自西南医科大学动物实验中心,动物生产许可证号:SYSK(川)2018-065。大鼠饲养于SPF 级环境,室温(25±5)℃、湿度40%~60%,大鼠在实验期间自由饮水和摄食。
2 实验试剂 脂多糖和丙酸钠(Sigma 公司);肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),白细胞介素6(interleukin-6,IL-6),IL-10 ELISA 试剂盒(ELK Biotechnology 公司);丙二醛(malondialdehyde,MDA),超氧化物歧化酶(superoxide dismutase,SOD)ELISA 试剂盒(南京建成生物工程研究所);BAC 蛋白定量试剂盒(ASPEN 公司);RIPA 总蛋白裂解液(ASPEN 公司);核转录因 子NF-κBp65、核转录因子p-NF-κBp65、Keap1、NF-E2 相关因子2(Nrf2)兔源单克隆抗体及羊抗兔二抗(ASPEN 公司);ECL 化学发光检测试剂盒(ASPEN 公司)。
3 动物分组及模型建立 适应性喂养1 周后,将SD 大鼠随机分模型组、低剂量SP 组、高剂量SP 组、对照组,每组5 只大鼠。低剂量SP 组和高剂量SP组分别给予300mg/kg、500mg/kg的SP 灌胃,相同条件下,模型组和对照组给予等量的0.9%氯化钠注射液灌胃,1 次/d,持续7 d。最后一次灌胃30min 后予以10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉大鼠,在大鼠充分麻醉后,模型组和SP 组通过气管内滴注LPS(5 mg/kg)的方法制备ALI 模型;相同条件下,对照组气管内滴注等体积0.9%氯化钠注射液。造模完成后6 h 处死大鼠,收集腹主动脉血、肺泡灌洗液(bronchoalveolar lavage fluid,BALF)、肺组织。
4 大鼠动脉血氧分压(PaO2)、肺湿/干质量比(W/D)测定 抽取大鼠腹主动脉血,用血气分析仪检测PaO2。取右肺组织,用PBS 冲洗干净,用滤纸吸干表面水分,称取肺湿重(W);随后将该肺组织放置于70℃烤箱内72 h 直至完全脱水,再次称取肺质量,为肺干重(D),计算相应的肺组织湿/干重比值(W/D)。
5 大鼠肺组织病理学观察 剪取大鼠左肺上叶组织小块,用PBS 冲洗干净,用甲醛固定,石蜡包埋,切成5 µm 厚片,HE 染色。在光学显微镜(200×)下随机选取5 个视野, 按照肺泡水肿、肺泡内充血、炎症细胞浸润、肺间质水肿程度评分,无改变或轻微改变为0 分,轻度改变为1 分,中度改变为2 分,重度改变为3 分,极重度改变为4 分,以平均值作为每个样本的肺损伤病理学评分[11]。
6 大鼠血清和BALF 的收集及细胞因子的测定抽取大鼠腹主动脉血5 mL;打开胸腔,分离出大鼠颈部气管,结扎气管及右主支气管,抽取无菌冰氯化钠溶液2 mL 缓慢注入肺内,反复抽注5 次,收集BALF。将取得的血液及BALF 样本分别在4℃下以3 000 r/min 离心10 min 后收集上清液。按照对应的ELISA 检测试剂盒说明书测定血清和BALF 中TNF-α、IL-6、IL-10 的浓度。
7 大鼠肺组织中MDA、SOD 水平测定 取适量肺组织,制备成组织匀浆。参照相应试剂盒说明书,用黄嘌呤氧化酶法测肺组织SOD 活力,用硫代巴比妥酸法测肺组织MDA 含量。
8 Western blot 法检测肺组织NF-κB p65、p-NFκB p65、Keap1、Nrf2 蛋白的表达 取适量肺组织,加入总蛋白裂解液,提取出总蛋白,用BCA 法测定所提蛋白的浓度,将各组蛋白浓度调整一致,然后加入5×蛋白上样缓冲液,95℃~100℃沸水浴5 min。制胶,每孔上样后进行电泳、转膜。5%脱脂奶粉封闭PVDF 膜1 h 后加入一抗4℃过夜。PBST 洗膜3 次后,加入二抗,室温孵育30 min,用TBST 在室温下摇床上洗4 次。加入适量的ECL 发光液曝光分析。
9 统计分析方法 应用SPSS26.0 统计分析软件,计量数据以±s表示,组间差异采用单因素方差分析,两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
结果
1 各组大鼠动脉血PaO2比较 与对照组相比,模型组大鼠动脉血PaO2明显降低(P<0.05),不同剂量的SP 可显著提高大鼠动脉血PaO2值(P<0.05),且高剂量SP 组动脉血PaO2提高更明显(P<0.05,表1)。
2 各组大鼠肺W/D 值比较 与对照组相比,模型组大鼠肺组织W/D 值明显升高(P<0.05),不同剂量的SP 可显著降低大鼠肺组织W/D 值(P<0.05),且高剂量SP 组W/D 值降低更明显(P<0.05,表1)。
3 各组大鼠肺组织病理学及评分 HE 染色结果显示,对照组大鼠肺组织结构清晰完善,肺泡和肺间质无水肿,肺泡腔无明显充血、出血及炎症细胞浸润;与对照组相比,模型组大鼠肺组织结构紊乱,肺泡水肿明显,肺泡腔出血,伴有炎症细胞广泛浸润,肺泡间隔明显增厚;而SP 组肺组织结构较LPS 组更清晰,且肺泡腔内红细胞、炎症细胞减少,渗出减轻,肺泡间隔增厚减轻,高剂量SP 组较低剂量SP 组病理改善更明显(图1)。与对照组相比,模型组大鼠肺损伤病理学评分值明显升高(P<0.05),SP 组可显著降低大鼠肺损伤病理学评分值(P<0.05),且高剂量SP 组病理学评分值较低剂量SP 组降低更明显(P<0.05,表1)。

表1 各组大鼠PaO2、W/D、肺损伤病理学评分变化(n=5)Tab.1 PaO2,W/D and lung pathological score of mice (n=5)

图1 SP 在LPS 诱导的急性肺损伤大鼠中对肺组织HE 染色的影响 (HE,200×) A:Control group;B:Model group;C:SP (300 mg/kg)group;D:SP (500 mg/kg) groupFig.1 Effect of SP on HE staining of lung tissue in LPS-induced acute lung injury rats (HE,200×) A:control group;B:model group;C:SP (300 mg/kg) group;D:SP (500 mg/kg) group
4 各组大鼠肺组织氧化指标比较 与对照组相比,模型组大鼠肺组织中氧化指标MAD 含量升高(P<0.05),抗氧化指标SOD 活性降低(P<0.05),低、高剂量的SP 使大鼠肺组织的MAD 含量降低(P<0.05),SOD 活性增加(P<0.05);与低剂量SP 组对比,高剂量SP 组大鼠肺组织MAD含量降低,SOD 活性增加更明显(P<0.05,图2)。

图2 SP 对肺组织MDA 含量和SOD 活性的影响[aP<0.05,vs control group;bP<0.05,vs LPS group;cP<0.05, vs SP(300 mg/kg)]Fig.2 Effects of SP on MDA content and SOD activity in lung tissue(± s,n=5) (aP<0.05,vs control group;bP<0.05,vs LPS group;cP<0.05, vs SP [300 mg/kg])
5 各组大鼠血清和肺泡灌洗液炎症因子含量比较与对照组相比,模型组大鼠血清和肺泡灌洗液中的促炎因子IL-6、TNF-α 均显著升高(P<0.05),同时抗炎因子IL-10 呈应激性增加(P<0.05);经SP 干预后,大鼠血清和肺泡灌洗液中的IL-6、TNF-α 显著降低(P<0.05),IL-10 显著升高(P<0.05);与低剂量SP 组相比,高剂量SP 组大鼠血清和肺泡灌洗液中的IL-6、TNF-α 降低,IL-10 升高更明显(P<0.05,图3)。

图3 SP 对急性肺损伤大鼠血清和BALF 中IL-6、TNF-α、IL-10 浓度的影响[aP<0.05,vs Control group;bP<0.05,vs LPS group;cP<0.05,vs SP (300 mg/kg)]Fig.3 Effects of SP on IL-6,TNF-α,IL-10 content in serum and BALF of mice with acute lung injury (n=5) (aP<0.05,vs control group;bP<0.05,vs LPS group;cP<0.05, vs SP [300 mg/kg])
6 各组大鼠肺组织中NF-κB、p65、p-NF-κB p65、Keap1、Nrf2 蛋白的表达比较 与对照组相比,模型组大鼠肺组织p-NF-κB p65 和Keap1 蛋白表达水平升高(P<0.05),而Nrf2 蛋白表达水平降低(P<0.05);低、高剂量的SP 可使p-NF-κB p65 和Keap1 蛋白表达水平降低(P<0.05),使Nrf2 蛋白表达水平升高(P<0.05),且高剂量SP 组肺组织p-NF-κB p65 和Keap1 蛋白表达水平降低,Nrf2 蛋白表达水平升高更明显(P<0.05,图4、图5)。
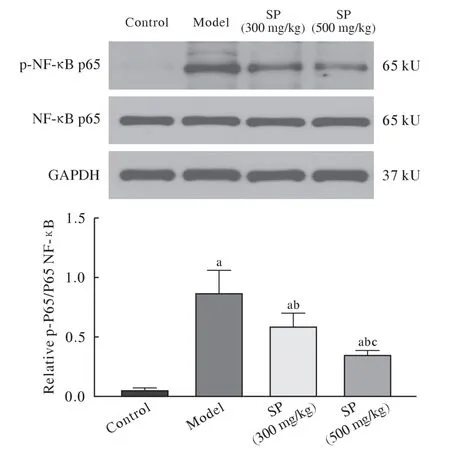
图4 SP 对急性肺损伤大鼠NF-κB p65、p-NF-κB p65 蛋白表达的影响[aP<0.05,vs Control group;bP<0.05,vs LPS group;cP<0.05, vs SP (300 mg/kg)]Fig.4 Effect of SP on the expression of NF-κB p65,p-NF-κB p65 proteins in LPS-induced mice (n=3) (aP<0.05,vs control group;bP<0.05,vs LPS group;cP<0.05, vs SP [300 mg/kg])

图5 SP 对急性肺损伤大鼠肺组织Keap1、Nrf2 蛋白表达的影响[aP<0.05,vs Control group;bP<0.05,vs LPS group;cP<0.05, vs SP (300 mg/kg)]Fig.5 Effect of SP on the expression of Keap1,Nrf2 proteins in LPS-induced mice (n=3) (aP<0.05,vs control group;bP<0.05,vs LPS group;cP<0.05, vs SP [300 mg/kg])
讨论
ALI 是一种严重的肺实质疾病,表现为进行性的呼吸困难,逐渐进展为呼吸窘迫综合征,导致严重的临床并发症及高死亡率[12]。引起ALI 的病因复杂,包括感染因素和非感染因素,临床以感染因素为主。LPS 是革兰阴性菌细胞外膜的主要成分,可刺激肺部炎性细胞募集与激活,导致系统性的炎症反应和免疫激活,产生组织损伤[13]。LPS 诱导的ALI 模型与人类ALI 病理过程的相似[14-15]。本实验采用气管内滴注LPS 方式建立ALI 模型,模型组大鼠肺组织病理变化表现为肺泡出血、肺泡组织破坏、肺泡间隔增厚、炎细胞浸润,可见模型建立成功,并且通过低氧血症、肺组织W/D 升高、炎性因子产生增加等进一步证实。此外,在不同剂量的SP 干预ALI 大鼠后,SP 组大鼠肺组织病理损伤明显减轻、W/D 降低、低氧和严重的炎症状态明显改善,显示出SP 对LPS 诱导的ALI 大鼠的保护作用,并呈一定的剂量依赖性。
SCFAs 主要由在小肠中不被消化和吸收的碳水化合物的糖酵解产生,主要产物为醋酸盐、丙酸盐和丁酸盐。丙酸盐在调节气道和肺部炎症方面起着关键作用[16]。ALI 的本质是炎症反应,其中,NF-κB 信号通路具有重要作用[17]。研究发现,LPS 可以激活NF-κB 信号通路,促进TNF-α、IL-6 等炎症因子的产生和释放[18]。NF-κB 蛋白通常以同源或异源复合物的形式存在,在静息状态下,细胞质中的p50/p65 与其抑制物IκB 结合,处于非活性的状态,而当细胞受到外源性信号刺激后,IκBα 被磷酸化,发生降解,释放出p50/p65,进入细胞核内,诱导靶基因的表达[19]。在本研究中,LPS增加了p65磷酸化和p65NF-κB核易位,这些均被SP 所抑制,同时我们发现暴露于LPS 的大鼠血清和肺泡灌洗液中促炎因子TNF-α、IL-6 的表达增加,抗炎因子IL-10 呈应激性增加,然而SP 给药降低了这些促炎因子的水平,提高了抗炎因子的水平。由此推测,SP 可能通过抑制NF-κB 信号通路而发挥抑制炎症的作用。
氧化应激是ALI 发展的重要因素,目前已有多项研究证明具有抗氧化应激作用的药物对ALI 具有保护作用[20-22]。Nrf2 在维持抗炎和抗氧化中起关键作用,一旦被激活,Nrf2 可以从Keap-1中释放,然后转移到细胞核,与抗氧化反应元件(antioxidant reaction element,ARE)结合,调节下游靶基因NQ01、HO-1 和 GCLC 等的表达转录,从而发挥抗炎、抗氧化作用[23]。研究显示,Nrf2可以抑制NF-κB,从而发挥抗炎作用[24]。本研究中,SP 给药后,Keap1 表达降低,而Nrf2 的表达升高,提示Nrf2/Keap1 信号通路明显被激活,并且肺组织中氧化指标MDA 浓度降低、抗氧化指标SOD 浓度升高也证明了这一结果。由此推测,SP 可能通过抑制Nrf2/Keap1 信号通路从而发挥抗氧化和抗炎作用。
综上所述,本研究表明SP 可以减轻LPS 诱导的ALI,并且这种保护作用呈一定的剂量依赖性。SP 可以减少炎症和氧化应激损伤,其机制可能是调节Keap1/Nrf2 信号通路,抑制NF-κB,减轻肺的炎症和氧化应激,从而改善ALI。但后续还需进一步验证、完善SP 改善ALI 的最佳剂量和其他可能参与的通路,为SP 治疗ALI 提供更全面的理论依据。
