PD-1抑制剂对转移性肺癌患者腹部免疫相关不良事件的影响及影像学特征
2022-06-09郑盛弘赵涵李思晨费苏鹏张玉梅
郑盛弘 赵涵 李思晨 费苏鹏 张玉梅
程序性死亡受体-1(programmeddeath-1,PD-1)抑制剂是一组免疫检查点抑制剂,目前已经被美国食品和药品监督管理局批准用于非小细胞肺癌、黑色素瘤、肾细胞癌等多种肿瘤[1]。PD-1 抑制剂的抗肿瘤活性是基于对PD-1 抑制,PD-1 是表达在调节和效应性T 细胞上的受体,其作用是在被其循环配体激活时抑制T 细胞激活[2]。PD-1 受体被阻断时,T 细胞可对任何易感组织(包括健康组织)发生炎症反应,导致出现一系列潜在的自身免疫样不良事件,临床称为免疫相关不良事件(immune-related adverse events,irAEs)[3]。超过70%的PD-1 抑制剂治疗患者可能发生irAEs,影像学检查是肿瘤诊断、病情评估和预后判定的重要方式,也是临床识别irAEs 的重要方式[4]。腹部irAEs 是Ⅲ~Ⅳ级irAEs最常见的部位,是导致患者停药的最常见irAEs[5]。PD-1 抑制剂治疗转移性非小细胞肺癌(non-smallcell lung cancer,NSCLC)的疗效优于常规化疗,无论是作为一线治疗还是二线治疗,其无进展生存率和总生存率均高于化疗[6]。本研究通过对纳武单抗治疗转移性NSCLC 过程中患者腹部irAEs 的发生率及影像学特征,旨在为PD-1 抑制疗法治疗期管理提供数据支持。
1 资料与方法
1.1 一般资料 选择2018 年1 月至2021 年6 月在金华市人民医院接受纳武单抗转移性NSCLC 患者作为进行回顾性分析,纳入标准为:①经病理证实为NSCLC,影像学明确存在转移(包括肺内转移和肺外转移);②患者年龄>18 岁;③一线或二线接受纳武单抗治疗;④患者临床资料完整。排除标准为:①治疗期间未行影像学检查者;②既往接受过具有肿瘤免疫作用药物治疗者。共纳入126 例,其中男性71 例、女性55 例;年龄31~74 岁,中位年龄61.00 岁。
1.2 方法 所有患者均接受纳武单抗治疗,剂量为3 mg/kg,每次60 min 输注,每2 周1 次,直至出现疾病进展或不可难受的毒性,治疗期间每隔6 周进行一次影像学评价,停药后再次治疗前影像仍作为评估irAEs 的重要标准。所有患者均采用64 排螺旋CT 进行扫描,所有影像学结果均由2 位放射科副主任医师完成分析。使用5 分量表对irAEs 的可能性进行评估:1 分表示绝对不是irAEs,2 分表示可能不是irAEs,3 分表示疑似irAEs,4 分表示可能是irAEs,5 分表示肯定是irAEs。irAEs 包括:①结肠炎/肠炎,包括广泛结肠炎、局限于结肠憩室的节段性结肠炎、小肠结肠炎、肠炎;②肝炎;③胰腺炎;④胆毒性;⑤肾炎;⑥肾上腺炎;⑦结节病样反应;⑧胰腺萎缩;⑨肾上腺萎缩。对irAEs 评分≥3 分的患者由另外两名肿瘤科副主任医师和两名放射科副主任医师进行复评,4 名评估者中有3 名评估irAEs 评分4 分或5 分,则诊断为irAEs 阳性,最后一次随访成像时未发生irAEs 定义为irAEs阴性。
1.3 统计学方法 采用SPSS 25.0 进行统计学数据分析,计数资料采用均数±标准差()表示,组间比较采用t检验,非正态分布资料采用非参数检验,计数资料采用χ2检验。设P<0.05 为差异有统计学意义。
2 结果
2.1 腹部irAEs 发生率和特征 126 例患者中共发生irAEs 29 例,irAEs 发生率23.02%,其中弥漫性结肠炎18 例、局限于结肠憩室的节段性结肠炎3 例、小肠结肠炎2 例、肾上腺炎1 例、肠炎2 例、肝炎3 例,irAEs 发生时间5 d~6 个月,中位时间2.70 月;影像学确诊后平均2.53 个月irAEs 消失。根据是否发生irAEs 将患者分为irAEs 组29 例和非irAEs 组97 例。两组患者性别、年龄、美国东部肿瘤协作组(Eastern cooperative oncology group,ECOG)评分、组织学类型、吸烟史等一般资料见表1。

表1 irAEs和非irAEs组患者一般资料比较
由表1 可见,两组性别、ECOG 评分、组织学类型、吸烟、年龄比较,差异均无统计学意义(χ2分别=0.50、0.07、0.43、0.06,Z=0.60,P均>0.05)。
2.2 肠炎/结肠炎患者影像特征 25 例结肠炎患者发病时间5 d~6 个月,中位发病时间2.50 个月。在25 例患者中19 例出现腹泻,其中7 例患者伴腹痛,15 例患者症状先于影像学表现,3 例患者影像学表现先于临床表现,7 例患者无症状。患者的CT 检查肠系膜充血24 例,占96.00%;肠壁增厚21 例,占84.00%;黏膜增强16 例,占64.00%;结肠液体充盈15 例,占60%。纳武单抗治疗后肠炎患者影像表现见图4。

图4 纳武单抗治疗后肠炎患者影像表现
由图4 A 和4 B 可见,多个小肠环和大肠壁增厚,黏膜增强,充满液体的肠环和肠系膜充血。由图4 C可见,正常的肠袢。
2.3 肝炎患者影像特征 3 例患者经放射性检查显示存在irAEs 相关肝炎,其中1 例在纳武单抗后1.60 个月,患者丙氨酸转氨酶143 U/L,天冬氨酸转氨酶106 U/L,CT 表现为不均匀的实质强化伴低密度区、门脉周围和胆囊水肿。1 例表现为不均匀实质强化伴低密度区、门脉周围和胆囊水肿,发生于用药后2.10 个月,丙氨酸转氨酶132 U/L,天冬氨酸转氨酶116 U/L;1 例患者出现门脉周围水肿,丙氨酸转氨酶245 U/L,天冬氨酸转氨酶106 U/L,发生于用药后2.40 个月。纳武单抗治疗后肝炎患者影像表现见封三图5。
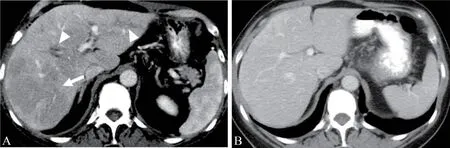
图5 纳武单抗治疗后肝炎患者影像表现
由图5 A 可见,轴向对比增强CT 图像显示不均匀实质增强,低密度区和门静脉周围水肿;由图5 B 可见,1 个月后CT 轴位增强扫描显示肝炎消退。
2.4 肾上腺炎患者特征 1 例肾上腺炎通过PET/CT 检测发现,发病时间服药后5.70 个月,表现为双侧脱氧葡萄糖阳性肾上腺轻度增大,患者表现为疲劳、低血糖和轻度低钠血症。
3 讨论
既往研究显示,纳武单抗治疗的不同癌症患者腹部irAEs 发生率为14%~18%,其中结肠炎/肠炎最常见,发生率为10%~13%。在一项评估PD-1抑制剂治疗患者irAEs 的研究[7]显示,使用纳武单抗或彭布罗利珠单抗治疗的患者中,仅观察到4%的患者出现腹部irAEs[8]。本研究结果显示,23.02%的纳武单抗治疗转移性NSCLC 患者出现明显的irAEs,有无irAEs 的患者人口统计学特征无显著差异,放射性特征是诊断irAEs的主要方式。
本次研究中,腹部放射影像学上的irAEs 发生在治疗开始后的中位时间2.70 个月,在影像学确诊RIAE 后的2.53 个月后消失。这与纳武单抗在NSCLC 患者中的试验结果一致,该研究显示纳武单抗治疗NSCLC 的肝脏和胃肠道irAEs 发作和缓解的中位时间少于3 个月[9]。这种现象可能是由于PD-1抑制剂能够产生强大的记忆T 细胞,即使在没有持续治疗的情况下,也可能导致任何易感组织发生持久的炎症反应。这一发现强调了对irAEs 患者即使中止纳武单抗治疗,也应进行及时随访。
本次研究在25 例患者中观察到肠炎/结肠炎,从开始使用纳武单抗到发展为肠炎/结肠炎中位时间2.50 个月,与既往研究无显著差异。结肠炎/肠炎最常见的CT表现是肠系膜充血和肠壁增厚,与PD-1相关irAEs的放射学特征研究报告相似[9]。既往研究显示PD-1 相关性结肠炎/肠炎中通常观察到泛结肠炎、轻度肠壁增厚和充满液体的结肠[10],这些征象在炎症或感染性肠炎/结肠炎中不太常见,本次研究亦排除了感染性或炎性肠炎/肠炎的患者,以减少误诊。
本次研究中共3 例患者被确诊为irAEs 相关肝炎,均表现为门脉周围水肿,其中2 例表现为不均匀实质强化,所有患者均有轻度肝功能受损。一项PD-1 抑制剂治疗irAEs 的研究显示,39 例影像学确诊的irAEs 患者中2 例患者表现为肝炎,超声表现为脂肪变性、淋巴结病、肝肿大、门脉周围和胆囊水肿[11]。荟萃分析显示,纳武单抗治疗的患者AST 或ALT 升高的发生率约为4%~5%[12]。本次研究肝炎发生率为2.38%,低于上述荟萃分析中AST 或ALT升高作为标准的发病率,可能是因为与根据ALT 和AST 水平升高的研究相比较,本研究根据CT 检查结果定义肝炎更为严格,导致部分ALT 或AST 升高患者未纳入研究。Mekki等[11]研究显示,接受纳武单抗治疗的患者中,肾上腺炎发生率为3.3%。本研究观察到肾上腺炎1 例,双侧FDG 阳性,肾上腺轻度肿大。本研究未观察到胰腺炎病例。Wang等[12]荟萃分析中,胰腺炎的发生率<1%。在接受PD-1 抑制剂治疗的患者中,有1%~2%的患者出现了免疫相关肾炎[13],但本研究未观察到胰腺炎和免疫相关肾炎。本研究中,7 例患者无临床症状,这可能是因为本研究为回顾性研究,临床症状可能未被及时记录有关。对舒尼替尼治疗癌症患者的研究显示,胰腺严重萎缩患者、偶发性肺栓塞及脂肪吸收不良等并发症患者也有类似的无症状表现[14]。对免疫检查点抑制剂临床试验系统回顾性研究,irAEs 的报告存在明显异质性,这表明即使在临床实践中,irAEs 也有可能被低估[15]。因此,本次研究无法确定7 例患者确实无症状,还是临床症状未被记录,irAEs 临床症状表现尚需要纳入更多病例的前瞻性研究进一步探讨。
综上所述,在接受纳武单抗治疗的转移性NSCLC患者中,irAEs发生率为23.02%,鉴于PD-1抑制剂在临床中应用越了越广泛,了解irAEs的发生率和影像学特征有助于为PD-1治疗期管理提供帮助。
