利用硫酸根自由基去除水中双酚A污染的研究综述
2022-06-09高艳娇
高艳娇,陈 玉,张 鑫
利用硫酸根自由基去除水中双酚A污染的研究综述
高艳娇,陈 玉,张 鑫
(辽宁工业大学 土木建筑工程学院,辽宁 锦州 121001)
硫酸根自由基(SO4•-)为主导的高级氧化法由于能够高效降解水中难降解污染物,近年来引起了许多研究人员的关注。双酚A是一种应用较多的化工原料,具有干扰生物体内分泌的特性。对硫酸根自由基氧化双酚A过程中的催化激活方法、反应条件、处理效果及氧化机理进行了研究综述。指出了目前该方法存在的问题,并对今后的研究方向进行了展望。
双酚A;过硫酸盐;硫酸根自由基;内分泌干扰物
水中的内分泌干扰物由于能够造成生物体的内分泌失调,使生物体发生病变,受到了越来越多研究人员的关注。双酚A(bisphenol A,BPA)、壬基酚、辛基酚和雌激素是自然界中发现的4种主要的内分泌干扰物,其中BPA尤为常见,且在几纳克/升的浓度下就能表现出干扰内分泌的活性[1]。BPA是一种重要的塑料添加剂,用于聚碳酸酯容器的制造,如矿泉水瓶和厨房塑料用具等,是一种潜在的食品污染物[2]。BPA具有特殊的雌激素特性,与雌激素受体的亲和力高,对甲状腺激素造成不良影响,促使肥胖,损害肝脏,并增加心血管患病率[3]。BPA在全球地表水环境中的浓度水平从几十纳克/升到几百微克/升,不良影响不容忽视[4]。地表水中的BPA多来自污水厂出水的排放,但污水厂并没有去除BPA的针对性工艺,由于BPA难于生化降解,常规的生化处理工艺对BPA的去除作用不明显[5]。
针对BPA这种难于生物降解的物质,采用具有较强矿化作用的高级氧化法来处理,是一个更好的选择。过去的30年,高级氧化法是以在化学反应过程中生成氧化能力很强的羟基自由基(·OH)来分解有机物[6]。如利用O3/H2O2过氧化系统、H2O2/UV(紫外线)照射系统、H2O2/Fe2+芬顿系统都可以产生·OH,能够降解甚至矿化有机物[7-9]。但是传统的基于·OH的高级氧化法也存在一些缺点[10]:作为氧化剂的H2O2和O3稳定性较差,不便于存储和运输;芬顿反应过程中需要调节pH在3左右,浪费药剂;反应生成大量污泥需要脱水处理,操作繁琐;·OH对有机物的分解没有选择性和针对性。目前硫酸根自由基(SO4•-)氧化作为一种新型高级氧化法用于难降解有机物的处理成为一个研究热点。1980年,Behrman等[11]首次系统地研究了热量存在条件下过硫酸根能分解生成SO4•-,且氧化性增加,使得对SO4•-产生方法的研究得到关注。2006年,张乃东等[12-13]在国内报道了SO4•-用于甲基橙脱色的研究,随后国内利用SO4•-处理水中污染物的研究逐渐增多。SO4•-具有很强的氧化性,标准氧化还原电位为2.6 V,且对含有苯环等物质的氧化更具选择性,半衰期也长于·OH,能够更好地矿化有机物[14]。过硫酸盐(persulfate,PS)是一种强氧化剂,性质稳定,被用来激活产生SO4•-[15]。PS产生自由基的激活方法很多,如能量激活、过渡金属激活、碳材料激活等[16]。本文描述了BPA与PS的性质,介绍各种激活PS产生SO4•-的方法及探讨激活原理,并对SO4•-处理内分泌干扰物BPA的效果与机理等方面进行归纳与分析。
1 BPA及PS的物理化学性质
BPA即2,2-二(4-羟基苯基)丙烷,简称为二酚基丙烷,是具有2个酚官能团的有机化合物(化学结构见图1),可以在催化剂或离子交换树脂存在下,通过苯酚和丙酮在酸性介质中缩合而制得[17]。PS也叫过二硫酸盐,包括过硫酸钠(SPS,化学结构见图2)、过硫酸钾和过硫酸铵等几种物质。过硫酸铵由于铵离子会污染水,一般不用于高级氧化。过硫酸钠和过硫酸钾常被用于激活产生SO4•-,但过硫酸钠价格便宜,比较常用。表1总结了BPA和过硫酸钠的一些性质[14,18]。
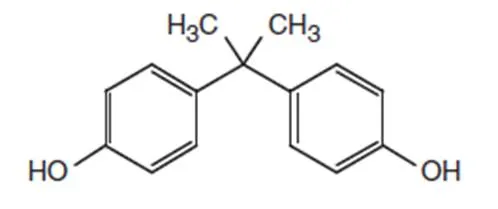
图1 BPA的化学结构

图2 过硫酸钠的化学结构
表1 双酚A与过硫酸钠的物理化学性质
化学名称双酚A过硫酸钠 CAS编号80-05-77727-21-1 分子式C15H16O2Na2S2O8 分子质量228.3 g/mol238.1 g/mol 相对密度1.2 g/cm³2.4 g/cm³ 水中溶解度120~300 mg/L(20~25 ℃)556 g/L(20 ℃) 熔点158~159 ℃100 ℃ 颜色及形状白色针晶或片状粉末白色结晶或粉末 气味轻度酚醛气味无
2 PS的激活及用于BPA的降解
2.1 基于能量输入的激活
通过外部能量的输入可以将PS的过氧化O—O键裂解而产生SO4•-(激活机理见图3),如采用直接加热、超声波、紫外线(UV)照射等方法可以产生能量。能量是激活PS的有效方法,但是要求的能量输入很多,O—O键断裂需要的最小能量约为140 kJ/mol[19],成本相对较高,因此这种激活方法不适用于大规模污染水体中有机物的降解。

图3 能量激活机理
2.1.1 加热激活
Olmez-Hanci等[20]采用加热的方法激活PS产生SO4•-用于降解BPA。在[BPA]=20 mg/L、TOC=16 mg/L、pH=6.5、[S2O82−]=10 mmol/L的初始条件下,研究了温度变化对降解能力的影响。当反应分别在70、60、50 ℃下进行时,在20、30、120 min内检测到BPA完全降解,而在40 ℃的温度下经120 mim反应仅有26%的BPA被去除,且处理过程的活化能确定为184 kJ/mol。Potakis等[21]的研究表明,在pH=6.5、[BPA]=220 μg/L、[PS]=625 mg/L的反应条件下,温度设定在70、60、50 ℃时,分别在3、8、30 min内观察到BPA完全降解,而在40 ℃下经30 mim反应后仅有50%的BPA被去除,这个反应需要活化能为133.5 kJ/mol。可知活化温度至关重要,随着温度从40 ℃提高到70 ℃,BPA去除率可显著提高。但热激活对能量的需求也不是越多越好,如温度过高,会加速副反应[见式(1)],造成SO4•-或·OH的重组,降低对目标污染物的去除效率[20]。

2.1.2 超声波激活
与其他能量激活方法相比,超声波激活具有明显的优势,因为它更安全、更清洁,并且可以在环境条件下操作,超声处理反应器可以使用更长的时间而无需更换,在流动型反应器中可以进行较大规模处理[22]。超声频率在20~1 000 kHz的范围内,会在水中产生局部极端条件,如温度高达5 000 K,压力约为1.013 MPa,引起空化气泡的瞬间崩溃辐射,从而激活PS,另外水分子在超声波的作用下会分解为氢自由基和羟基自由基[见式(2)],同样会加速PS的激活[23]。

Pokhalekar等[24]在30 ℃、超声波频率20 kHz、功率密度在4~60 W/L的范围激活过硫酸钠(1~100 mg/L)来降解BPA(110~450 μg/L),结果表明,单独超声作用可以在这些条件下降解BPA,超声和PS氧化的协同效应,导致形成了·OH和SO4•-,对BPA的降解更加有利。但液相温度的提高,一方面促使PS利用效率提高,另一方面由于“缓冲”现象,降低了声化学活动,因此会存在一个最佳温度与最佳处理效率的问题待解决。
2.1.3 UV激活
与热激活机理相同,紫外线在波长254 nm时可以提供足够的能量来破坏PS的过氧键,S2O82-会分解成2个阴离子自由基SO4•-。污染物也可在没有PS的条件下通过UV的直接光解作用得到降解。
姜能座[25]采用功率9 W、波长254 nm紫外光对过硫酸钾进行激活并降解BPA。研究了光照时间、光照距离、过硫酸钾浓度、BPA浓度和溶液pH对BPA降解效果的影响。BPA浓度随光照时间呈现表观一级反应动力学关系,BPA降解率与光照距离呈负相关。过硫酸钾的初始浓度提高,BPA去除率增加,但BPA初始浓度增加,BPA去除率下降。溶液pH为7.0时,BPA的降解效果最好,30 min时达到了93%。Sharma等[26-27]在室温,中性pH条件下对比了UV/S2O82−和UV/H2O2系统(254 nm波长,40 W功率)对BPA的处理效果。发现前者在S2O82−/BPA的摩尔比为5.7∶1时对BPA的去除率为95%,后者在H2O2/BPA的摩尔比为53.4∶1时对BPA的去除率为85%。UV/S2O82−系统在UV/H2O2系统摩尔浓度1/10的条件下,取得了高出10%的BPA去除率。在UV/S2O82−(PS=1.26 mmol/L)中BPA的去除随着BPA的初始浓度(0.04~0.31 mmol/L)增加而减小,且总有机碳TOC值也随着光照时间的增加得以降低。该降解动力学可以很好地用伪一级速率方程式表示,降解常数随着BPA浓度的降低而增加,当SPS/BPA最优摩尔比为5.7∶1时,=0.009 min-1.
2.2 非均相过渡金属激活
过渡金属Zn、Cu、Ag和Fe可以激活PS产生SO4•-,但Fe作为非均相催化剂具有更多的优势,Fe成本低,且环保对生物体无毒性。Fe激活PS的机理包括2步,首先零价铁可在厌氧[式(3)]或好氧[式(4)]条件下发生腐蚀生成2价铁,也能被过硫酸根氧化成2价铁[式(5)、图4],然后2价铁与过硫酸根发生氧化还原反应,生成3价铁、硫酸根和硫酸根自由基[式(6)][28]。3价铁还可以被零价铁还原成2价铁[式(7)]。如果水中有过量的过硫酸根或2价铁,它们还会消耗SO4•-[式(8)、式(9)、图5][29]。因此氧化剂与催化剂的比例是反应中一个重要的控制参数。








图5 自由基的清除
Zhao等[29]研究了Fe激活过硫酸钠去除BPA与磷酸盐,当[BPA]=22 μm、[PS]=0.2 mmol/L、pH=6.0、=60 min的条件下随着零价铁ZVI浓度从0.1 g/L增加到0.5 g/L时,BPA去除率从30%提高到91%。当[ZVI]=0.1 g/L不变时,PS浓度从0.1 mmol/L增加到0.5 mmol/L,BPA去除率为从19%升高到82%。另外当磷酸盐的浓度在5~10 mg/L范围时,会对BPA的降解有轻微的抑制作用。将这一方法用于实际污水厂出水的处理,得到了74%的BPA去除率及91%的磷酸盐去除率。除磷机理为反应过程中产生的3价铁对磷的去除作用。Girit等[30]在初始[BPA]= 20 mg/L、TOC=16 mg/L、[PS]=2.5 mmol/L、[nZVI]=1 g/L、pH=5.0、=25 ℃、=60 min的条件下用纳米铁nZVI激活过硫酸盐,取得了100%的BPA去除率和80%的TOC去除率。从上述研究可知,零价铁和纳米铁都可以有效地去除BPA并去除一定比例的TOC。纳米铁虽然效率高于零价铁,但纳米铁容易流失,研究纳米铁的包裹物或支持物,可推动纳米铁的研究,有利于纳米铁的实际应用。
2.3 均相过渡金属激活
过渡元素离子(Fe2+,Co2+,Ni2+,Cu2+,Ag+)均可作为均相催化剂,发生式(10)中的化学反应,使PS还原为SO4•-,自身变成高价离子[31]。Co2+、Ni2+被确定有着较佳的催化作用,但是它们存在一定的毒性,限制了其应用。而且Cu2+与Ag+成本都很高。Fe2+是最常用的均相金属催化剂,但也不是最理想的,因为过量的Fe2+可以充当SO4•-和PS的清除剂[32]。所以有时考虑用零价铁可以作为溶解铁的缓释源离子,激活PS产生SO4•-。
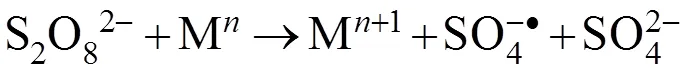
Jiang等[33]的研究揭示了初始的S2O82-和Fe2+浓度对BPA去除率有重要影响。随着初始S2O82-浓度的增加,BPA去除效率得到了加强。但Fe2+浓度对BPA去除率的影响比较复杂,过低的Fe2+浓度会使自由基的量产生不足,减弱反应速率,过高浓度的Fe2+会发生式(9)这样的反应,消耗自由基,也同样抑制反应。如果不是一次性供应Fe2+,而是可持续供应Fe2+,便可更好地控制与利用生成的SO4•-用于降解和矿化BPA。
2.4 非均相碳基材料催化激活
碳基材料作为在高级氧化法中激发产生自由基的无金属催化剂引起了很多关注,因为其不会产生二次金属污染。碳基材料的催化活性取决于碳材料的类型,如活性炭、生物炭、还原氧化石墨烯(rGO)、碳纳米管(CNTs)和石墨碳氮化物(g-C3N4)等[34]。碳基材料可以通过自由基和非自由基途径激活PS,机理见图6。碳的比表面积、形态、石墨化程度及表面化学特性决定其催化基团承载氧化还原活性功能的程度。此外,基于碳基材料的吸附能力,也能去除部分污染物。CNTs、rGO、g-C3N4等因独特性更受关注,有望在水处理中作为金属基催化剂的替代品,如替代Co、Fe或Mn,从而避免金属浸出和相关水体中的二次污染[35]。

图6 碳材料催化PS的机理
Olmez-Hanci等[36]采用rGO催化过硫酸盐降解BPA,将GO加热还原膨胀成rGO薄片,并采用化学方法进行改良,以使rGO获得具有良好催化活性的点位。改良后的rRGO微晶具有7.6 nm直径的层状结构,共5~6层,距离为0.36 nm,改变了结构特征并形成了更活跃的表面区域。BET比表面积从原来的26.63 m2/g增加到了287.52 m2/g。在初始BPA浓度0.125 mmol/L,PS浓度度为2 mg/L,pH为6.5的条件下,利用0.01 g/L rGO对去离子水中的PS进行催化激活并降解BPA。在反应达30 min时BPA的去除率达到了98%,这说明rGO对过硫酸盐的催化作用能力很强。rGO激活PS形成硫酸自由基的反应见式(11)。研究还表明,rGO浓度的增加,缩短了达到一定BPA去除率所需的时间,但PS浓度的增加与BPA的去除并不是正相关,有一个最优PS的存在,要通过实验条件来确定。因为过多的PS会形成如式(8)的副反应,捕捉自由基,从而抑制BPA的降解。

Wang等[37]研究了用水热法氮改性的还原氧化石墨烯NrGO激活过硫酸盐,并研究了吸附与催化的协同作用,改性增强了吸附和催化能力。对于初始BPA浓度为0.385 mmol/L的NrGO的吸附容量评估为1.56 mmol/g,是无氮rGO吸附能力的1.75 倍。NrGO的对PS激活降解PBA的表观降解常数是0.71 min-1,是无氮的700倍。使用NrGO(120 mg/L)和过硫酸盐(0.6 mmol/L)pH为6.6的情况下反应17 min几乎完全去除了BPA(0.385 mmol/L)。
Wang等[38]采用热分解方法合成氮和硫双掺杂还原氧化石墨烯(N,S-rGO),可以有效地活化PS产生活性自由基。使用Nr-RGO(50 mg/L)和过硫酸钾(0.9 mmol/L)在pH为6.64条件下下,在30 min内完全降解双酚A(20 μg/L),表现出很强的催化氧化能力。
3 自由基的识别
在采用各种方法激活PS的过程中,水中会产生自由基,在不同的pH及氧化剂条件下,不同的自由基所占的主导地位不同。通常需要通过自由基清除实验来鉴别水中存在哪些自由基。Olmez-Hanci等[36]采用乙醇EtOH与叔丁醇TBA作SO4•-和·OH的识别物质。EtOH(含有α-H)能迅速地同时与SO4•-和·OH反应,反应的速率分别在1.2×109~2.8×109mol/(L·s)和1.6×107~7.7×107mol/(L·s)之间,因此可同时识别2种自由基[39]。另外采用TBA作为·OH的识别物质,TBA(不含α-H)能与·OH迅速反应,反应速率常数为3.8×108~7.6×108mol/(L·s),但与SO4•-反应的速率常数仅为4.0×105~9.1×105mol/(L·s),前者是后者速率的1 000倍,所以TAB仅用来识别·OH[40]。在自由基降解有机物如BPA的过程中,在填加识别物质前后如果BPA降解率发生变化,就说明主导的自由基被清除。根据投入的识别物质就可判断出哪种自由基被清除,水中哪个自由基占主导。如投入TBA,BPA降解率比没投入前变化不大,说明水中的主要自由基是硫酸自由基,因为TBA只清除了羟基自由基,对硫酸根自由基没有影响,因而没有影响BPA的降解效率。
4 BPA的降解产物
BPA被硫酸根自由基氧化后,即使测定BPA的降解效率很高,但并不意味着有害的BPA都变成无害的物质,只有BPA完全矿化为CO2和H2O时才安全,降解机理见图7。

图7 BPA降解机理
如果BPA降解效率高的同时,TOC也得到了降解,才证明BPA被矿化。根据一些文献得到的BPA降解中间产物主要有丙烷-1,2,3-三醇、对羟基苯乙酮、4-羟基苯乙酮、丙酮、3甲基丁酮、苯酚、对苯二酚、4-异丙基苯酚、富马酸、马来酸、丙二酸、2-羟基丙酸和苯醌等[29,39-40]。BPA降解的中间产物种类很多,有的甚至毒性比BPA大,所以调整反应参数尽量矿化BPA是关键。
5 结论与展望
回顾了过硫酸盐的能量激活法、均相过渡金属激活法、非均相过渡金属激活法及碳基材料催化激活法,并对产生的自由基降解BPA的应用进行了归纳,可以看出通过催化激活过硫酸盐产生硫酸自由基降解有机污染物已经成为有前途的一种新型高级氧化法。
在能量激活方法中,超声波与UV激活比较环保,但不适合于大水量的处理,今后可以考虑与其他激活方法复合使用,比如UV/金属激活、超声波/金属激活,并需在不同水质条件下进一步研究激活条件。
与钴、镍、铜和银等其他过渡金属催化剂相比,零价铁和2价铁是更经济环保的激活剂,并且也是最广泛使用的激活剂,但由于零价铁能持续供应2价铁源,防止过量的2价铁离子消耗自由基,目前有替代2价铁的趋势。但零价铁的激活还需考虑控制其腐蚀或溶解度问题,可考虑pH控制,或添加EDTA等螯合剂,寻求反应的最佳条件。对于纳米铁用于激活的研究仍需注意纳米铁的泄露问题,可以开展纳米铁的包裹及支持体研究,比如采用壳聚糖包裹或生物碳支持等。
新型负载型催化剂石墨烯避免了金属催化剂的二次污染问题,是一种有前途的材料,但其改性过程也比较复杂,需使用化学药剂,仍需在达到处果效果的同时降低成本。
另外在应用硫酸自由基处理BPA时局限于实验室配水研究的阶段,对于真实废水的处理还有待研究,还应考虑水中一些因素对处理效果的影响,更应考虑BPA的矿化及中间产物的生成,必要时还要做毒理学实验,评价中间体的毒性。
总之,硫酸根自由基高级氧化法具有羟基自由基氧化法所没有的优势,在未来的水处理中,尤其是对BPA这类难降解的内分泌干扰物去除的应用范围会越来拓宽。
[1] Jiang J Q, Zhou Z, Sharma V K. Occurrence, transportation, monitoring and treatment of emerging micro-pollutants in waste water — a review from global views[J]. Microchemical Journal, 2013, 110: 292-300.
[2] 李康, 郭劲松, 何靖, 等. 改性无烟煤去除水中内分泌干扰物的性能探究[J]. 安全与环境学报, 2017, 17(2): 665-670.
[3] Olmez-Hanci T, Arslan-Alaton I, Genc B. Bisphenol A treatment by the hot persulfate process: oxidation products and acute toxicity[J]. Journal of Hazardous Materials, 2013, 263: 283-290.
[4] Wilkinson J, Hooda P S, Barker J, et al. Occurrence, fate and transformation of emerging contaminants in water: An overarching review of the field[J]. Environmental Pollution, 2017, 231: 954-970.
[5] Can Z S, Fırlak M, Kerç A, et al. Evaluation of different wastewater treatment techniques in three WWTPs in Istanbul for the removal of selected EDCs in liquid phase[J]. Environmental Monitoring and Assessment, 2014, 186(1): 525-539.
[6] 魏令勇, 郭绍辉, 阎光绪. 高级氧化法提高难降解有机污水生物降解性能的研究进展[J]. 水处理技术, 2011, 37(1): 14-19.
[7] 徐军, 涂勇, 武倩, 等. 臭氧、臭氧/双氧水催化氧化深度处理化工废水[J]. 工业水处理, 2017, 37(4): 62-65.
[8] Liu Z, Wardenier N, Hosseinzadeh S, et al. Degradation of bisphenol A by combining ozone with UV and H2O2in aqueous solutions: mechanism and optimization[J]. Clean Technologies and Environmental Policy, 2018, 20(9): 2109-2118.
[9] Escalona I, Fortuny A, Stueber F, et al. Fenton coupled with nanofiltration for elimination of bisphenol A[J]. Desalination, 2014, 345: 77-84.
[10] Brienza M, Katsoyiannis I. Sulfate radical technologies as tertiary treatment for the removal of emerging contaminants from wastewater[J]. Sustainability, 2017, 9(9): 1604.
[11] Behrman E J, Edwards J O. The thermal decomposition of peroxodisulfate ions[J]. Reviews in Inorganic Chemistry, 1980, 2: 179-206.
[12] 张乃东, 张曼霞, 彭永臻. S2O82-派生氧化法催化降解水中的甲基橙[J]. 催化学报, 2006(5): 445-448.
[13] 张乃东, 张曼霞, 孙冰. 硫酸根自由基处理水中甲基橙的初步研究[J]. 哈尔滨工业大学学报, 2006(4): 636-638.
[14] Wacławek S, Lutze H V, Grübel K, et al. Chemistry of persulfates in water and wastewater treatment: A review[J]. Chemical Engineering Journal, 2017, 330: 44-62.
[15] 张炳烛, 张钊, 王昆亭, 等. 过硫酸盐非均相催化剂进展[J]. 应用化工, 2018, 47(1): 176-180.
[16] 赵文莉, 王广智, 弋凡, 等. 过硫酸盐活化技术的研究进展[J]. 现代化工, 2018, 38(7): 53-56.
[17] 徐朋飞, 王光辉, 李鹏, 等. 环境内分泌干扰物双酚A的吸附研究进展[J]. 工业水处理, 2018, 38(4): 17-20.
[18] Ghazali F M, Johari W L W. The occurrence and analysis of bisphenol A (BPA) in environmental samples–a review[J]. Journal of Biochemistry, Microbiology and Biotechnology, 2015, 3(2): 30-38.
[19] He X, Armah A, O'Shea K E, et al. Kinetics and mechanisms of cylindrospermopsin destruction by sulfate radical-based advanced oxidation processes[J]. Water Research, 2014, 63: 168-178.
[20] Olmez-Hanci T, Arslan-Alaton I, Genc B. Bisphenol A treatment by the hot persulfate process: oxidation products and acute toxicity[J]. Journal of Hazardous Materials, 2013, 263: 283-290.
[21] Potakis N, Frontistis Z, Antonopoulou M, et al. Oxidation of bisphenol A in water by heat-activated persulfate[J]. Journal of environmental management, 2017, 195: 125-132.
[22] Ghanbari F, Moradi M. Application of peroxymonosulfate and its activation methods for degradation of environmental organic pollutants[J]. Chemical Engineering Journal, 2017, 310: 41-62.
[23] Darsinou B, Frontistis Z, Antonopoulou M, et al. Sono-activated persulfate oxidation of bisphenol A: kinetics, pathways and the controversial role of temperature[J]. Chemical Engineering Journal, 2015, 280: 623-633.
[24] Pokhalekar P, Chakraborty M. Degradation of bisphenol A and 4-tert-octylphenol: a comparison between ultrasonic and photocatalytic technique[J]. Desalination and Water Treatment, 2016, 57(22): 10370-10377.
[25] 姜能座. 254 nm紫外光活化过硫酸钾降解双酚A的研究[J]. 复旦学报: 自然科学版, 2015, 54(5): 648-653.
[26] Sharma J, Mishra I M, Kumar V. Degradation and mineralization of Bisphenol A (BPA) in aqueous solution using advanced oxidation processes: UV/H2O2and UV/S2O82−oxidation systems[J]. Journal of Environmental Management, 2015, 156: 266-275.
[27] Sharma J, Mishra I M, Kumar V. Mechanistic study of photo-oxidation of Bisphenol-A (BPA) with hydrogen peroxide (H2O2) and sodium persulfate (SPS)[J]. Journal of Environmental Management, 2016, 166: 12-22.
[28] Oh W D, Lim T T. Design and application of heterogeneous catalysts as peroxydisulfate activator for organics removal: An overview[J]. Chemical Engineering Journal, 2019, 358: 110-133.
[29] Zhao L, Ji Y, Kong D, et al. Simultaneous removal of bisphenol A and phosphate in zero-valent iron activated persulfate oxidation process[J]. Chemical Engineering Journal, 2016, 303: 458-466.
[30] Girit B, Dursun D, Olmez-Hanci T, et al. Treatment of aqueous bisphenol A using nano-sized zero-valent iron in the presence of hydrogen peroxide and persulfate oxidants[J]. Water Science and Technology, 2015, 71(12): 1859-1868.
[31] Hu P, Long M. Cobalt-catalyzed sulfate radical-based advanced oxidation: a review on heterogeneous catalysts and applications[J]. Applied Catalysis B: Environmental, 2016, 181: 103-117.
[32] Shang W, Dong Z, Li M, et al. Degradation of diatrizoate in water by Fe (Ⅱ)-activated persulfate oxidation[J]. Chemical Engineering Journal, 2019, 361: 1333-1344.
[33] Jiang X, Wu Y, Wang P, et al. Degradation of bisphenol A in aqueous solution by persulfate activated with ferrous ion[J]. Environmental Science and Pollution Research, 2013, 20(7): 4947-4953.
[34] Chen X, Oh W D, Lim T T. Graphene-and CNTs-based carbocatalysts in persulfates activation: Material design and catalytic mechanisms[J]. Chemical Engineering Journal, 2018, 354: 941-976.
[35] Cheng X, Guo H, Zhang Y, et al. Non-photochemical production of singlet oxygen via activation of persulfate by carbon nanotubes[J].Water Research,2017,113:80-88.
[36] Olmez-Hanci T, Arslan-Alaton I, Gurmen S, et al. Oxidative degradation of Bisphenol A by carbocatalytic activation of persulfate and peroxymonosulfate with reduced graphene oxide[J]. Journal of Hazardous Materials, 2018, 360: 141-149.
[37] Wang X, Qin Y, Zhu L, et al. Nitrogen-doped reduced graphene oxide as a bifunctional material for removing bisphenols: synergistic effect between adsorption and catalysis[J]. Environmental Science & Technology, 2015, 49(11): 6855-6864.
[38] Wang Q, Li L, Luo L, et al. Activation of Persulfate with Dual-doped Reduced Graphene Oxide for Degradation of Alkylphenols[J]. Chemical Engineering Journal, 2019, 376: 120891-120901.
[39] Gao F, Li Y, Xiang B. Degradation of bisphenol A through transition metals activating persulfate process. Ecotoxicology and Environmental Safety, 2018, 158: 239-247.
[40] Liu C M, Diao Z H, Huo W Y, et al. Simultaneous removal of Cu2+and bisphenol A by a novel biochar-supported zero valent iron from aqueous solution: Synthesis, reactivity and mechanism[J]. Environmental Pollution, 2018, 239: 698-705.
Review of Removing Bisphenol A Pollution from Water by Sulfate Radicals
GAO Yan-jiao, CHEN Yu, ZHANG Xin
(School of Civil and Architectural Engineering, Liaoning University of Technology, Jinzhou 121001, China)
The advanced oxidation process dominated by sulfate radicals (SO4•-) has attracted the attention of many researchers in recent years due to its ability to efficiently degrade refractory pollutants in water. Bisphenol A, a common chemical raw material, has the characteristics of interfering with the secretion of organisms. The catalytic activation method, reaction conditions, treatment effects and oxidation mechanism of sulfate radical oxidation towards bisphenol A were reviewed. The problems existing in the current method are pointed out, and the future research directions are prospected.
bisphenol A; persulfate; sulfate radicals; endocrine disrupting contaminants
10.15916/j.issn1674-3261.2022.02.009
TQ085
A
1674-3261(2022)02-0111-07
2021-04-14
辽宁省教育厅高校科研基金项目(JZL202015406)
高艳娇(1974-),女,吉林公主岭人,教授,博士。
责任编辑:孙 林
