85例肺间质纤维化合并肺癌的临床特点及CT征象分析*
2022-06-09曹雷刘娜兰超,*
曹 雷 刘 娜 兰 超,*
1.保定市第一中心医院西院医学影像三科(河北 保定 071000)
2.保定市第一医院感染科(河北 保定 071000)
肺间质纤维化(pulmonary interstitial fibrosis,IPF)是机体肺间质呈纤维病变的肺部疾病,主要病变部位位于肺间质,可部分累及肺泡上皮细胞及肺毛细血管,其致病原因复杂多样,主要有环境因素(粉尘、工业废气等)、病毒或细菌感染、药物性损伤、遗传因素等,临床主要表现为活动后气促、咳嗽咳痰、发热、紫绀、杵状指等,该病起病隐匿,早期症状多不明显、且无特异性,晚期易并发右心衰竭、肺癌(lung cancer,LC)等,预后多为不良,因此分析辨别IPF合并LC患者的临床发病特点对临床防治该病,改善患者预后具有重要意义[1]。在上述研究背景下,本研究回顾性分析了本院85例IPF患者的临床病理资料,来探讨IPF)合并LC的临床特点及CT征象,现报道如下。
1 资料与方法
1.1 一般资料选取2016年12月至2018年12月本院的IPF患者85例作为研究对象,将不合并LC的单纯IPF患者45例分为IPF组。
纳入标准:均符合《特发性IPF诊治进展》[2]中IPF的诊断标准。排除标准:合并除IPF外其他肺部疾病者;合并恶性肿瘤者;合并恶病质者;临床病理资料不全者。将合并LC的IPF患者40例分为IPF-LC组,纳入标准:均符合《特发性IPF诊治进展》[2]中IPF的诊断标准;均符合《LC诊断及治疗进展》[3]中LC的诊断标准。排除标准:合并除IPF、LC外其他肺部疾病者;合并除LC外其他恶性肿瘤者;临床病理资料不全者。本研究经本院医学伦理委员会会议表决通过。
1.2 方法收集所有患者的临床病理资料,进行回顾性分析。采用酶联免疫吸附实验试剂法检测患者外周血清癌胚抗原(carcino-embryonic antigen,CEA)、糖类抗原125(carbohydrate antigen 125,CA125)水平,用急诊血气分析仪(美国GEM,3500)检测患者血浆二氧化碳分压(partial pressure of carbon dioxide,PaCO2)、氧分压(oxygen partial pressure,PaO2)水平,相关试剂盒均购自武汉华联科生物科技有限公司,操作流程均严格参照相关试剂和仪器说明书。对IPF-LC组进行肺部CT检查:患者取仰卧位,采用CT扫描仪(德国西门子,Sensation)对患者胸廓入口至膈肌水平进行常规平扫,参数设置:螺旋因子0.8,管球电压120kV,管电流110mA~220mA,层厚4mm,旋转速率0.5s/圈。聘请2名具有10年以上临床工作经验的副主任医师对图像进行观察,作出分析。
1.3 观察指标(1)观察比较IPF组与IPF-LC组一般资料情况的差异,包括年龄、性别、饮酒史、糖尿病史、肺结核史、吸烟史、发热、呼吸困难、咳嗽、PaCO2、PaO2、CEA、CA125水平。分析IPF合并LC的相关影响因素,并进行Logistic多因素回归分析,观察其独立危险因素。(2)对两组进行为期1年的门诊、电话随访,每半个月1次,绘制两组1年内的生存曲线,记录比较两组1年内死亡率。(3)观察IPF-LC组肺部CT征象,分析其病灶好发部位。
1.4 统计学方法用SPSS 20.0软件进行统计分析,计量数据均以(±s)的方式表示,采用t检验。计数数据组间比较采用χ2检验。独立影响因素分析采用Logistic多因素回归分析法。以P<0.05视为差异具有统计学的意义。
2 结 果
2.1 两组一般资料比较IPF-LC组与IPF组在年龄、性别、饮酒史、糖尿病史、肺结核史、发热上均无明显差异(P>0.05);在吸烟史、呼吸困难、咳嗽、PaCO2、PaO2、CEA、CA125上差异明显(P<0.05),见表1。

表1 两组一般资料比较
2.2 IPF合并LC的Logistic多因素回归分析将IPF是否合并LC作为因变量,将单因素分析中差异具有统计学意义的因素(吸烟史、呼吸困难、咳嗽、PaCO2、PaO2、CEA、CA125)作为自变量,并进行赋值,IPF是否合并LC(否=0,是=1),吸烟史(无=0,有=1)、吸烟史(无=0,有=1)、咳嗽(无=0,有=1)、PaCO2(mmHg)(≤50=0,>50=1)[4]、PaO2(mmHg)(≥75=0,<75=1)[4]、CEA(ng/mL)(≤5.9=0,>5.9=1)[4]、CA125(U/mL)(≤35=0,>35=1)[4],将其纳入Logistic回归模型,结果显示,有吸烟史、呼吸困难、咳嗽、PaCO2>50mmHg、PaO2<75mmHg、CEA>5.9ng/mL、CA125>35U/mL是IPF合并LC独立危险因素(OR=2.280、2.307、1.042、1.570、1.413、2.038、1.659,P<0.05),见表2。
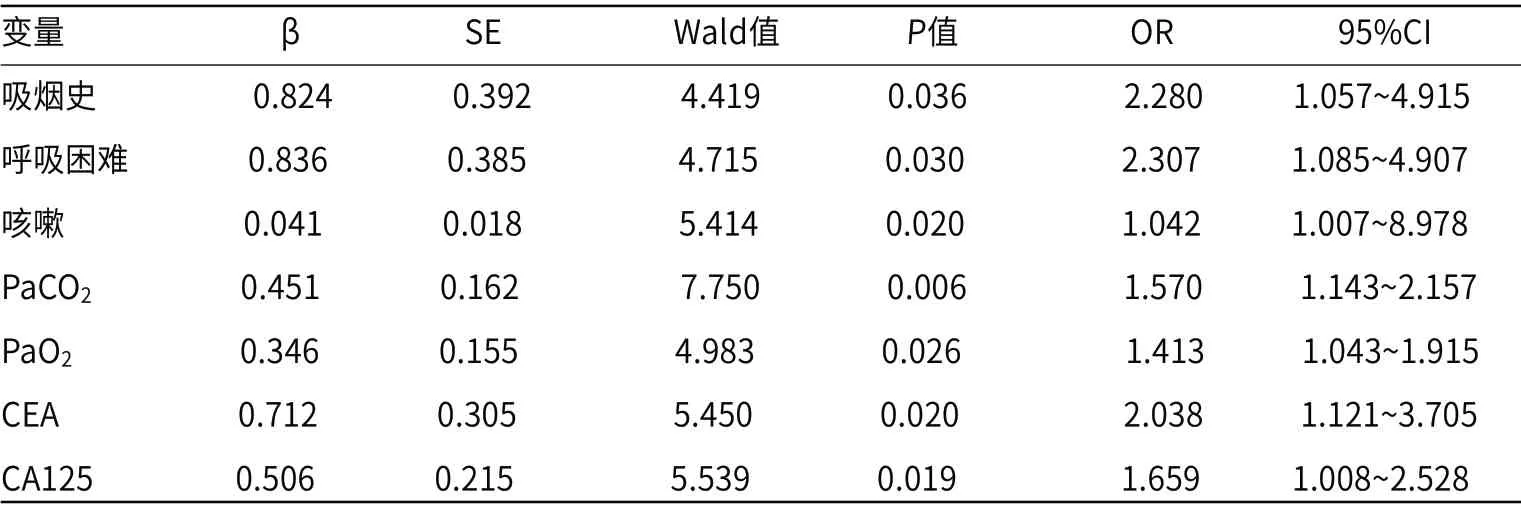
表2 急性脑卒中患者并发急性肾衰竭的Logistic多因素回归分析
2.3 两组1年内生存预后分析IPF-LC组1年内死亡率明显高于IPF组(P<0.05),见表3。生存曲线分析结果显示,IPF-LC组的1年内生存预后情况明显劣于IPF组,见图1。
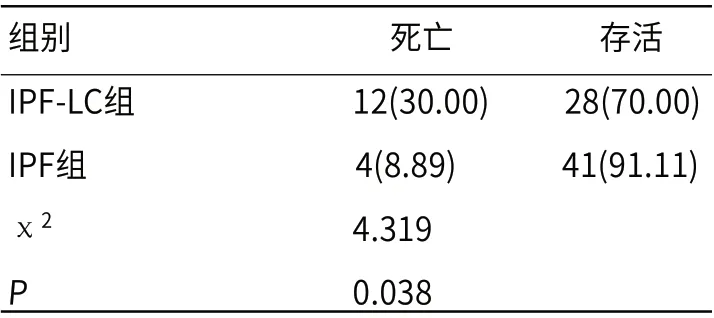
表3 两组1年内生存预后比较[n(%)]
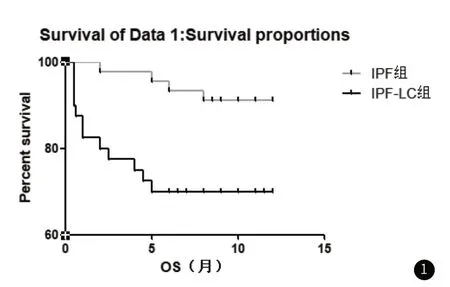
图1 两组1年内生存曲线
2.4 IPF-LC组CT征象分析CT征象分析结果显示,IPF-LC组的癌灶多位于肺间质纤维化区,主要分布于双肺上叶。见图2~图3。
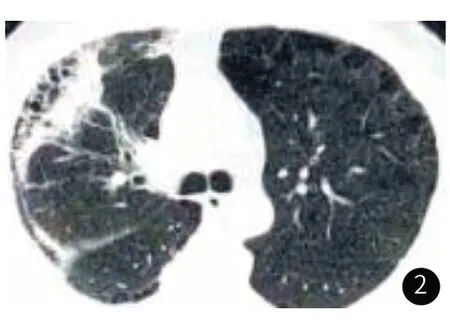
图2 癌灶位于右肺上叶。
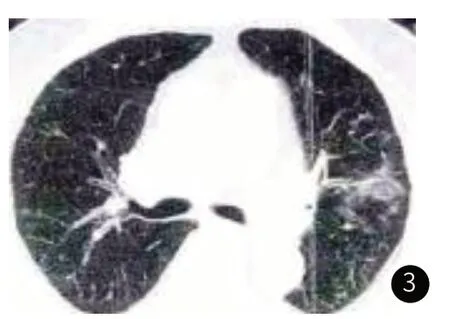
图3 癌灶位于左肺上叶
3 讨 论
IPF是以成纤维细胞大量增生与浸润为特征的肺纤维性炎症病变,其肺组织结构遭炎症破坏后经纤维性修复而形成瘢痕组织,可影响正常心肺功能,甚至可并发肺心病、肺动脉高压、恶性肿瘤等,严重威胁患者生命健康[5]。有研究表明,IPF人群中并发LC的概率要高于普通人群,其具体临床特点与病因机制尚且不明[6]。现为探讨IPF合并肺癌LC的临床特点及CT征象,特做此研究。
本研究Logistic多因素回归分析结果显示,有吸烟史、呼吸困难、咳嗽、PaCO2>50mmHg、PaO2<75mmHg、CEA>5.9ng/mL、CA125>35U/mL是IPF合并LC独立危险因素,提示有吸烟史、呼吸困难、咳嗽、PaCO2>50mmHg、PaO2<75mmHg、CEA>5.9ng/mL、CA125>35U/mL的IPF患者更易并发LC。究其原因,可能是烟草中含有大量一级致癌物,长期吸食可导致细胞基因突变,诱发恶性肿瘤。另外,呼吸困难、咳嗽可反应性增加IPF患者肺部的有害刺激,进一步加重IPF患者肺部炎症反应,长期可增加癌变倾向[7]。研究表明,IPF合并LC患者常因肺部存在占位性病变,进一步增加了患者肺部呼吸活动受限程度,从而加重呼吸困难常,易导致PaCO2水平过高及PaO2水平过低[8]。此外,CEA作为一种广谱肿瘤标记物,可反映机体多种恶性肿瘤的存在,特别是对于大肠癌、乳腺癌、肺癌的筛查诊断、疗效评定、病情发展、预后判断等具有重要应用价值,而CA125是原本针对卵巢癌的一种特异性肿瘤标记物,近年来被证明在肠癌、胰腺癌、肺癌、肝癌等多种恶性肿瘤患者体内其水平也呈显著升高状态[9]。赵虹等[10]的研究表明,IPF患者血清CEA、CA125呈正常水平,IPF合并LC患者血清CEA、CA125则明显高于正常水平,差异具有统计学意义(P<0.05),其研究发现与本研究结果相符合。
本研究结果显示,IPF-LC组1年内死亡率明显高于IPF组,生存曲线分析结果显示,IPF-LC组的1年内生存预后情况明显劣于IPF组,提示IPF合并LC会提高患者死亡率,降低其生存预后。这可能LC可加重IPF患者呼吸困难症状,加大肺心病、心衰等严重并发症的发病率有关,同时LC病灶本身的恶性增生与远处转移也可导致患者多器官功能障碍或衰竭,危及患者生命[11]。本研究CT征象分析结果显示,IPF-LC组的癌灶多位于肺间质纤维化区,主要分布于双肺上叶,探究其机制,可能是IPF患者肺纤维化区往往炎症反应剧烈、组织破坏严重,更易诱发肺泡上皮细胞非典型增生,增加癌变气倾向[12]。同时,肺纤维化区由于组织结构损害严重,气道阻力更大,使得气流在此处产生的摩擦刺激更甚,进一步促进肺部组织病变[13]。此外,Jung等[14]的研究表明,人体双上肺气体流通呈现“先进后出”的特点,因此肺泡处于充气、膨胀状态的时间要长于双下肺,可能导致有害气体滞留上叶时间过长,造成的不良影响更大,因此更易发生恶性病变[15]。
综上所述,有吸烟史、呼吸困难、咳嗽、PaCO2>50mmHg、PaO2<75mmHg、CEA>5.9ng/mL、CA125>35U/mL的IPF患者更易并发LC,且IPF合并LC患者生存预后变差,其癌灶多分布于双肺上叶、肺间质纤维化区。
