甲状腺未分化多形性肉瘤一例
2022-06-09巫恒平仲建全浩唐周洪园
巫恒平 仲建全 冯 浩唐 翎 周洪园
自贡市第一人民医院放射科(四川 自贡 643000)
1 一般资料
患者,男,62岁,发现颈部包块20+年入院。21年前因颈部包块曾行“甲状腺包块切除术”(具体不详)。术后患者无特殊不适。手术1年后患者颈部右侧再次出现包块并进行性长大,仍不伴特殊不适。1月前,患者出现呼吸不畅、活动后气促、进食梗阻感。主要体征:颈软,颈前见最大径约3cm陈旧性手术疤痕;右侧颈根部见大小约9cm×6cm×6cm巨大肿块,质硬、不活动。
影像检查:彩超示右侧甲状腺内大小约7.0cm×6.5cm×5.3cm不均质稍低回声,其内见强回声斑及少许不规则液性暗区,CDFI示其内可见血流信号。CT示右侧甲状腺区最大径约10.2cm巨大团块状混杂密度肿块,其内见坏死及多发斑点、斑片状钙化,增强扫描实性部分轻度不均匀强化,邻近气管及食管、颈部血管受压移位(图1~图3),肿块下份胸廓入口处气管后方见最大径约4.6cm肿块并部分坏死,未见明显强化,邻近气管及食管受压推移(图1~图2)。MRI增强扫描示右侧颈部大小约10.7cm×5.3cm×5.1cm混杂信号肿块,边界大部分可见,其内见斑片及斑条状STIR高信号及条状低信号,实质部分不均匀强化,邻近气管及食管受压、颈部血管受压并向左侧移位,右侧甲状腺显示不清(图4~图6);肿块下份胸廓入口处见最大径约5.0cm不规则团块状肿块,轻度不均匀强化,两者部分分界欠清。
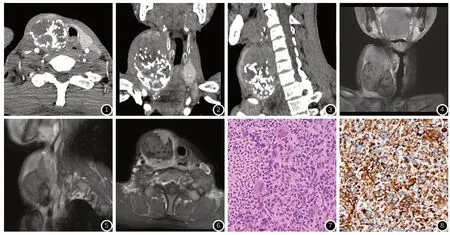
图1~图3 示右侧甲状腺区巨大团块状混杂密度肿块,其内见坏死及多发钙化,增强扫描实性部分轻度不均匀强化,肿块边界尚清;肿块下份胸廓入口处不规则团块状肿块,轻度不均匀强化。图4~图6 示颈部右份甲状腺区混杂信号肿块,边界大部分可见,其内见坏死及钙化,实质部分不均匀强化,邻近气管及食管、颈部血管受压并向左侧移位。图7 示主要由交织条束状或席纹状排列的多形性梭形细胞组成,还可见大圆形瘤细胞,或畸形瘤巨细胞,核分裂象易见,包括病理性核分裂HE x200。图8 示梭形细胞中阳性表达Vimentin SPx200。
手术及病理所见:颈部皮下疤痕形成;右侧颈部大小约10cm×7cm×6cm巨大肿物,肿物内为液化坏死组织,肿物与带状肌、气管、食管粘连严重,取出肿物后上纵隔内仍有质硬肿块,与周围粘连严重,肿瘤将食管向左侧推移且粘连严重,向后达椎体,向下无法探及,行局部活检。大体观察:甲状腺右叶包块,灰白不整形组织一个,大小约8cm×7cm×5cm,切面灰白,质脆,中央为囊性,内为坏死样物。镜下见主要由交织条束状或席纹状排列的多形性梭形细胞组成,还可见大圆形瘤细胞,或畸形瘤巨细胞,核分裂象易见(图7);免疫组化表型示肿瘤细胞呈Vimentin(+)(图8)、CD31(+,部分)、S100(+,部分)、CyclinD1(+)、Lys(+)、Bcl-2(+)、CD68(+)、CD99(+),Ki67(+,约50%),P-CK、p53、CD34、ERG、STAT6、SMA、Desmin、EMA、MelanA、TTF-1、PAX-8、ALK、CD30阴性表达。病理诊断:未分化多形性肉瘤(undifferentiated pleomorphicsarcoma,UPS)。
2 讨 论
UPS又称为恶性纤维组织细胞瘤,2013年WHO分类将其归类于未分化或未能分类肿瘤,这是一组未分化或利用现有技术不能明确分化方向的多形性、异质性间质肿瘤[1]。UPS是一个排他性诊断,依其光学显微镜下形态,分为多形性、梭形细胞、圆细胞及上皮样未分化肉瘤,虽然免疫组织化学检查可提示间叶来源,但缺少特征性标记,必须在排除其他相似的疾病后方可确诊[2]。Vim及CD68是诊断UPS的极为重要的标志物[3]。UPS病因不明,但可继发于放疗电离辐射(特别是头颈部)、畸形性骨炎、骨梗死、炎性肉芽肿及手术术区慢性修复过程中[1-4]。UPS影像表现无明显特异性,呈浸润性生长,约近半数的肿瘤累及深筋膜或骨骼肌实质,病灶密度及信号与组织成分有关,而与肿瘤大小无关,坏死、囊性变多见,可伴有钙化。
本病需与颈部结核、颈部恶性肿瘤转移性包块、恶性淋巴瘤等鉴别。颈部结核呈颈部串珠样肿物,病程长,肿物质韧,严重时有全身症状,病检可明确诊断。颈部恶性肿瘤转移性包块病程较长,多见于成年人,肿物质硬,不活动,多有原发肿瘤病史。恶性淋巴瘤全身多处淋巴结肿大,严重时有全身症状,病检可明确诊断。
UPS是一种常见的软组织肉瘤,可发生于全身各部位,多见于四肢及腹膜后,影像学表现缺乏特异性,误诊率较高,发生于甲状腺罕见报道。通过本病例讨论,可以提高对UPS影像学征象的认识,对甲状腺占位病变,进行排他性诊断后应考虑本病可能。
