针药结合对脑梗死大鼠氧化应激、炎症反应及血管生成的影响
2022-06-09赵辉杨晓静程芳沈菲张静高宏波袁玉欣
赵辉,杨晓静,程芳,沈菲,张静,高宏波,袁玉欣
(河北省退役军人总医院康复医学科,河北邢台 054000)
脑梗死(cerebral infarction)是指因脑部血液循环障碍,缺血、缺氧所致局限性脑组织缺血性坏死或软化,而出现相应的神经系统功能缺损,以猝然昏仆、口舌歪斜、半身不遂、语言不利为主症的疾病[1]。脑梗死是严重危害中老年人健康的常见病,具有发病率高、致残率高、病死率高、复发率高及并发症多等“四高一多”的特点,且发病有明显年轻化趋势[2]。对脑梗死的防治具有重要意义,处理上应强调早期诊断、早期治疗、早期康复和早期预防再发[1]。临床常将针药结合的方法运用到脑梗死的治疗中。本课题组采用电针联合大黄、水牛角水煎液治疗脑梗死,取得较好的疗效,但其作用机制尚不明确。因此,本研究建立脑梗死大鼠模型,观察电针联合大黄、水牛角水煎液对脑梗死大鼠的治疗机制,现将研究结果报道如下。
1 材料与方法
1.1 实验动物40只SPF级健康成年雌雄参半的SD大鼠,体质量250~300 g,购自广东省医学实验动物中心,动物使用许可证号:SYXK(粤)2019-0006。饲养温度22℃,湿度保持在50%~65%,自由饮水及摄食。适应周围环境7 d后,按《实验动物管理条例》规定进行实验,动物实验于河北省退役军人总医院附属动物实验中心进行。
1.2 药物生大黄、水牛角中药材由武汉市武昌区药材公司提供。生大黄、水牛角按10∶2比例组成,常规方法煎煮。
1.3 主要试剂与仪器苏木素-伊红(HE)染色试剂盒购自南京生航生物技术有限公司;末端脱氧核苷酸转移酶介导的d UTP缺口末端标记(TUNEL)细胞凋亡检测试剂盒、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒,肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β酶联免疫吸附法(ELISA)试剂盒均购自北京百奥莱博科技有限公司;二喹啉甲酸(BCA)蛋白浓度测定试剂盒购自南京诺唯赞有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒购自凯基有限公司;聚合酶链反应(PCR)引物由上海复生生物工程研究所合成;血管内皮细胞生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)抗体购自美国Santa Cruz公司。G6805-2电针治疗仪购自上海涵飞医疗器械有限公司;蛋白电泳仪购自南大普阳科学仪器研究所;CG-05荧光定量PCR仪器购自力新仪器(上海)有限公司;SDS-800凝胶成像系统购自美国UVP公司;电泳槽购自美国Pharmacia公司;高速冷冻离心机购自北京金恒祥有限公司。
1.4 分组与造模将40只大鼠随机分为5组,即假手术组、模型组、电针组、中药组、针药组,每组8只。除假手术组外,其余各组大鼠参考文献方法[3-4]建立脑梗死模型。操作方法如下:采用1%戊巴比妥钠麻醉后,在大鼠头部正中偏右侧做一切口,分离颈部总动脉、颈内动脉及颈外动脉,在颈外动脉远心端进行结扎,采用动脉夹阻断动脉血流,插入栓线,放开夹子,推动栓线至阻力,栓线插至16~18 mm,2 h后拔出栓线。假手术组分离颈动脉不结扎,缝合切口。造模后给予抗感染护理,自由饮水摄食。造模成功标准按照Zea-Longa[5]原则判定,1~3分为造模成功。
1.5 干预方法大鼠用药量按人与大鼠体表面积比值换算法求得。从建模后第1天开始,中药组大鼠给予大黄、水牛角水煎液5 g/kg灌胃,每日1次,7 d为1疗程,共2个疗程;电针组采用电针治疗,用华佗牌28号1.5寸(3.3 cm)毫针针刺百会、足三里及水沟穴,将针柄用导线分别连接到定量针麻仪的电极上,增加频率为5~15 Hz的疎密波,强度从1 V开始,最大强度为3 V,针刺5 min后增加1个强度,留针15 min,每日1次,每日电针时间相同,7 d为1个疗程,共2个疗程。针药组为中药组、电针组上述干预方法联合使用;假手术组与模型组大鼠均灌胃等体积的生理盐水,每日1次,7 d为1个疗程,共2个疗程。
1.6 观察指标与方法
1.6.1 神经功能缺损评分 干预第1、7、14天时,分别采用Zea-Longa 5分法[5]评价大鼠神经功能。无神经功能损伤,计0分;对侧前肢不能完全伸展,计1分;行走时表现对侧肢体旋转,计2分;走时倾倒,计3分;意识丧失,计4分。
1.6.2 检测氧化应激、炎症指标的血清水平 末次治疗结束后,麻醉大鼠,采集眼眶静脉血1.5 mL,离心收集上清液,采用硫代巴比妥酸(TBA)法检测MDA水平,采用黄嘌呤氧化酶法检测SOD水平,采用比色法检测GSH-Px水平,ELISA法检测TNF-α、IL-1β水平。
1.6.3 TUNEL法检测大鼠神经细胞凋亡情况 颈部脱臼处死大鼠,取脑组织,制备切片。具体操作方法按试剂盒说明书进行。光学显微镜下观察凋亡神经细胞。凋亡神经细胞核呈棕黄色。随机选择5个视野下的细胞,计算细胞凋亡率,细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.6.4 蛋白免疫印迹法检测大鼠脑组织VEGF、bFGF蛋白表达水平 取脑组织,提取蛋白,用BCA蛋白定量试剂盒进行蛋白定量;加入5×SDS上样缓冲液,使蛋白变性;加样,进行SDS-PAGE凝胶垂直电泳,再将蛋白电转移至聚偏氟乙烯(PVDF)膜;加入50 g/L脱脂奶粉,室温封闭1 h;分别加入一抗稀释液VEGF(1∶500)、bFGF(1∶500)、内参β-actin(1∶2 000),室温孵1 h后,4℃孵育过夜;洗膜,加入羊抗兔免疫球蛋白G(IgG)二抗稀释液(1∶5 000),室温孵育1 h;洗膜,用电化学发光试剂(ECL)显影。应用凝胶成像系统进行图像采集和分析,结果以目的蛋白条带与β-actin蛋白条带灰度比值作为目的蛋白的相对表达水平。
1.6.5 实时定量聚合酶链反应(qRT-PCR)检测大鼠脑组织VEGF、bFGF mRNA表达水平 取脑组织30 g,提取总RNA,应用核酸定量仪检测提取RNA的浓度和纯度。按照第一链合成系统说明书进行逆转录制备cDNA,以β-actin为内参进行荧光定量PCR扩增。50℃预处理2 min,循环1次;95℃预变性10 min,循环1次;95℃变性15 s,50℃退火30 s,70℃延伸30 s,循环30次。各组均设3个复孔。PCR产物用2%琼脂糖凝胶电泳,紫外灯下观察并照相。应用凝胶图像分析系统分析,PCR产物量以光密度×面积表示,根据2-△△Ct值计算目的基因的相对表达水平。引物序列见表1。

表1 PCR引物序列Table 1 PCR primer sequences
1.7 统计方法采用SPSS 23.00统计软件进行数据分析。实验数据以均数±标准差(±s)表示,多组比较采用单因素方差分析,进一步两两比较采用LSD-t检验分析。以P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠神经功能缺损评分比较干预第1、7、14天:与假手术组比较,模型组神经功能缺损评分升高,差异有统计学意义(P<0.05);与模型组比较,电针组、中药组、针药组大鼠神经功能缺损评分降低(均P<0.05),其中,中药组与电针组比较,差异无统计学意义(P>0.05),而针药组神经功能缺损评分明显低于电针组和中药组(P<0.05)。干预第14天,各治疗组神经功能缺损评分明显低于干预第1天。具体结果见表2。
2.2 各组大鼠氧化应激指标及炎症指标血清水平比较与假手术组比较,模型组大鼠血清中MDA、TNF-α及IL-1β水平升高,SOD、GSH-Px水平降低(均P<0.05);与模型组比较,电针组、中药组、针药组大鼠血清中MDA、TNF-α及IL-1β水平降低,SOD、GSH-Px水平升高(均P<0.05),其中,针药组降低MDA、TNF-α、IL-1β作用及升高SOD、GSH-Px的作用,明显优于电针组、中药组(均P<0.05)。具体结果见表3。
表2 各组大鼠神经功能缺损评分比较Table 2 Comparison of neurologicaldeficit scores between various groups of rats(±s,分)
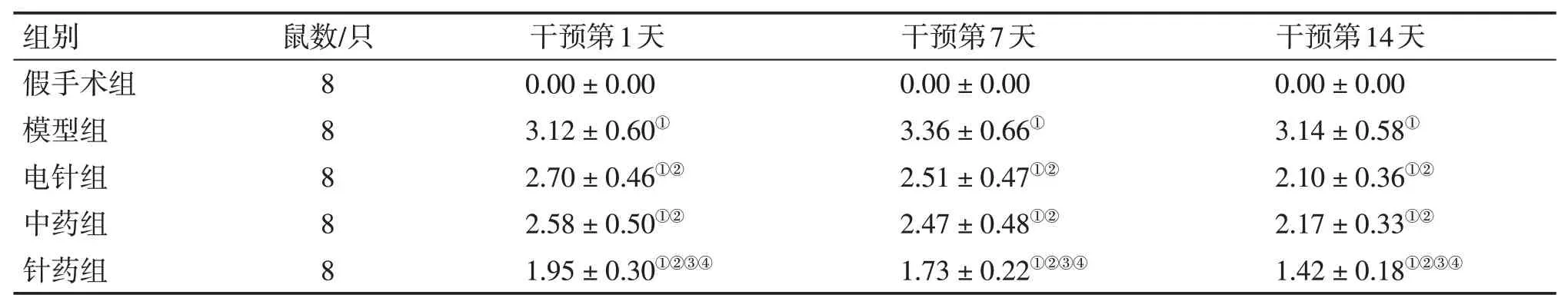
表2 各组大鼠神经功能缺损评分比较Table 2 Comparison of neurologicaldeficit scores between various groups of rats(±s,分)
①P<0.05,与假手术组比较;②P<0.05,与模型组比较;③P<0.05,与电针组比较;④P<0.05,与中药组比较
组别假手术组模型组电针组中药组针药组鼠数/只8 8 8 8 8干预第1天0.00±0.00 3.12±0.60①2.70±0.46①②2.58±0.50①②1.95±0.30①②③④干预第7天0.00±0.00 3.36±0.66①2.51±0.47①②2.47±0.48①②1.73±0.22①②③④干预第14天0.00±0.00 3.14±0.58①2.10±0.36①②2.17±0.33①②1.42±0.18①②③④
2.3 各组大鼠脑组织神经细胞凋亡情况比较假手术组、模型组、电针组、中药组、针药组脑组织神经细胞凋亡率分别为(2.15±0.20)%、(41.10±3.65)%、(19.30±2.17)%、(20.25±2.03)%、(12.05±1.33)%,组间比较,差异有统计学意义(P<0.001)。进一步比较:与假手术组比较,模型组神经细胞凋亡率显著升高(P<0.001);与模型组比较,电针组、中药组、针药组神经细胞凋亡率降低(P<0.001),其中,电针组与中药组神经细胞凋亡率比较,差异无统计学意义(P=0.421),而针药组神经细胞凋亡率低于电针组与中药组(P<0.001)。各组神经细胞凋亡情况如图1所示。
2.4 各组大鼠脑组织中VEGF、bFGF蛋白表达比较模型组大鼠脑组织中VEGF、bFGF蛋白表达水平低于假手术组(P<0.05),电针组、中药组与针药组VEGF、bFGF蛋白表达水平高于模型组(P<0.05),而针药组大鼠脑组织中VEGF、bFGF蛋白表达水平明显高于电针组与中药组(P<0.05)。具体结果见表4、图2。
2.5 各组大鼠脑组织中VEGF、bFGF mRNA表达比较模型组大鼠脑组织中VEGF、bFGF mRNA相对表达水平低于假手术组(P<0.05),电针组、中药组与针药组大鼠脑组织VEGF、bFGF mRNA相对表达水平高于模型组(P<0.05),而针药组大鼠脑组织VEGF、bFGF mRNA相对表达水平明显高于电针组与中药组(P<0.05)。具体结果见表5。
表3 各组大鼠氧化应激指标及炎症指标血清水平比较Table 3 Comparison of serum levels of oxidative stress indexes and inflammatory markers between various groups of rats(±s)

表3 各组大鼠氧化应激指标及炎症指标血清水平比较Table 3 Comparison of serum levels of oxidative stress indexes and inflammatory markers between various groups of rats(±s)
①P<0.05,与假手术组比较;②P<0.05,与模型组比较;③P<0.05,与电针组比较;④P<0.05,与中药组比较
组别假手术组模型组电针组中药组针药组鼠数/只8 8 8 8 8 MDA/(nmol·mL-1)11.56±3.25 26.03±4.57①16.33±4.18①②16.17±4.38①②12.08±3.22①②③④SOD/(U·mL-1)308.50±29.66 231.05±30.54①278.53±41.22①②280.05±40.56①②295.36±36.5 3①②③④GSH-Px/(μmol·mL-1)105.20±15.47 71.22±11.45①85.36±12.41①②86.12±12.31①②96.24±15.05①②③④TNF-α/(ng·mL-1)1.45±0.20 2.61±0.30①1.78±0.19①②1.80±0.20①②1.60±0.17①②③④IL-1β/(ng·mL-1)0.11±0.02 0.30±0.04①0.21±0.03①②0.20±0.02①②0.14±0.03①②③④

图1 各组大鼠脑组织神经细胞凋亡情况比较(TUNEL法,×200)Figure 1 Comparison of apoptosis of neuralcells in brain tissues between various groups of rats(by TUNEL method,×200)
表4 各组大鼠脑组织中VEGF、bFGF蛋白表达比较Table 4 Comparison of protein expression of VEGF and bFGF in brain tissues between various groups of rats(±s)
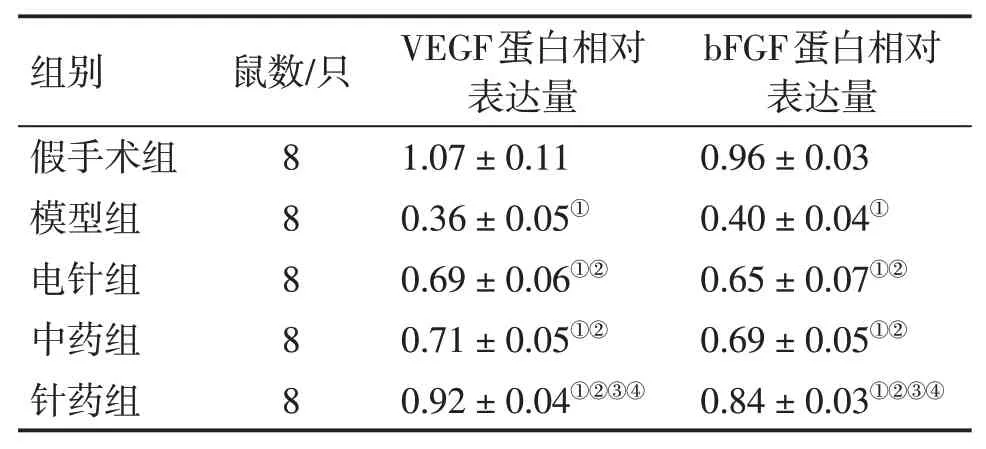
表4 各组大鼠脑组织中VEGF、bFGF蛋白表达比较Table 4 Comparison of protein expression of VEGF and bFGF in brain tissues between various groups of rats(±s)
①P<0.05,与假手术组比较;②P<0.05,与模型组比较;③P<0.05,与电针组比较;④P<0.05,与中药组比较
组别假手术组模型组电针组中药组针药组鼠数/只8 8 8 8 8 VEGF蛋白相对表达量1.07±0.11 0.36±0.05①0.69±0.06①②0.71±0.05①②0.92±0.04①②③④bFGF蛋白相对表达量0.96±0.03 0.40±0.04①0.65±0.07①②0.69±0.05①②0.84±0.03①②③④
3 讨论

图2 各组大鼠脑组织中VEGF、bFGF蛋白电泳条带图Figure 2 Electrophoretic stripes of VEGF and bFGF proteins in brain tissues in various groups of rats
表5各组大鼠脑组织中VEGF、bFGF mRNA表达比较Table 5 Comparison of mRNA expression of VEGF and bFGF in brain tissues in various groups of rats(±s)
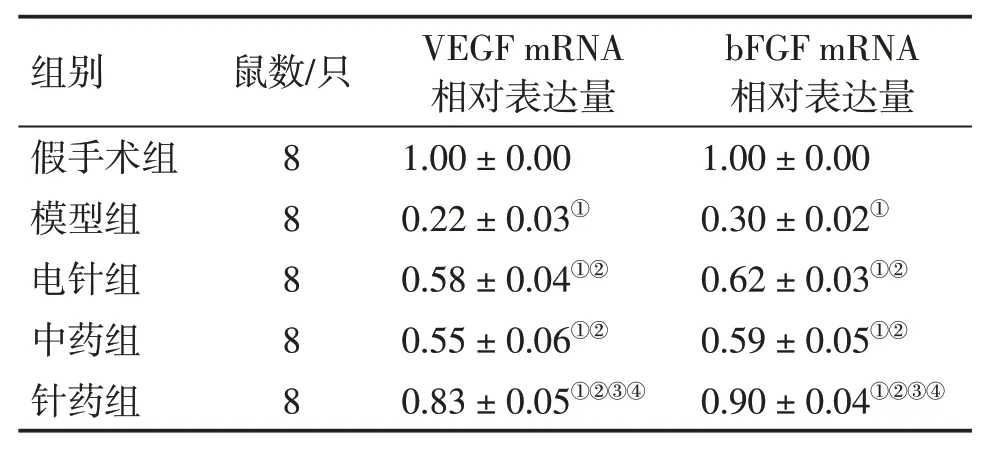
表5各组大鼠脑组织中VEGF、bFGF mRNA表达比较Table 5 Comparison of mRNA expression of VEGF and bFGF in brain tissues in various groups of rats(±s)
①P<0.05,与假手术组比较;②P<0.05,与模型组比较;③P<0.05,与电针组比较;④P<0.05,与中药组比较
组别假手术组模型组电针组中药组针药组鼠数/只8 8 8 8 8 VEGF mRNA相对表达量1.00±0.00 0.22±0.03①0.58±0.04①②0.55±0.06①②0.83±0.05①②③④bFGF mRNA相对表达量1.00±0.00 0.30±0.02①0.62±0.03①②0.59±0.05①②0.90±0.04①②③④
脑梗死可归属于中医学“中风病”的范畴,中医病机为“窍闭神匿,神不导气”[6],治疗应遵循“病变在脑,首取督脉”原则,故本研究针刺选择百会穴、水沟穴。百会穴,属督脉,可开窍醒脑、回阳固脱。水沟穴,属督脉,清热开窍、回阳救逆。针刺百会穴、水沟穴,可改善脑梗死患者认知和运动功能障碍[7-10]。中风的发生与气血亏虚、脏腑功能失调有关。故本研究针刺选择足三里穴。足三里穴,属足阳明胃经,可燥化脾湿,生发胃气。针刺足三里可以改善局部气血,促进肢体功能恢复[11]。中风病之病位在脑络,以通里攻下、化痰通腑为代表的“上病下治”法具有治疗中风病的普适性[12-13]。故本研究选择通腑泻热、凉血解毒中药大黄、水牛角进行治疗。大黄,性寒味苦,归大肠及肝经,具有清热、通络、解毒、化瘀之功效。水牛角,性寒味咸,入肝、心经,有凉血定惊、清热解毒之功。临床上应用大黄、水牛角治疗脑梗死急性期属于痰热腑实证患者取得良好效果[14-16]。本研究应用电针联合大黄、水牛角煎液治疗脑梗死大鼠,结果显示,其可明显保护脑梗死大鼠神经功能。
既往研究证实,脑梗死往往伴随着缺血再灌注损伤,脑组织恢复血液后脑组织损伤没有缓解反而会加重,并引起一系列炎症反应产生自由基导致脑细胞继发性损伤,加大梗死体积。脑梗死后再灌注损伤能够引起脑组织氧化应激反应促进大量炎症介质释放,加重神经细胞凋亡及神经功能损伤。有研究[17]表明,急性脑梗死患者血清TNF-α和IL-1β含量显著高于对照组,增高的程度与神经功能缺损程度及梗死灶大小密切相关。本研究结果显示:与假手术组比较,模型组大鼠血清MDA、TNF-α及IL-1β水平升高,SOD、GSH-Px水平降低,神经细胞凋亡率升高(均P<0.05);与模型组比较,电针组、中药组、针药组大鼠血清MDA、TNF-α及IL-1β水平降低,SOD、GSH-Px水平升高,神经细胞凋亡率降低(均P<0.05),而针药组的作用效果明显优于电针组、中药组。表明电针联合大黄、水牛角煎液对脑梗死大鼠具有保护神经功能的作用,能够降低氧化应激与炎症反应,改善脑组织损伤。氧化应激与炎症反应类似于中医学“毒”的特性,本研究结果体现了电针联合大黄、水牛角煎液“解毒”的基本治法。
血管内皮细胞生长因子(VEGF)属于血小板衍生生长因子(PDGF)家族成员之一,属于分泌性多肽物质,在正常机体内能够促进胚胎发育及血管再生。当发生脑梗死时,VEGF及受体表达降低,可引起脑组织梗死面积加大、神经细胞死亡加重。有研究报道,VEGF能够加快脑局部血液循环,发挥促进神经组织再生及神经增殖的作用[18-19]。本研究针刺碱性成纤维细胞生长因子(bFGF)为神经营养因子,也是一种多效能生长因子,可对抗细胞内钙超载、抑制细胞凋亡、清除自由基、拮抗兴奋性氨基酸毒性及抗氧化等多种生物学活性,促进细胞增殖分化、组织增生和血管形成,并参与炎症反应和创伤愈合[20]。临床研究[21]表明,脑梗死患者血清bFGF水平明显增高,且与梗死灶大小关系密切,恢复期时血清bFGF水平较急性期明显下降。还有研究[22]表明,急性脑梗死患者血清VEGF和bFGF浓度的变化与病程、梗死面积大小及脑神经功能恢复情况均具有一定的相关性。提示VEGF和bFGF浓度与脑梗死后新血管形成关系密切,二者可作为判断梗死面积与预后的新外周指标。本研究结果显示:模型组大鼠脑组织中VEGF、bFGF mRNA与蛋白表达水平低于假手术组(P<0.05),中药组、电针组与针药组VEGF、bFGF的mRNA与蛋白表达水平高于模型组(均P<0.05),而针药组大鼠脑组织中VEGF、bFGF的mRNA与蛋白表达水平高于中药组与电针组(P<0.05)。表明电针联合大黄、水牛角煎液可改善脑梗死大鼠新血管形成,含“活血化瘀”之效,且疗效优于单用黄角汤或单用电针。
综上所述,电针联合大黄、水牛角煎液能够显著改善大鼠脑梗死病变,其可通过降低氧化应激、抑制炎症反应、改善微循环发挥保护神经功能的作用。本研究存在一定的局限性,今后可加强与其他单位合作,深入开展相关机制研究,为脑梗死临床治疗提供实验基础。
