基于网络药理学和分子对接技术探讨优化新生脉散方抗慢性心力衰竭心肌纤维化的作用机制*
2022-06-09张泽宇王贤良王帅贾壮壮闫海峰毛静远
张泽宇,王贤良,王帅,贾壮壮,闫海峰,毛静远
1.天津中医药大学第一附属医院,天津 300381; 2.国家中医针灸临床医学研究中心,天津 300381
慢性心力衰竭(chronic heart failure,CHF)是由多种有害因素长期刺激引起的心室结构代偿性改变,功能上可表现为心肌收缩和/或舒张受限、射血分数降低、心室压升高等,造成体循环或肺循环瘀血[1]。CHF的根本原因是心室重构,其重要机制之一是心肌纤维化(myocardial fibrosis,MF)[2-3]。根据该病疲乏、呼吸窘迫、水肿、血瘀等临床表现,中医将其病机归纳为本虚标实,以心脏气血阴阳虚衰与瘀血痰湿等病理产物相互作用为主[4]。优化新生脉散方是毛静远教授在多年临床研究基础上提出的治疗CHF的经验方,由黄芪、党参、刺五加、丹参、醋鳖甲、茯苓、葶苈子、麦冬、枳壳等药物组成,君药黄芪补益元气以固本,补而不滞,兼有行湿之功;臣药党参、刺五加、丹参益气以通脉;佐药醋鳖甲、茯苓活血利水,葶苈子辛散苦泻,性寒下降,开泻肺气以利治节;枳壳协助诸药以行气,麦冬养血复脉以防伤阴,各药共用共奏益气活血利水之功。前期临床及实验研究证实,优化新生脉散方具有良好的抗炎、抗氧化、抗凋亡、抗MF等作用,可显著改善MF患者的生存质量、心肌功能等[5-7]。
网络药理学从微观到宏观多维度、多方面解析药物调控疾病的机制,可以更准确地预测和分析中药复方的作用机理,已成为药物研究的新模式。分子对接能够演算得出受体与配体之间的亲和力数值以及一些结合形式,并通过这些条件将结果进行评估和筛选。本研究采用网络药理学和分子对接方法对优化新生脉散方治疗CHF的作用机制及物质基础进行探索,旨在为后续实验和临床研究提供线索与思路。
1 资料与方法
1.1 中药有效成分的获取基于中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP,http://tcmspw.com/tcmsp.php)和本草组鉴(HERB,http://herb.ac.cn/)数据库筛选优化新生脉散方9味中药的化学成分。以口服生物利用度(oral bioavailability,OB)≥35%、类药性(druglikeness,DL)≥0.2为条件对其化学成分进行初筛后,再通过SwissADME(http://www.swissadme.ch/)平台以肠道吸收度(GI absorption)为Yes、DL为2个Yes及以上为条件进行复筛,最终得到优化新生脉散方的有效成分。
1.2 有效成分靶蛋白的获取基于Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)获取有效成分的SMILES结构式,并导入SEA数据库(https://sea.bkslab.org/)预测有效成分的靶蛋白,最后通过UniProt数据库(https://www.uniprot.org/)对靶蛋白名称进行标准化处理。
1.3 “成分-疾病”交集靶点的获取通过GeneCards数据库(http://www.genecards.org/)以Relevance score≥5为条件,chronic heart failure和myocardial fibrosis为关键词,获取CHF和MF的相关蛋白。将CHF靶蛋白、MF靶蛋白和优化新生脉散方有效成分相关靶蛋白取交集,获得交集蛋白,即为优化新生脉散方治疗CHF心肌纤维化的靶点蛋白,保存文件为“Drug-Disease”。
1.4 富集分析将“Drug-Disease”通过Rx64 4.0.2软件进行基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,并以P<0.05为条件进行筛选分析。GO功能富集分析可分为生物过程、分子功能和细胞组分,各取排名前10的功能绘制条形图;将KEGG通路富集分析获取的前30条通路绘制气泡图(纵坐标为通路名称,横坐标为基因占比,圆圈大小代表富集基因数目的多少,颜色为富集程度,红色越深代表富集显著性越强)。通过查阅文献筛选疾病相关通路并于KEGG富集结果中获取富集蛋白,利用STRING数据库(https://string-db.org/)和Cytoscape-v3.8.2软件筛选富集核心蛋白并对“通路-靶点”进行拓扑分析。
1.5 构建“成分-靶点”拓扑分析网络将优化新生脉散方活性成分和通路富集蛋白导入Cytoscape-v3.8.2软件进行可视化处理,构建“成分-靶点”网络。其中,节点表示化合物和靶点,边代表节点之间相互作用关系。
1.6 分子对接验证及筛选以富集核心蛋白为受体、对应中药成分为配体,进行分子对接。将成分2D结构通过Chem3D.exe软件进行3D转化和结构优化,保存为lig.mol2;通过PDB数据库(http://www.rcsb.org/)获取靶蛋白的晶体结构并通过PyMOLWin.exe软件对其进行去除H2O和小分子配体处理,保存为rep.pdb;将rep.pdb和lig.mol2导入AutoDockTools 1.5.6转化为PDBQT格式,并确定活性位点;利用AutoDock Vina进行分子对接,选取与靶蛋白对接结合能最低的成分,利用PyMOLWin.exe将对接结果进行可视化。
2 结果
2.1 优化新生脉散方的有效成分及其相关靶蛋白通过TCMSP和本草组鉴数据库共获得优化新生脉散方有效成分83种,其中黄芪11种、党参4种、刺五加11种、丹参29种、鳖甲5种、茯苓1种、葶苈子5种、麦冬18种、枳壳4种,蛋白预测并标化处理后得到有效成分靶蛋白769种。根据OB值列出排名前20的化合物。见表1。
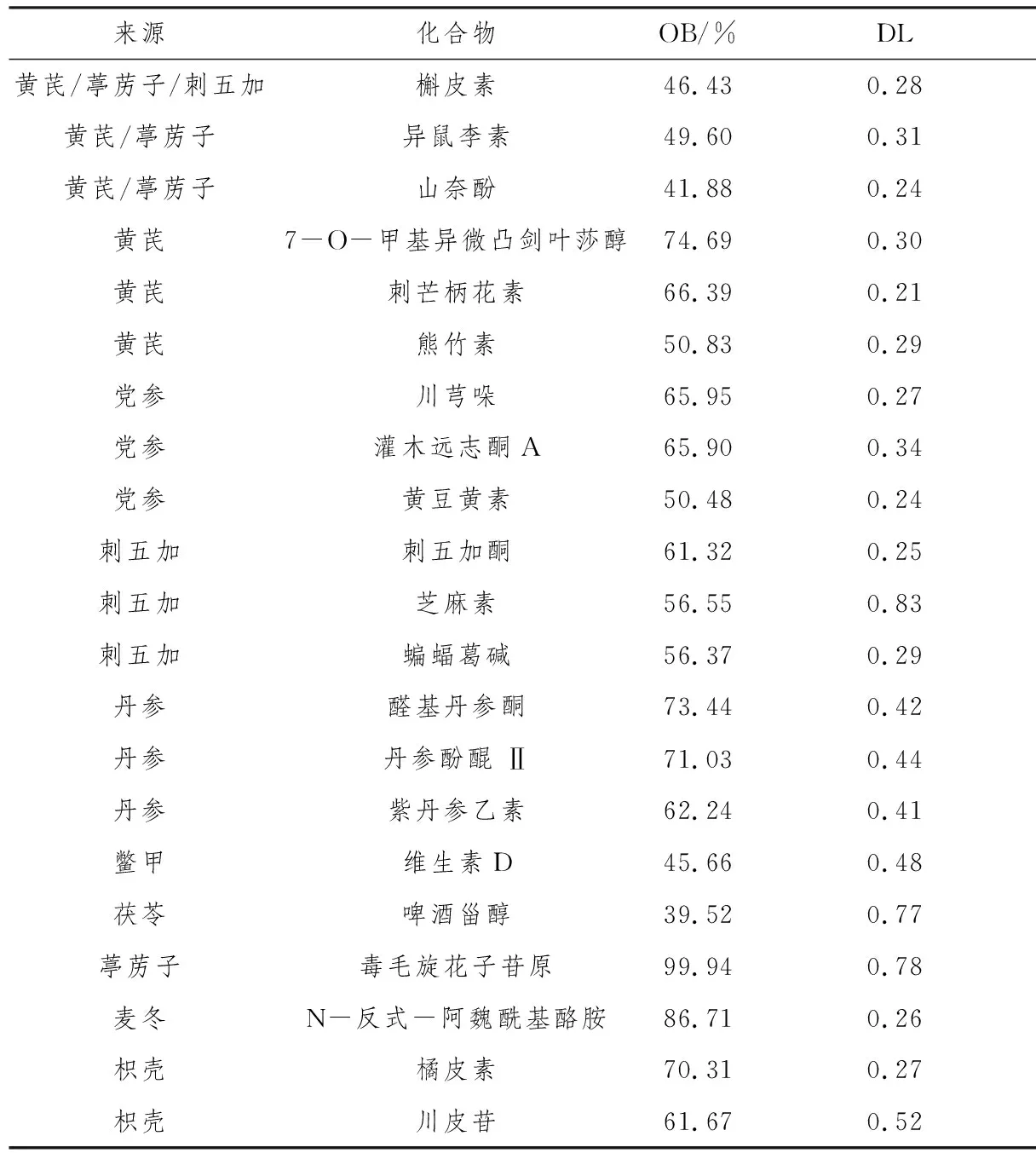
表1 优化新生脉散方OB值排名前20位的化合物
2.2 “成分-疾病”交集靶点通过GeneCards数据库以Relevance score≥5为条件,获得CHF相关蛋白5 913种,MF相关蛋白725种,将CHF靶蛋白、MF靶蛋白及优化新生脉散方有效成分的相关蛋白取交集后得到119个交集靶点。见图1。
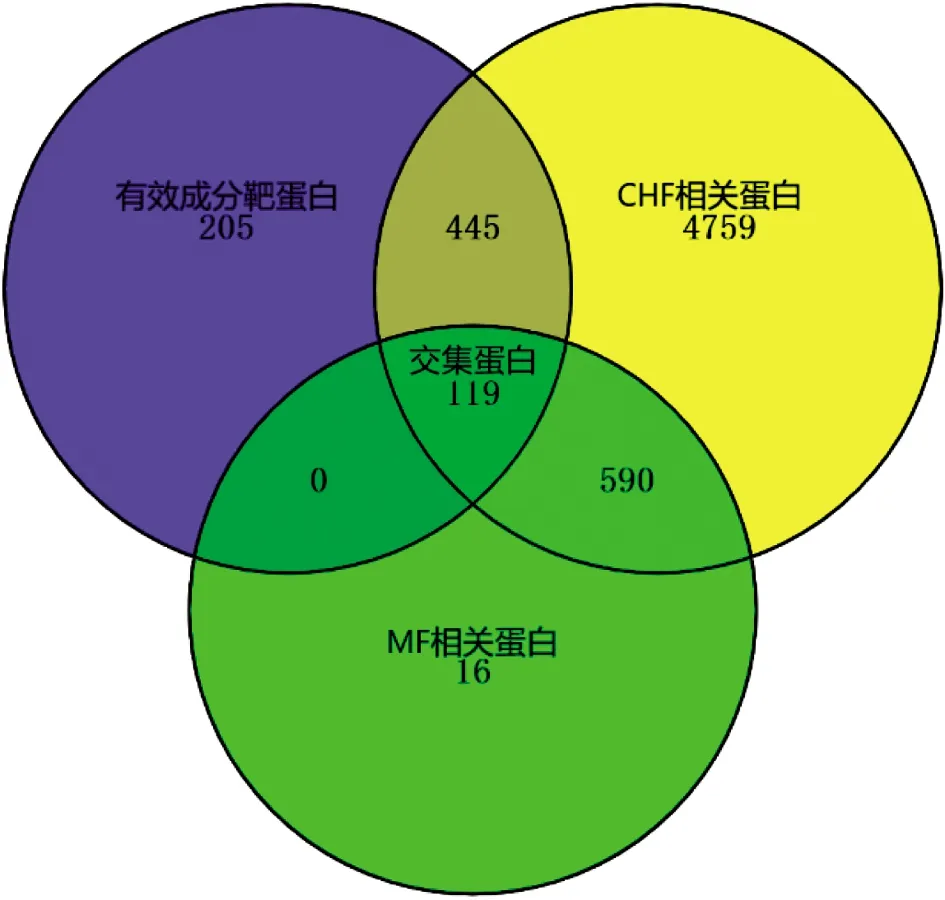
图1 成分-疾病靶蛋白Venn图
2.3 GO和KEGG富集分析GO功能富集分析共获得2 388个功能条目,其中生物过程有2 178条,主要包括药物反应、缺氧反应、钙离子稳态等;细胞组分有52条,主要与膜区、质膜外侧、细胞外基质、胶原含量等有关;分子功能有158条,主要涉及生长因子(growth factor,GF)结合、G蛋白偶联受体(G protein-coupled receptors,GPCRs)结合、GPCRs活性、受体酪氨酸激酶(receptor tyrosine kinase,RTK)活性、丝氨酸/苏氨酸激酶活性等。KEGG通路富集分析共获得154条信号通路,其中磷酸肌醇3激酶(phosphoinositide 3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)通路[8]、丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)通路[9]、Ras相关蛋白1b(Ras-related protein 1b,Rap1)通路[10]、环磷酸腺苷(cyclic adenosine monophosphate,cAMP)通路[11]、表皮生长因子受体(epidermal growth factor receptor,EGFR)通路[12]等与CHF过程中MF的发生关系最为密切。“通路-靶点”拓扑分析网络中红色八边形为上述通路,紫色圆形为一般富集蛋白,黄色圆形为核心富集蛋白,由此可知,组蛋白乙酰转移酶p300(histone acetyltransferase p300,EP300)、MAPK1、EGFR、RAF原癌基因丝氨酸/苏氨酸蛋白激酶(RAF proto-oncogene serine/threonine-protein kinase,RAF1)、转录因子AP-1(transcription factor AP-1,JUN)等蛋白可能对上述通路起到关键调节作用。见图2-图4,表2。
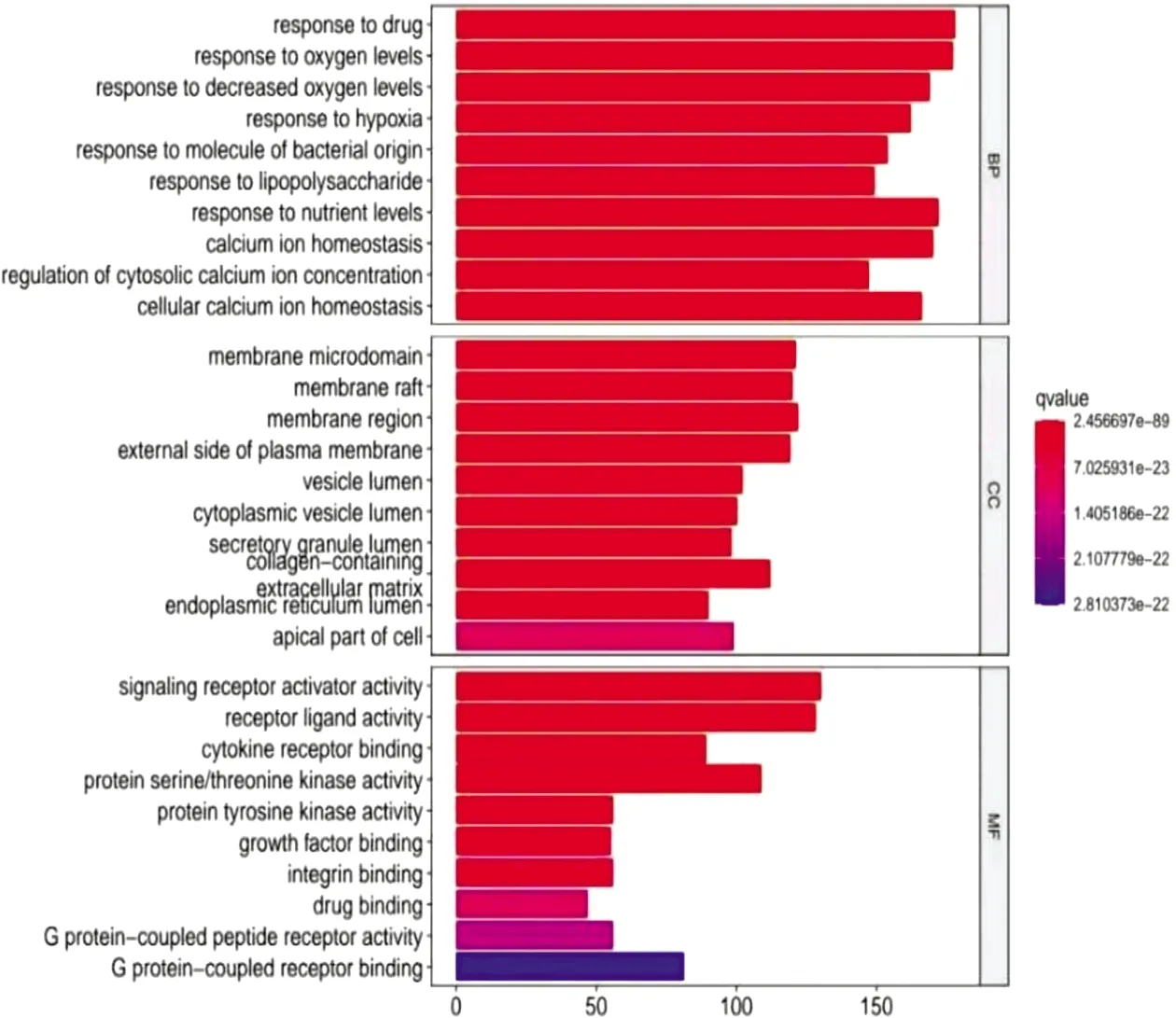
图2 交集靶点的GO富集分析
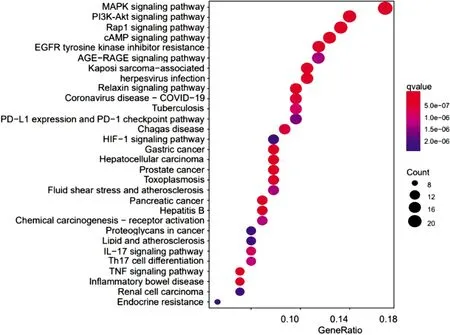
图3 交集靶点的KEGG富集分析

表2 核心富集蛋白
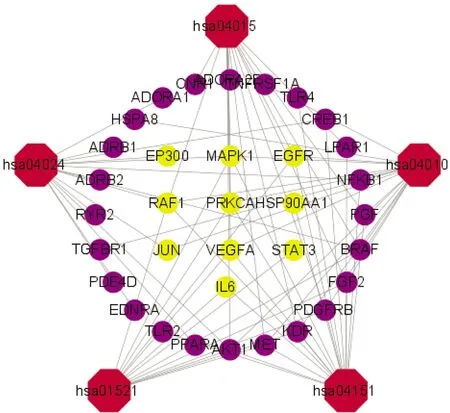
图4 通路-靶点拓扑分析网络图
2.4 “成分-靶点”网络的构建“成分-靶点”拓扑分析网络共含75个节点和123条边。图5中左侧环形代表药物有效成分,咖啡色为黄芪成分、橙色为党参成分、紫色为刺五加成分、绿色为丹参成分、红色为鳖甲成分、灰色为茯苓成分、淡黄色为葶苈子成分、粉色为麦冬成分、青色为枳壳成分,多种颜色的节点代表药物共有成分;右侧环形代表通路富集蛋白,蓝色为一般富集蛋白,黄色为核心富集蛋白。结果显示,该方主要成分为异鼠李素、山奈酚、槲皮素、丹参酮IIA等,核心蛋白可受到多种药物有效成分的调控作用。见图5。

图5 成分-靶点拓扑分析网络图
2.5 核心靶点与药物有效成分的分子对接受体与配体的结合能低于-7 kJ·mol-1表示受体与配体之间具有强烈的结合能力[13]。将核心靶蛋白与相应主要成分进行分子对接发现,靶蛋白与对应化合物的结合能基本<-7 kJ·mol-1,将靶蛋白与其亲和力最强的化合物构建分子对接模式图,由此说明药物成分与作用靶点之间具有强烈的结合能力。见图6,表3。
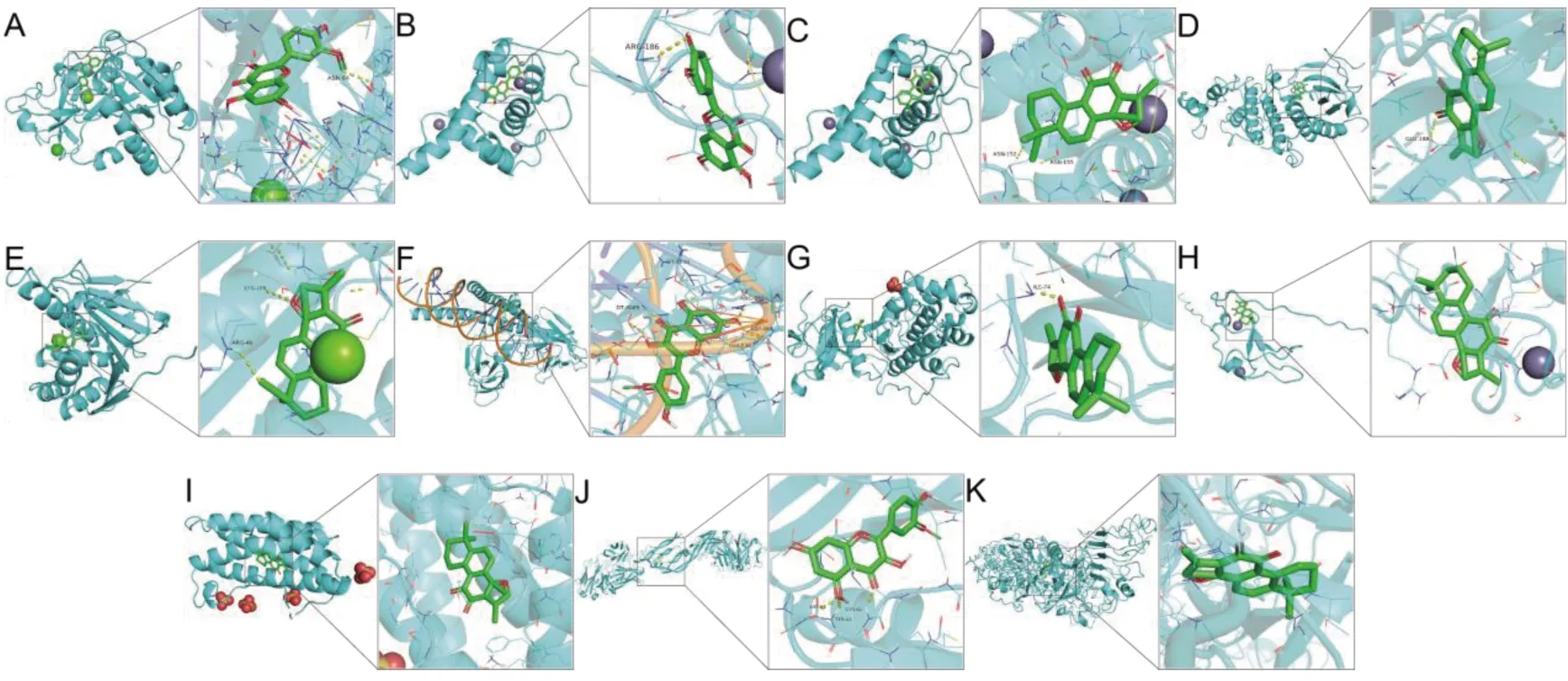
注:A:RAF1与异鼠李素;B:EP300与槲皮素;C:EP300与丹参酮IIA;D:STAT3与丹参酮IIA;E:HSP90AA1与丹参酮IIA;F:JUN与异鼠李素;G:MAPK1与丹参酮IIA;H:PRKCA与丹参酮IIA;I:IL6与丹参酮IIA;J:VEGFA与异鼠李素;K:EGFR与丹参酮IIA图6 分子对接模式图

表3 成分-靶点的分子对接数据
3 讨论
中医认为CHF的病机为心气虚损,血瘀痰阻,优化新生脉散方诸药合用,共奏益气活血利水之功,通过辨证对药物进行加减,治疗CHF实具良效。网络药理学体现了中医整体观的特点,有助于多层次阐明药物的作用机制。本研究借助网络药理学与分子对接方法对优化新生脉散方、CHF以及MF的关系进行探讨,考察优化新生脉散方在治疗CHF过程中抑制MF的具体调控机制及物质基础。
GO功能富集分析结果表明,优化新生脉散方对CHF过程中MF的治疗作用涉及GF结合、GPCRs结合、GPCRs活性、RTK活性、丝氨酸/苏氨酸激酶活性等。在缺血、缺氧、炎症等多种致病因素的作用下,心肌组织发生慢性代偿反应,促进心肌细胞、内皮细胞、炎症细胞及心肌成纤维细胞(Cardiac fibroblasts,CFs)等的病理反应,增加促纤维化因子的分泌,GF、炎症因子、胰岛素与CFs表面的RTK结合,血管紧张素与CFs表面的GPCRs结合,促进MF的发生[14-17]。KEGG富集分析结果表明,优化新生脉散方可能主要作用于PI3K-Akt通路、MAPK通路、Rap1通路、cAMP通路、EGFR通路等信号通路,抑制CHF过程中MF的发展。PI3K具有丝氨酸/苏氨酸蛋白激酶活性,其中,Ⅰ型PI3K研究最为广泛,包括ⅠA亚类和ⅠB亚类,ⅠA亚类主要由RTK激活,可在多种组织中表达;ⅠB亚类由GPCRs激活,主要表达于白细胞[18-19]。病理条件下,RTK被激活后可与PI3K p85亚基的SH2结构域结合,解除对P110的抑制,P110被RTK招募后激活PI3K,催化磷脂酰肌醇4,5-二磷酸生成磷脂酰肌醇-3,4,5-三磷酸(phosphatidylinositol-3,4,5-triphosphate,PIP3),PIP3再作为第二信使将Akt募集到质膜上与3-磷酸肌醇依赖性蛋白激酶1/2结合,活化的Akt通过磷酸化多种下游底物增强CFs转录因子的活性[20]。MAPK通路主要包括胞外信号调节激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)、p38MAPK和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK),p38MAPK与JNK通路主要调节心肌细胞的凋亡和分化,ERK通路与CFs的增殖相关[9]。ERK通路胞膜受体包括RTK和血管紧张素Ⅱ1型受体(angiotensin ii type 1 receptor,AT1),活化受体首先将信号传递至Src酪氨酸激酶(Src tyrosine kinase,Src)以磷酸化接头蛋白Shc,p-Shc与Grb2、SOS构成Shc/Grb2/SOS复合物激活Ras蛋白,诱导Raf-1的磷酸化[21-22]。p-Raf-1以三级激酶级联激活ERK1/2,进而激活Elk-1调控c-fos基因,启动CFs增殖[23]。心肌缺血/再灌注损伤小鼠模型中,抑制Rap1通路可减少心肌梗死面积、减轻心肌细胞肥大、炎症和MF程度[10,24]。cAMP信号通路的激活可抑制CFs的DNA合成,进而阻止CFs的增殖、分化、迁移和侵袭,使胶原生成减少[11,25]。EGFR通路的激活可上调促纤维化基因,增强Ⅰ、Ⅲ型胶原合成,引起MF和瘢痕,维持病理条件下心肌结构的完整性,如双调蛋白通过激活EGFR依赖性通路加重心肌梗死小鼠MF及心功能不全,分泌型磷脂酶A2-IIA可通过调节EGFR 转录激活以促进肌成纤维细胞分化,Ang II/醛固酮可激活TRIF/EGFR通路诱导小鼠心脏炎症、MF、肥大和功能障碍等[12,26-27]。
通过富集筛选核心蛋白、“通路-靶点”拓扑分析、“成分-靶点”拓扑分析及分子对接得出,优化新生脉散方主要成分为异鼠李素、槲皮素、山奈酚、丹参酮IIA等,通过干预EP300、MAPK1、RAF1、JUN等核心蛋白调控PI3K-Akt通路、MAPK通路、EGFR通路等信号通路。现代药理学表明,异鼠李素可通过阻断PI3K-Akt通路、TGFβ通路等信号通路,抑制I型胶原蛋白α1 mRNA的表达,减轻甚至逆转血管紧张素II所诱导的心肌细胞肥大和MF[28-29];槲皮素可结合SIRT5,促进IDH2去糖基化,维持线粒体内环境稳态,在炎症条件下保护小鼠心肌细胞,改善MF,降低CHF患者的住院率和病死率,同时,还可预防心脏脂肪堆积,减少高脂饮食诱导的MF、心肌细胞肥大、氧化应激和血管稀疏,通过调节miR-223-3p/FOXO3增加自噬,预防异丙肾上腺素诱导的MF。此外,槲皮素二水合物能够抑制Ang II诱导的CFs增殖和分化[30-33];山奈酚可抑制AngII诱导的CFs增殖和活化及Ⅰ/Ⅲ型胶原蛋白的合成,促进基质金属蛋白酶-1的表达,减轻MF程度[34-35];丹参酮IIA可减少ROS生成、抑制NADPH氧化酶和TGFβ1/SMAD-2/3通路及调控microRNA,以抑制CFs增殖、细胞外基质(如胶原和纤维连接蛋白)沉积,调节基质金属蛋白酶和金属蛋白酶组织抑制剂之间的平衡,发挥抗MF作用[36]。
综上所述,优化新生脉散方可能是通过异鼠李素、槲皮素、山奈酚、丹参酮IIA等多种有效成分作用于EP300、MAPK1、RAF1、JUN等核心蛋白,进而调控PI3K-Akt通路、MAPK通路、Rap1通路、cAMP通路、EGFR通路等信号通路,发挥抑制CFs过度增殖,恢复Ⅰ、Ⅲ型胶原的合成与分解动态平衡,减少ECM的病理性积聚,降低心肌中间质成分比重,最终改善MF的作用。本研究仅通过网络药理学和分子对接技术分析药物活性成分的吸收情况和结合能力,并未衡量其在复方中的含量及相互反应等问题,尚存在一定的局限性,但可为临床和实验研究提供大致的参考方向。
