恩诺沙星悬乳剂肌注给药在鸡体内的药动学研究
2022-06-09冯万宇陈亮苗艳张艳兰世捷沈思思李丹张蕾武晓东王丽坤金振华王岩
冯万宇 陈亮 苗艳 张艳 兰世捷 沈思思 李丹 张蕾 武晓东 王丽坤 金振华 王岩


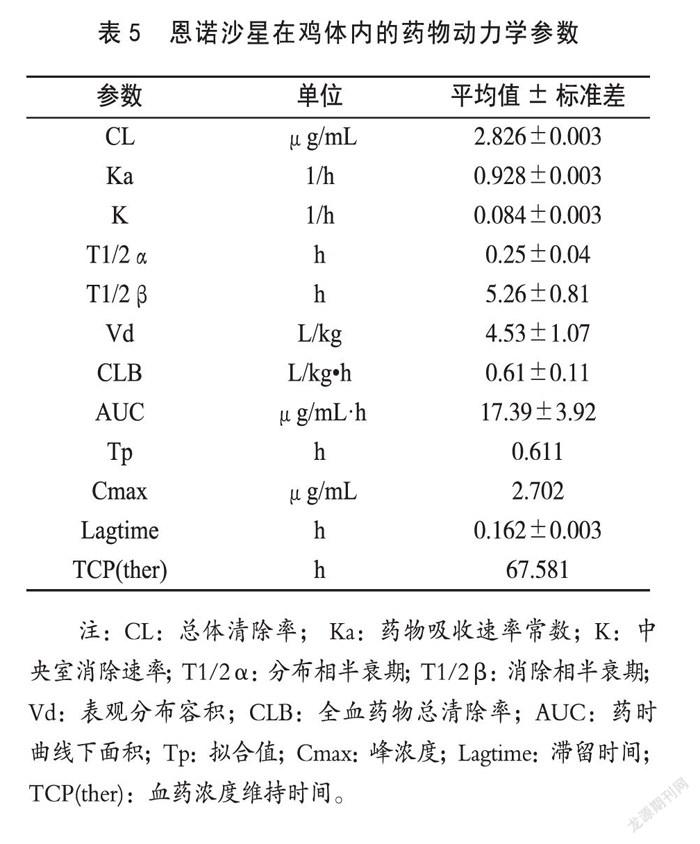
摘 要:为研究恩诺沙星悬乳剂在来航鸡体内的动力学,以肌注给药后利用RP-HPLC法测定鸡血浆中恩诺沙星浓度,恩诺沙星Ci-Ti数据采用MCPKP药物动力学计算机程序进行处理。肌注恩诺沙星后的Ci-Ti数据符合一级吸收二室开放性模型,其药代动力学参数T1/2α、T1/2β、Vd、CLB和AUC分别为0.25±0.04 h、5.26±0.81 h、4.53±1.07 L/kg、0.61±0.11 L/kg·h、17.39±3.92 μg/mL·h;试验结论显示鸡注射恩诺沙星后,在体内分布广泛,血药维持时间长、消除缓慢,有较好的临床应用前景。
关键词:恩诺沙星;悬乳剂;药代动力学;鸡
恩诺沙星属畜禽专用的第三代氟喹诺酮類抗菌药物,具有广谱抗菌、强力杀菌、作用迅速和在动物体内分布广的优点,与其它抗生素之间无交叉耐药,已被广泛应用于国内外家禽、家畜及水产渔业等动物临床领域[1,2]。目前,临床应用的多为普通注射液,每日多次用药给临床应用带来许多不必要的麻烦,研制长效制剂是兽医临床用药之所需[3,4]。
悬乳剂是固体悬浮体与乳状液混合形成的悬浮乳状体系,也有人称其为三相混合物或者悬浮体系[5,6],通过缓控药物释放来发挥其长效作用[7,8],其研究始于20世纪80年代后期。
本研究选择恩诺沙星悬乳剂为模型药物,考察恩诺沙星悬乳剂特性,并以来航鸡为动物模型来研究恩诺沙星悬乳剂的药代动力学特征,克服现有剂型用药次数多、作用时间短及易产生应激反应等方面存在的不足,打破传统给药方式的束缚,为兽用药物新剂型的研发提供技术参考,也为恩诺沙星悬乳剂实现临床用药提供理论依据[9~12]。
1 材料与方法
1.1 试验材料
1.1.1 试验动物 120日龄健康来航鸡10只,购于讷河天禹禽业有限公司,平均体重(1.54 ±0.43)kg。
1.1.2 药品与仪器 药品:恩诺沙星标准品,净含量100%,批号H201501,购于中国兽医药品监察所;恩诺沙星粉剂,浙江新昌国帮兽药厂,批号141108-2,净含量99%;恩诺沙星悬乳剂,规格5 mL:500 mg,批号20200716,本研究室自制;乙腈为色谱纯,磷酸、氢氧化钠和三乙胺为分析纯。
仪器:Agilent 1200液相色谱仪,日本santec公司。
1.2 试验设计
1.2.1 试验动物给药 将10只120日龄健康来航鸡预饲7 d后,取恩诺沙星悬乳剂摇匀,肌肉注射,注射剂量为20 mg/kg·bw。
1.2.2 血样采集 分别在给药后0、0.0833、0.5、0.75、1、2、4、6、8、12、24、36、48 h和60 h采取血样1.5~2 mL,置于装有适量肝素的试管中,摇匀,经4 000 r/min离心15 min,分离后取出血浆,置于-20 ℃冰箱冷冻保存、备用。
1.2.3 血浆样品处理 吸取血浆100 μL,加入0.5 mL乙腈,漩涡振荡混合1 min,以15 000 r/min离心10 min,取上清液于60 ℃恒温水浴锅中氮气吹干。加0.5 mL流动相,漩涡混合1 min,15 000 r/min离心10 min,弃去沉淀,以0.22 μm微孔滤膜过滤上清液,取样品20 μL进行测定。
1.2.4 色谱条件 固定相Wasters-C18反相柱(250mm×4.6mm,5μm);流动相0.05 mol/L H3PO4溶液/三乙胺-乙腈(82∶18,体积比);检测器激发波长为280 nm,发射波长为450 nm;柱温20 ℃;流速1.0 mL/min;进样量20 μL;最低检测限0.01 μg/mL;用外标法测定;流动相使用前经0.5 μm滤膜滤过,超声振荡15 min。
1.3 方法确证
1.3.1 方法专属性 取空白血浆100μL,按照1.2.3项操作处理,处理后的样品用高效液相色谱仪进行检测,可得空白血浆色谱图;取空白血浆100μL,加入恩诺沙星标准品10 μg,用0.03 mol/L氢氧化钠溶液稀释,使其恩诺沙星含量为10 μg/mL,按照1.2.3项操作处理,处理后的样品用高效液相色谱仪进行检测,可得含恩诺沙星的血浆标准色谱图;取肌注4 h恩诺沙星待检血浆样品,按照1.2.3项操作处理,处理后的样品用高效液相色谱仪进行检测,可得恩诺沙星待检样品血浆色谱图。
1.3.2 恩诺沙星血浆标准曲线和线性范围 称取50 mg恩诺沙星对照品,用0.03 mol/L氢氧化钠稀释为浓度1 mg/mL储备液为母液,4 ℃保存备用。各离心管中加入0.5 mL空白血浆,将恩诺沙星对照品母液加入其中,使各药物浓度为0.02、0.05、0.1、0.5、1.0、3.0 μg/mL和5.0 μg/mL,依1.2.3项处理后,从低浓度到高浓度作HPLC分析。每个浓度作3次重复,用重复性试验好的数据,以纵坐标为峰面积、横坐标为质量浓度,求线性回归方程和相关系数,并制作血浆标准曲线。根据相关系数,对血浆中恩诺沙星线性范围进行估测。
1.3.3 回收率测定 取空白血浆,将恩诺沙星对照品母液加入其中,使其浓度为0.1、0.5、1.5 μg/mL,依1.2.3项处理后进行HPLC数据分析,并以恩诺沙星血浆标准曲线回归方程计算其浓度,以其浓度和加入量进行比较,同时计算不同浓度恩诺沙星回收率,每个作3次重复。
1.3.4 方法精密度的测定 在空白血浆中加入恩诺沙星母液,使浓度分别为0.1、0.5、1.5 μg/mL,按1.2.3项处理后,测得恩诺沙星峰面积,每个浓度日内作3次重复,共作3个批次。计算批间及批内峰面积离散系数CV,估算本定量方法的精密度。
1.4 统计学处理
试验数据用Mintab 17软件处理,结果以平均值±标准差表示;药-时数据采用MCPKP药物动力学计算机程序软件进行计算、统计和拟合模型,并通过相关系数判断拟合模型好坏,同时计算出药动学有关参数。
2 结果与分析
2.1 方法确证数据与分析
2.1.1 恩诺沙星专属性分析 在本色谱条件下,恩诺沙星保留时间为5.24~5.27 min,与杂峰分离良好。空白血浆色谱图见图1,空白血浆+恩诺沙星标准品色谱图见图2,待检血浆样品恩诺沙星色谱图见图3。
2.1.2 恩诺沙星血浆标准曲线测定及线性范围测定 将恩诺沙星对照品添加至血浆中制成不同浓度溶液进行测定,测定结果如表1所示。以峰面积x对恩诺沙星标准液浓度Y求得回归方程:Y=94020x+4579.0,构建的恩诺沙星血浆标准曲线如图4。相关系数r=0.9994,表明待测样品中恩诺沙星浓度在0.02~5.0 μg/mL范围内与峰面积呈良好线性关系,最低检测限为0.02 μg/mL。
2.1.3 回收率试验结果 血浆样品中恩诺沙星的回收结果见表2。由表2可见,在0.1~1.5 μg/mL范圍内,血浆样品中恩诺沙星平均回收率为89.53%,测定结果准确,符合药动学要求,方法可行。
2.2 恩诺沙星悬乳剂在鸡体内药物动力学分析
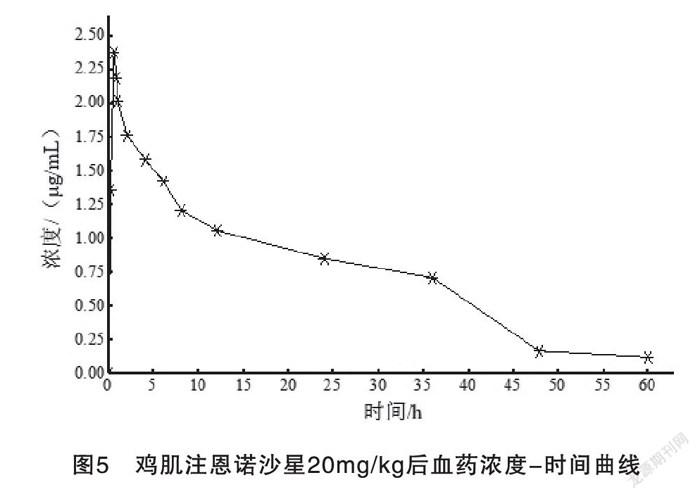
鸡注射恩诺沙星悬乳剂后,血中药物浓度随时间变化情况见表4。经药动学软件分析进行浓度-时间拟合,结果表明恩诺沙星悬乳剂在鸡体内的消除符合一级吸收二室开放模型,动力学参数见表5。药物-时间曲线图见图5。
3 讨论
恩诺沙星特点之一是起效快,但从体内排出去也快,常规注射剂型一般需要用药2次/d。已有试验研究证实,应用恩诺沙星混悬液治疗人工诱发动物大肠杆菌病,应用疗效确实可行,给药一次即可控制病情[11,12];对重症动物或顽固细菌感染疾病,疗效也相当满意[13,14]。研究长效恩诺沙星注射液肌注后在猪体内的药物动力学,研究结果表明,经5.64 h达到最高浓度4.86 μg/mL,吸收半衰期和消除半衰期分别为2.42 h和19.47 h,有效浓度维持时间为128.73 h,AUC为166.96 mg/L·h,
吸收半衰期显著延长,达峰时间极显著推迟(p<0.01),消除半衰期也显著长于恩诺沙星注射液[15-16]。本试验结果表明,对来航鸡肌注20mg/kg恩诺沙星悬乳剂后在体内的药代动力学参数显示,在鸡体内能迅速达到较高浓度,血浆达峰浓度Cmax为2.702 μg/mL,吸收半衰期和消除半衰期分别为0.25 h和5.26 h,AUC为17.39 μg/mL·h,这说明恩诺沙星制成悬乳剂后具有一定的缓释作用,肌注后药物从血中消除的速率(0.611 h)明显慢于普通注射剂[17-19],而且肌注24 h后血浆药物浓度(0.118~0.851 μg/mL)明显高于最低抑菌浓度0.08~0.75μg/mL[20-21],血药浓度维持时间也长达60 h以上。
4 结论
本试验研究结果表明,恩诺沙星悬乳剂在鸡体内的药代动力学特征优良,血药浓度维持时间也较长,可减少临床用药次数。此外,由于恩诺沙星悬乳剂工厂化生产工艺比较简单,制作成本相对低,非常容易实现产业化生产。因此,恩诺沙星悬乳剂是一种具有广泛开发和应用前景的兽医临床可用的新型抗菌药剂。
参考文献:
[1] 张航俊,周芷锦,侯轩,等.恩诺沙星、氟苯尼考和泰万菌素在鸡蛋中残留消除规律研究[J].食品安全质量检测学报,2021,12(19):7851-7856.
[2] 赵琳,张瑞英,孙向东,等.产前饲喂模式下恩诺沙星在初产蛋中的残留规律及膳食暴露评估[J].食品安全质量检测学报,2021,12(18):7473-7479.
[3] 单祥保,方龙香,施羽露,等.利用多介质环境逸度模型比较典型抗生素磺胺甲噁唑和恩诺沙星在水产养殖中的环境归趋[J].生态与农村环境学报,2021,37(08):1059-1065.
[4] 朱晓漫,刘永涛,杨秋红,等.恩诺沙星乳在罗非鱼体内的药代动力学及组织分布[J].淡水渔业,2021,51(04):42-48.
[5] 戴燕彬.恩诺沙星及其代谢产物在珍珠龙胆石斑鱼(Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus ♂)体内的代谢及消除规律[J].渔业研究,2021,43(03):299-306.
[6] 王美红. 恩诺沙星可溶性粉混饮给药在雏鸡的药动学特征[D].扬州:扬州大学,2021.
[7] 张佩,刘雪松,姜岩,等.恩诺沙星在比格犬体内的药代动力学研究[J].动物医学进展,2020,41(12):132-136.
[8] 许颖,邱阳阳,沈悦,等.恩诺沙星纳米乳的制备及喷雾给药的药效学评价[J].华南农业大学学报,2021,42(01):42-48.
[9] 唐敏敏,朱磊,栾枫婷,等.恩诺沙星在雪山鸡不同组织中残留消除规律研究[J].江苏农业科学,2020,48(21):215-219.
[10] 侯轩,周炜,陈勇,等.HPLC-MS/MS法研究恩诺沙星在鸡蛋中残留消除规律[J].畜牧与饲料科学,2020,41(05):46-51.
[11] 黄铢玉,方龙香,宋超,等.抗生素恩诺沙星在渔业中的研究进展[J].农学学报,2019,9(11):57-62.
[12] 杜昕悦,杨哲敏,赵宇,等.恩诺沙星与其他氟喹诺酮类药联合对畜禽常见病原菌抑菌效果探讨[J].黑龙江畜牧兽医,2019(20):140-143.
[13] 王玉万,潘贞德,戴晓曦.含阿维菌素类抗寄生虫药物的长效注射剂:中国,ZlL031568769[P]. 2006-05-22.
[14] 肖田安,尹烨华,梁眷衡,等.恩诺沙星长效注射液肌注后在猪体内的药动学研究[J].中国兽药杂志,2002(04):21-23.
[15] 肖田安,陈杖榴.氟喹诺酮类药物在动物体内的药动学研究进展[J].中国兽药杂志,2000(01):59-61.
[16] 孙红洋,白玉惠,尹晖,等.高效液相色谱-串联质谱法检测鸡蛋和鸡组织中恩诺沙星、环丙沙星残留的研究[J].中国家禽,2020,42(07):54-58.
[17] 王旗,余永涛,马春芳,等.恩诺沙星可溶性粉中有效成分含量的HPLC测定[J].动物医学进展,2020,41(09):41-45.
[18] 邱阳阳.禽用恩诺沙星纳米乳的制备及药效学评估[D].广州华南农业大学,2019.
[19] 刘婉玉,Tadiyose G B,赵洪霞.恩诺沙星在鲫鱼肝微粒体中的代谢及代谢关键酶[J].生态毒理学报,2020,15(03):64-70.
[20] 罗晶晶,张秀珍,宋怿,等.不同水温条件下恩诺沙星及其代谢物在俄罗斯鲟体内的代谢及消除规律[J].食品安全质量检测学报,2020,11(06):1749-1757.
[21] 郑育基,全家兴,霍皓远,等.恩诺沙星及其代谢物在1日龄鸡体内的药动学研究[J].动物医学进展,2019,40(11):59-62.
