一株鸡传染性贫血病毒的分离鉴定及全基因组序列分析
2022-06-09胡峰朱彤高月花黄兵宋敏训刘丹丹汪建华李玉峰
胡峰 朱彤 高月花 黄兵 宋敏训 刘丹丹 汪建华 李玉峰


摘 要:利用MDCC-MSB1细胞系从某养鸡场疑似鸡传染性贫血病毒(chicken infectious anemia virus,CIAV)感染的发病鸡组织病料中进行病毒分离,并通过PCR、病毒基因序列测序分析,确定分离到一株鸡源CIAV,并命名为CZ16。将分离株全基因组进行PCR分段扩增、测序,结果显示分离株CZ16基因组序列全长为2 298 bp,VP1、VP2、VP3基因大小分别为1 350、651、366 bp,两端5'和3'非编码区长度分别为358 bp和117 bp。全基因组序列同源性分析结果显示CZ16与国内外已发表的36个CIAV毒株全基因组核苷酸同源性在95.6%~99. 6%之间,与国内毒株GD-102关系最近,与澳大利亚毒株(U65414.1)关系最远。研究结果为鸡传染性贫血病病原学研究提供材料。
关键词:传染性贫血病毒;病毒分离;全基因组;进化分析
鸡传染性贫血病是由鸡传染性贫血病毒(CIAV)感染引起的鸡主要免疫抑制病,其中雏鸡最易感[1]。CIAV感染后主要病理特征是胸腺萎缩和骨髓黄化,从而造成贫血和免疫抑制,容易继发其它病毒、细菌、寄生虫感染[2-3]。CIAV不仅可以感染鸡,还可感染野生鸟类[4]。CIAV属于圆环病毒科,环形病毒属,病毒粒子呈球形,无囊膜。病毒基因组为单股环状DNA,编码3个蛋白质(VP1、VP2、VP3)[5]。目前发现的CIAV均属于同一个血清型,但不同地区不同毒株之间毒力不同,基因组序列也存在一定的差异[6]。本实验室接诊了某养殖公司送检的疑似鸡传染性贫血病毒感染病例,通过病毒分离、PCR检测、病毒基因序列测序分析,确定分离到1株CIAV,为进一步了解CIAV的流行规律提供材料。
1 材料与方法
1.1 试验材料及试剂
病料:来自河北某养鸡场。
试剂:高保真聚合酶,GenStar产品;DNA提取试剂盒,AxyGen公司产品;克隆载体pMD18T,购自宝生物(大连)生物技术有限公司;MDCC-MSB1細胞,哈尔滨兽医研究所惠赠。
1.2 引物设计与合成
根据GenBank中已发表的CIAV毒株基因序列设计并合成3对引物用于病毒分离鉴定和全长基因组扩增。
病毒鉴定引物对:CAV-F:5'-GGACCATCAA
CGGTGTTCAG-3',CAV-R:5'-CCTCAAGTCCGG
CACATTCT-3',预计扩增产物长度为200 bp。
扩增VP1和3'UTR基因引物对:3VP1-F:5'-ATGGCAAGACGAGCTCGCAGAC-3',3VP1-R:5'-GATTGTGCGATAAAGCCATTTG-3',预计扩增产物长度为1 467 bp。
扩增VP2(含VP3)和5'UTR基因引物对:5VP2-F:5'-GCATTCCGAGTGGTTACTATTCC-3',
5VP2-R:5'-TTACACTATACGTACCGG-3',预计扩增产物长度为1 009 bp,引物由青岛擎科生物技术有限公司合成。
1.3 病毒分离
无菌采集的病死鸡肝脏、脾脏等脏器,经实验室检测初步确定为CIAV阳性。病料混合后以1∶5比例加入含有青霉素、链霉素的灭菌生理盐水,研磨,离心取上清,过滤除菌后接种于MDCC细胞,定期观察细胞生长状态,待细胞出现明显病变后收集细胞悬液,-80 ℃保存。
1.4 PCR鉴定
按照试剂盒(Axygen)说明书提取细胞悬液病毒核酸,利用设计的引物进行PCR鉴定,PCR反应体系25 μL:2 ×Taq PCR StarMix 12.5 μL,
上下游引物(20 μmol/L)各0.5 μL,DNA模板2 μL,超纯水9.5 μL。扩增条件:94 ℃ 预变性2 min;94 ℃ 20 s,50 ℃ 20 s,72 ℃ 90 s,35个循环;72 ℃延伸5 min。PCR产物经琼脂糖电泳鉴定并测序。
1.5 病毒全基因组克隆
取1.4中提取的病毒核酸,利用设计的引物(3VP1-F/3VP1-R, 5VP2-F/5VP2-R)PCR扩增病毒全基因组序列,PCR产物纯化回收后与pMD18T载体连接,转化DH5α感受态细胞,筛选阳性克隆,送青岛擎科生物技术有限公司测序。
1.6 病毒全基因组序列分析
对全基因组序列进行拼接,并利用Mega6.0软件将分离株与其它在GenBank已发表的36个毒株进行序列比对和遗传进化分析。
2 结果
2.1 病毒分离
组织病料经无菌处理后接种MDCC细胞,48 h后开始出现细胞病变,细胞死亡,碎片增多,而对照组MDCC未出现细胞病变(图1)。将病毒扩大培养,并将该分离株命名为CZ16。
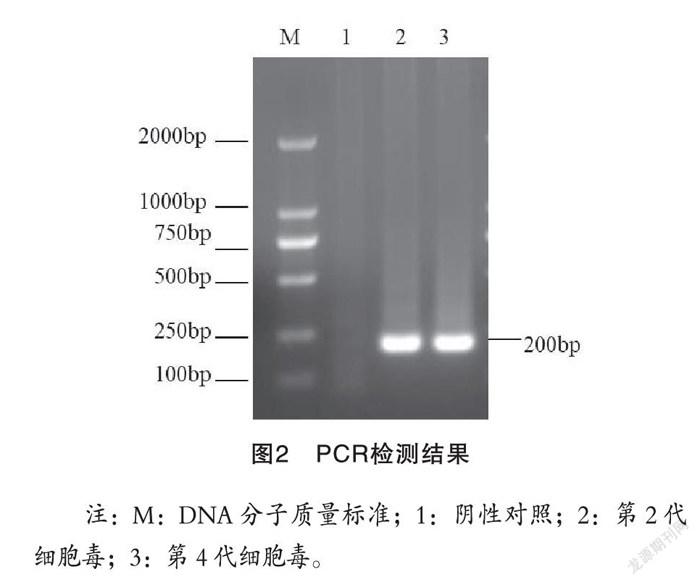
2.2 特异性PCR检测
以提取的第2代和第4代细胞培养病毒DNA为模板,利用特异性引物进行PCR鉴定,琼脂糖凝胶电泳结果显示在约200 bp处出现目的条带(图2)。
注:M:DNA分子质量标准;1:阴性对照;2:第2代细胞毒;3:第4代细胞毒。
2.3 全基因组分段扩增和序列分析
病毒全基因组PCR扩增结果显示,扩增获得两条目的片段,且大小与预期结果相符(图3)。将PCR产物连接到pMD18T载体中,测序结果显示分离株CZ16基因组全长为2 298 bp, 其中VP1基因大小为1 350 bp,VP2基因大小为651 bp,VP3基因大小为366 bp,VP3基因完全包括在VP2基因中,基因组的两端为5'和3'非编码区,长度分别为358 bp和117 bp,与已知的CIAV基因组结构一致,均无缺失或插入。同源性分析表明CZ16与GenBank中收录的CIAV流行株全基因组核苷酸同源性在98.61%~99. 56%之间。CZ16 VP1氨基酸序列与标准毒株Cux-1有12个氨基酸差异,而与中国毒株SC-MZ只有1个氨基酸差异。氨基酸序列分析还发现了CZ16与其它36个毒株VP1氨基酸序列的一些变异位点,这些变异位点主要分布于VP1基因的aa 136~157、aa 357~376及aa 436~448区域(图4)。A6AD6A04-CE0E-4BF6-8BBB-8B1CF407BF53
2.4 分离株遗传进化分析
分离株CZ16与其它GenBank已发表的CIAV毒株全基因组序列遗传进化分析结果显示, CZ16与亚洲流行毒株亲源关系较近,其中与中国分离株GD-102(KU050677.1)关系最近,与澳大利亚的U65414.1关系最远(图5)。
3 讨论
鸡传染性贫血病对鸡群的主要危害是产生免疫抑制,继而造成鸡群易感其它病毒和细菌,使得疫病发生更加复杂[7]。鸡传染性贫血病是家禽重要的垂直传播性疫病,严重影响家禽养殖,特别是种业生产。目前,种业已成为国家战略性和基础性核心产业,种源质量直接关系到家禽业健康发展的未来,对垂直传播性疫病进行研究是保障家禽种源质量的核心和关键。由于CIAV容易与其它病毒和细菌混合感染,所以病原分离较困难。本研究基于CIAV易感细胞MDCC,成功分离获得一株CIAV,并对分离株基因组序列进行分析。
基因序列分析结果表明,分离株CZ16与GenBank中收录的CIAV流行株全基因组核苷酸同源性在98.61%以上,说明该分离株变异很小。VP1氨基酸序列分析结果表明变异位点散在分布于基因中,但主要还是集中在关键的氨基酸区域,特别是aa 136~157高变区域。VP1基因编码CIAV的衣壳蛋白,也是病毒的主要抗原基因,它的变异可能与病毒和宿主相互作用有关,但具体变异机制还需要进一步研究。已有研究表明CIAV VP1蛋白第394位氨基酸是决定病毒致病性强弱的关键位点,谷氨酰胺(Q)代表强感染性,组氨酸(H)代表弱感染性[8]。本研究中,分离株CZ16 VP1蛋白第394位氨基酸是Q,说明该分离株是强感染性毒株,但其对鸡的致病性还需要动物实验进一步证实。系统发育进化树分析结果显示,所比对的37个CIAV毒株既有来自中国、韩国、日本、马来西亚等亚洲毒株,也有美国、德国等欧美来源毒株,它们分布在各个进化分支中,没有表现出明显的地域性。本研究中,分离株CZ16与国内分离株GD-102关系最近,与澳大利亚分离株U65414.1关系最远。
本研究成功分离到一株CIAV,并对其全基因组序列进行系统分析,为更全面了解CIAV流行规律、致病性提供材料,同时为鸡传染性贫血病的有效防控奠定一定的基础。
参考文献:
[1] Fatoba AJ, Adeleke MA. Chicken anemia virus: A deadly pathogen of poultry [J]. Acta Virol, 2019, 63 (1):19-25.
[2] Li Y, Yan N, Wang Y, et al. Molecular evolution and pathogenicity of chicken anemia virus isolates in China[J]. Arch Virol, 2021, 166(2): 439-449.
[3] Luan Q, Jiang Z, Wang D, et al. A sensitive triple nanoparticle-assisted PCR assay for detection of fowl adenovirus, infectious bursal disease virus and chicken anemia virus [J]. J Virol Methods, 2022, 303:114499.
[4] 劉婉思,高宏雷,秦立廷,等.1株野鸭源鸡贫血病病毒的分离鉴定及其编码区基因序列分析[J].中国兽医学报,2013,33(05): 654-658.
[5] Rosario K,Breitbart M, Harrach B, et al. Revisiting the taxonomy of the family Circoviridae: establishment of the genus Cyclovirus and removal of the genus Gyrovirus [J]. Arch Virol, 2017, 162(5):1447-1463.
[6] Li Y, Fang L, Cui S, et al. Genomic Characterization of Recent Chicken Anemia Virus Isolates in China [J]. Front Microbiol, 2017, 8:401.
[7] Gimeno IM, Schat KA. Virus-Induced Immunosuppression in Chickens [J]. Avian Dis, 2018, 62(3):272-285.
[8] Eltahir YM, Qian K, Jin W, et al. Molecular epidemiology of chicken anemia virus in commercial farms in China [J]. Virol J, 2011,8:145.
Isolation and Complete Genomic Sequence Analysis of
a Chicken Infectious Anemia Virus Strain
HU Feng1, ZHU Tong1, GAO Yuehua1, HUANG Bing1, SONG Minxun1,
LIU Dandan1, WANG Jianhua2, LI Yufeng2
(1.Institute of Poultry Science, Shandong Academy of Agricultural Sciences / Shandong Provincial Key Laboratory of Immunity and Diagnosis of Poultry Diseases, Jinan 250100,China;A6AD6A04-CE0E-4BF6-8BBB-8B1CF407BF53
2. Shandong Hekangyuan Biological Breeding Co., Ltd, Jinan 250000,China)
Abstract: Chicken infectious anemia virus (CIAV) strain CZ16 was successfully isolated on MDCC-MSB1 cells from chicken flock suspicious of infected CIAV, and identified by PCR and gene sequence analysis. The complete genomic sequence of the virus was amplified by PCR, cloned, and sequenced. The results showed that the whole genome of CZ16 was comprised of 2298 nt, and the length of VP1, VP2, and VP3 gene was 1350,651 and 366 bp, respectively. The length of 5' and 3' untranslated regions was 358 bp and 117 bp, respectively. The nucleotide homology of complete genomic sequences between CZ16 strain and other CIAV isolates ranged from 95.6%~99.6%. Based on phylogenetic analysis of the complete genomic nucleotide sequence of CZ16 strain and other CIAV isolates, the phylogenetic tree showed a relatively close genetic distance from the internal strain GD-102, and a far genetic distance from the external strain (U65414.1) of Australia. A CIAV stain was isolated successfully and analyzed, which provided material for further study.
Keywords: Chicken infectious anemia virus;Isolation;complete genome;Phylogenetic analysisA6AD6A04-CE0E-4BF6-8BBB-8B1CF407BF53
