吕氏泰勒虫与尤氏泰勒虫形态学、标签基因选择及其遗传进化分析
2022-06-09李中波李晖罗世民
李中波 李晖 罗世民


摘要:为比较吕氏泰勒虫、尤氏泰勒虫形态学及选择合适基因标签,以期探究它们间的遗传进化关系。借助光学显微镜观察2种泰勒虫的形态结构;利用PCR技术分别扩增了吕氏泰勒虫与尤氏泰勒虫的cox1、18S rRNA及28S rRNA等3个标签基因的部分序列,分别比对它们相应基因的同源性,分析吕氏泰勒虫与尤氏泰勒虫基因差异,并利用其cox1、18S rRNA和28S rRNA基因序列分别构建了它们的遗传进化树。研究结果表明,吕氏泰勒虫多呈圆点形、卵圆形和短杆状,而尤氏泰勒虫多呈逗点状、十字架状及三叶草形;吕氏泰勒虫cox1、18S rRNA及28S rRNA基因序列的长度分别为1 122、1 303、1 995 bp;尤氏泰勒虫cox1、18S rRNA及28S rRNA基因序列的长度分别为1 123、1 303 、1 990 bp;两者cox1、18S rRNA及28S rRNA基因序列比对,其相似度分别为80.32%、95.87%及88.64%;所構建的3个遗传进化树均显示吕氏泰勒虫与尤氏泰勒虫未处于进化树一分支。提示吕氏泰勒虫与尤氏泰勒虫尽管形态极为相似,但它们间存在较远的亲缘关系,且cox1、18S rRNA及28S rRNA基因序列适用于泰勒虫种属的鉴别。
关键词:吕氏泰勒虫;尤氏泰勒虫;形态学;标签基因;选择;遗传进化
中图分类号:S852.72 文献标志码: A
文章编号:1002-1302(2022)09-0173-06
羊泰勒虫病是由隶属于泰勒科、泰勒属的泰勒原虫经蜱传播,寄生于山羊、绵羊的红细胞、淋巴细胞及巨噬细胞内,引起的一类以高热、消瘦、贫血、黄疸及血红蛋白尿特征性临床症状的血液原虫病[1-3]。该类疾病分布广泛,自1914年首次于埃及发现后,已陆续报道于世界上多个国家和地区[4]。目前,该病在我国的青海省、甘肃省、辽宁省、内蒙古自治区、山西省、宁夏回族自治区、新疆维吾尔自治区、湖北省、河南省、云南省、贵州省等省(区)均有报道[5-7]。迄今为止,国内外共发现6种泰勒虫可感染羊群[8],它们分别为莱氏泰勒虫(Theileria lestoquardi)、尤氏泰勒虫(T. uilenbergi)、吕氏泰勒虫(T. luwenshun)、绵羊泰勒虫(T. ovis)、隐藏泰勒虫(T. recondita)及分离泰勒虫(T. separata)[9-10]。相关研究发现,吕氏泰勒虫、尤氏泰勒虫及莱氏泰勒虫的致病力较其他虫株强[11],其中,吕氏泰勒虫与尤氏泰勒虫已成为我国优势虫种[12],且吕氏泰勒虫流行最为广泛[8]。如钟维等对四川阿坝州牦牛及藏绵羊感染吕氏泰勒虫的情况进行调查,发现其感染率高达75%[13]。由此可见,泰勒虫病已严重危害动物健康[14],极大阻碍了世界畜牧业发展。
物种精准鉴定不仅是开展寄生虫研究的前提和基础[15],同时,也是有效监测、控制和防治寄生虫病的关键环节之一。然而,传统物种鉴定及分类主要依据物种自身的形态特征划分,高度依赖样本的完整性和鉴定者的经验[16],其鉴定和分类结果受人为主观因素影响极大,难免会出现一定程度偏差,甚至完全错误,造成形态不完整或极为相似的物种及处于不同发育阶段的同一物种鉴定有误的情况,给防治带来极大的挑战,故选择合适的基因标签在寄生虫的种类鉴定及分类鉴定等方面至关重要。吕氏泰勒虫与尤氏泰勒虫均为我国的优势虫种,其形态结构及其所引发的临床症状也极为相似,很难利用传统的物种鉴定、分类方法将它们区别开来。核糖体与线粒体的基因因具有进化速度快,缺乏基因重组及母系遗传等特征,已广泛应用于种群结构、分子标记、生物进化、种系发生及物种鉴定等方面的研究[17-18]。例如,王天葆等[19]、王坤轮等[20]就分别利用核糖体18S rRNA基因去鉴定云南省和陕西麟游县羊源性泰勒虫的种类及其遗传进化关系。为此,本研究于2020年6—9月在怀化职业技术学院动物科技系寄生虫实验室对分离于湖南省湘西自治州吕氏泰勒虫与尤氏泰勒虫标签基因的差异及其遗传进化关系进行分析,其结果不仅可为今后对泰勒虫的种类鉴定、分类和分子流行病学调查提供有用信息和技术指导,还可为以后泰勒虫病的诊断、控制及防治提供参考和依据。
1 材料与方法
1.1 样品采集
本研究所用吕氏泰勒虫(T. luwenshun)(n=13)、尤氏泰勒虫(T. uilenbergi)(n=12)均采自于湘西地区不同病羊的血液中。采集后,进行编号、记录位置,立即置于冰盒内。
1.2 主要试剂
动物血液、组织DNA提取试剂盒,购于北京天根有限公司;Taq保真酶,购于宝生物工程(大连)有限公司;蛋白酶K和2000 DNA Marker,均购于北京全式金生物技术有限公司;电泳缓冲液,购于南京诺唯赞生物科技股份有限公司。
1.3 虫株的鉴定
采用胶头滴管分别从2份阳性血液中吸取 1 mL 血液,分别滴1滴血液于2片洁净的载玻片上,均匀涂抹、风干;姬姆萨染色,先甲液固定 10 min,后乙液染色30 min;蒸馏水去除染色颗粒,待自然风干后,再置于40倍镜下观察。
1.4 DNA提取
首先,从含有吕氏泰勒虫、尤氏泰勒虫病羊的血液中,吸取0.15 mL血液,分别置于2个洁净的离心管内,混合均匀、编号。再根据血液、组织DNA提取试剂盒的使用说明书,分别提取含有吕氏泰勒虫与尤氏泰勒虫山羊血液的基因组 DNA。将提取好的DNA样品,分别置于-20 ℃保存、备用。
1.5 标记基因序列的扩增及测序
根据NCBI所公布吕氏泰勒虫与尤氏泰勒虫的cox1、18S rRNA及28S rRNA基因序列,设计3对特异性引物(表1),发至生工生物工程(上海)股份有限公司进行合成。71B92BC9-5A5F-449D-8132-6887D5119BAA
对吕氏泰勒虫、尤氏泰勒虫的cox1、18S rRNA及28S rRNA基因序列进行PCR扩增。PCR扩增体系(总体积均为50 μL):Taq 酶(MIX)均25 μL,DNA模板均1 μL,上下游引物各均1 μL,dH 2O均22 μL。PCR扩增程序95 ℃预变性5 min;95 ℃变性30 s,54 ℃(cox1)、58 ℃(18S rRNA)、56 ℃(28S rRNA)退火30 s,72 ℃延伸2 min,共35个循环;最后72 ℃均再延伸5 min。待PCR反应完成后,分别从每个反应体系吸取5 μL PCR产物在1.5%琼脂糖上进行凝胶电泳检测,观察结果并拍照。将所有PCR产物发送至生工生物工程(上海)股份有限公司进行双向测序,获得吕氏泰勒虫、尤氏泰勒虫的cox1、18S rRNA及28S rRNA基因序列。将所得序列经BLAST分析比对,确认它们均为目的基因序列。再运用Clustal X[21]软件对所获基因序列进行拼接和组装。
1.6 基因序列差异与遗传进化分析
基于吕氏泰勒虫、尤氏泰勒虫的cox1、18S rRNA及28S rRNA基因序列,运用软件DNAMAN对它们标记基因序列间的差异进行分析;运用软件Clustal X、PhyML3.0[22]及MEGA5.0[23]对吕氏泰勒虫、尤氏泰勒虫的遗传进化关系进行分析;运用软件FigTree v1.3.1[24]描绘出所构建的遗传进化树。
2 结果与分析
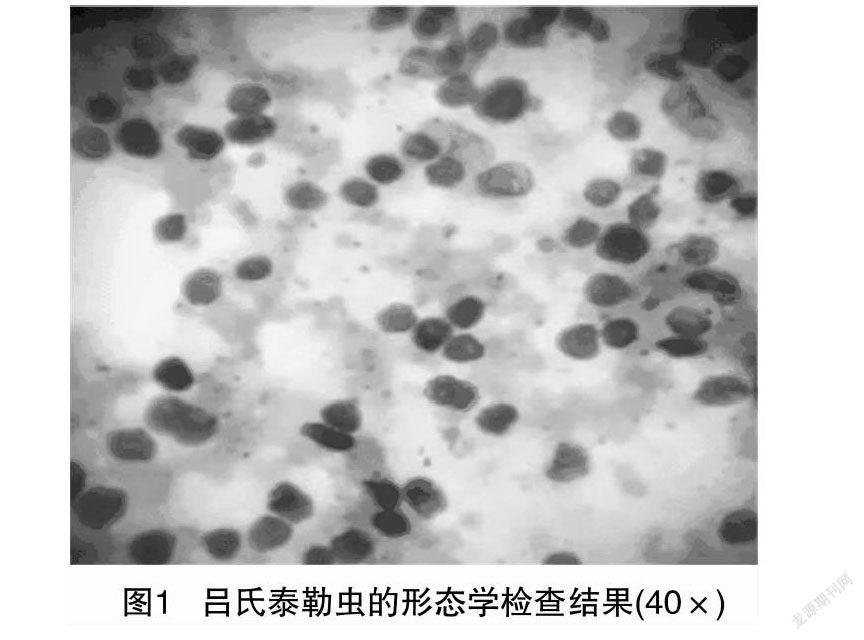
2.1 虫株形态学观察结果
由图1可知,病羊红细胞中存有呈圆点形、卵圆形及短杆状的多形态虫体,参照相关文献,发现该份山羊红细胞内所含的虫体与王天堡等所描述吕氏泰勒虫的形态[19]极为相似,从而初步鉴定该虫株为吕氏泰勒虫。
由图2可知,病羊红细胞中存有呈逗点状、十字架状及三叶草形的多形态虫体,参照相关文献,发现该份山羊红细胞内所含的虫体与李有全等所描述尤氏泰勒虫的形态[25]极为相似,从而初步鉴定该虫株为尤氏泰勒虫。
2.2 吕氏泰勒虫、尤氏泰勒虫cox1的扩增结果
吕氏泰勒虫与尤氏泰勒虫cox1基因序列的扩增结果见图3。由图3可知,2个PCR产物均为阳性,每个泳道仅含1个条带,无明显杂带,且大小与预期一致,大小均约为1 200 bp。每个样品重复3次测序,待测序完成,将所获全部序列进行校准、对齐。最终获得吕氏泰勒虫与尤氏泰勒虫cox1基因序列的长度分别为1 122、1 123 bp。将处理后的序列提交到NCBI,分别获得其基因登录号:MW879215、MW879216。
2.3 吕氏泰勒虫、尤氏泰勒虫18S rRNA的扩增结果
吕氏泰勒虫与尤氏泰勒虫18S rRNA基因序列的扩增结果见图4。由图4可知,2个PCR产物均为阳性,每个泳道仅含1个条带,无明显杂带,且大小与预期的相一致,大小均约为1 400 bp。每个样品重复3次测序,待测序完成,将所获全部序列进行校准、对齐。最终获得吕氏泰勒虫与尤氏泰勒虫18S rRNA基因序列的长度均为1 303 bp。将处理后的序列提交至NCBI,分别获得其基因登录号:MW881298、MW881299。
2.4 呂氏泰勒虫、尤氏泰勒虫28S rRNA的扩增结果
吕氏泰勒虫与尤氏泰勒虫28S rRNA基因序列的扩增结果见图5。由图5可知,2个PCR产物均为阳性,每个泳道仅含1个条带,无明显杂带,且大小与预期的相一致,大小均约为2 000 bp。每个样品重复3次测序,待测序完成,将所获全部序列进行校准、对齐。最终获得吕氏泰勒虫与尤氏泰勒虫28S rRNA基因序列的长度分别为1 995、1 990 bp。将处理后的序列提交至NCBI,分别获得其基因登录号:MW881300、MW882064。
2.5 2种泰勒虫cox1、18S rRNA及28S rRNA基因序列分析
所获吕氏泰勒虫cox1、18S rRNA及28S rRNA基因序列与GenBank中吕氏泰勒虫相对应序列的相似度分别为100.0%、99.8%和100.0%;尤氏泰勒虫cox1、18S rRNA及28S rRNA基因序列与GenBank中尤氏泰勒虫相对应序列的相似度分别为100%、100%和100%。2种泰勒虫cox1、18S rRNA及28S rRNA基因序列的4种碱基(A、T、G、C)的含量见表2。进一步比较吕氏泰勒虫与尤氏泰勒虫的cox1、18S rRNA及28S rRNA基因序列,发现其相似度分别为80.32%、95.87%及88.64%。
2.6 遗传进化分析
基于cox1基因序列,本研究以所获的吕氏泰勒虫、尤氏泰勒虫及从NCBI下载的东方泰勒虫(T. orientalis)(AB499090)、马泰勒虫(T. equi)(MF510491)及小泰勒虫(T. parva)(AB499089)为内群,以双芽巴贝斯虫(Babesia bigemina)(AB499085)为外群,构建其遗传进化树。由图6可知,吕氏泰勒虫与尤氏泰勒虫未位于进化树的一分支上。
基于18S rRNA基因序列,本研究以所获的吕氏泰勒虫、尤氏泰勒虫及从NCBI下载的绵羊泰勒虫(T. ovis)(AY260172)、分离泰勒虫(T. separata)(AY260175)、环型泰勒虫(T. annulata)(KF429795)、瑟氏泰勒虫(T. sergenti)(AY661515)、水牛泰勒虫(T. buffeli)(DQ104611)、中华泰勒虫(T. sinensis)(EU274472)、东方泰勒虫(T. orientalis)(LC576821)、狍泰勒虫(T. capreoli)(AY726011)、马泰勒虫(T. equi)(MT903276)及小泰勒虫(T. parva)(HQ895985)为内群,以双芽巴贝斯虫(Babesia bigemina)(KM046917)为外群,构建其遗传进化树。由图7可知,吕氏泰勒虫、尤氏泰勒虫分别位于进化树的不同分支上。71B92BC9-5A5F-449D-8132-6887D5119BAA
基于28S rRNA基因序列,本研究以所获的吕氏泰勒虫、尤氏泰勒虫及从NCBI下载的绵羊泰勒虫(T. ovis)(JN696672)、环型泰勒虫(T. annulata)(JN696676)、瑟氏泰勒虫(T. sergenti)(JN696679)、水牛泰勒虫(T. buffeli)(HM538241)、中华泰勒虫(T. sinensis)(JN696681)、东方泰勒虫(T. orientalis)(XR_696410)、马泰勒虫(T. equi)(MF510487)及小泰勒虫(T. parva)(AF218825)为内群,以双芽巴贝斯虫(Babesia bigemina)(JN391440)为外群,构建其遗传进化树,由图8可知,吕氏泰勒虫、尤氏泰勒虫分别位于进化树的2个不同分支上。
3 讨论
吕氏泰勒虫、尤氏泰勒虫为我国泰勒虫株的优势虫株[12]。如王坤轮等[20]、孟林明等[26]分别就陕西麟游县、甘肃武威市山羊感染吕氏泰勒虫的情况进行了流行病学调查,发现其感染率分别为61.2%和64%;可见其分布广泛,毒力之强,已严重威胁动物健康,极大阻碍了世界畜牧业的发展。目前,检测泰勒虫病的经典手段依然是形态学方法,其检测结果准确与否直接取决于检测者的经验和水平[27]。然而,吕氏泰勒虫与尤氏泰勒虫同属于泰勒属但不同物种的血液原虫,其形态结构极为相似,很难用形态学方法快速、准确地将其区别开来,故快速、精准地鉴定对泰勒虫病的防治至关重要。因此,比对吕氏泰勒虫与尤氏泰勒虫分子标记的差异及遗传进化关系对医学、公共卫生事业及畜牧业具有十分重要的意义,其结果不仅有助于泰勒虫的种类鉴定、分类、种群结构、基因变异及遗传进化等方面研究,还有利于泰勒虫病的流行病学调查、诊断、控制及相关药物的研发。
基于cox1基因序列,发现吕氏泰勒虫与尤氏泰勒虫的相似度为80.32%;基于18S rRNA基因序列,发现吕氏泰勒虫与尤氏泰勒虫的相似度为95.87%;基于28S rRNA基因序列,发现吕氏泰勒虫与尤氏泰勒虫的相似度为88.64%。显然,吕氏泰勒虫与尤氏泰勒虫的3个标记基因序列的相似度较低,相同基因序列间存在较大差异,这表明cox1、18S rRNA及28S rRNA基因序列能够准确鉴定吕氏泰勒虫与尤氏泰勒虫,暗示这3个标记基因适用于泰勒属原虫之间的种属鉴定。基于cox1基因序列吕氏泰勒虫与尤氏泰勒虫的相似度显著低于18S rRNA和28S rRNA基因序列。这主要由于cox1、18S rRNA及28S rRNA基因分别为线粒体和核糖体基因,其具有进化速度快、种内变异小而种间变异大等特点[28-29],尤其cox1基因演化速率是其他基因的 3 倍,能够很好地区分物种[30]。此外,吕氏泰勒虫与尤氏泰勒虫的cox1基因序列AT含量显著高于GC含量,明显呈AT偏斜,其主要原因为cox1基因是一线粒体基因,而后生动物线粒体基因组及其基因均呈AT偏斜,与之前其研究结果[24]相一致。
在基于cox1、18S rRNA及28S rRNA基因序列所构建的遗传进化树中,发现吕氏泰勒虫与尤氏泰勒蟲均未处于进化树的一个分支上,表明吕氏泰勒虫与尤氏泰勒虫间的亲缘关系较远。
结合吕氏泰勒虫与尤氏泰勒虫cox1、18S rRNA、28S rRNA基因序列的相似度,及遗传进化分析结果,推断吕氏泰勒虫与尤氏泰勒虫间存在较远的亲缘关系,且cox1、18S rRNA及28S rRNA基因序列适用于泰勒虫种属的鉴别。
4 结论
尽管吕氏泰勒虫与尤氏泰勒虫的形态相似,很难用形态学方法将其区分,但两者cox1、18S rRNA及28S rRNA基因序列的相似度较低,能够准确地将其区分。因此,推断吕氏泰勒虫与尤氏泰勒虫间存在较远的亲缘关系,且cox1、18S rRNA及28S rRNA基因序列适用于泰勒属原虫间的种属鉴定。
参考文献:
[1]闫亚群. 羊吕氏泰勒虫与嗜吞噬细胞无浆体双重PCR检测方法的建立与应用[D]. 郑州:河南农业大学,2018.
[2]Morrison W I. The aetiology,pathogenesis and control of theileriosis in domestic animals[J]. Revue Scientifique et Technique (International Office of Epizootics),2015,34(2):599-611.
[3]Luo J X,Yin H. Theileriosis of sheep and goats in China[J]. Tropical Animal Health and Production,1997,29(4):8S-10S.
[4]Tian Z C,Liu G Y,Yin H,et al. First report on the occurrence of Theileria sp. OT3 in China[J]. Parasitology International,2014,63(2):403-407.
[5]Hooshmand-Rad P,Hawa N J. Malignant theileriosis of sheep and goats[J]. Tropical Animal Health and Production,1973,5(2):97-102.
[6]Li Y Q,Zhang X A,Liu Z J,et al. An epidemiological survey of Theileria infections in small ruminants in central China[J]. Veterinary Parasitology,2014,200(1/2):198-202.71B92BC9-5A5F-449D-8132-6887D5119BAA
[7]Yang Y,Mao Y J,Kelly P,et al. A Pan-Theileria FRET-qPCR survey for Theileria spp. in ruminants from nine provinces of China[J]. Parasites & Vectors,2014,7:413.
[8]陈 倩,王坤轮,闫亚群,等. 中国不同地区羊吕氏泰勒虫分子流行病学调查及遗传进化分析[J]. 中国畜牧兽医,2020,47(6):1902-1909.
[9]Ahmed J S,Luo J X,Schnittger L,et al. Phylogenetic position of small-ruminant infecting piroplasms[J]. Annals of the New York Academy of Sciences,2006,1081(1):498-504.
[10]Yin H,Schnittger L,Luo J X,et al. Ovine theileriosis in China:a new look at an old story[J]. Parasitology Research,2007,101(Suppl 2):S191-S195.
[11]苟惠天,薛慧文,殷 宏,等. 基于COⅠ基因序列对我国泰勒虫分类的研究[J]. 中国预防兽医学报,2016,38(8):661-663
[12]田万年,薛书江,贾立军,等. 吉林省部分地区羊泰勒虫病流行病学调查及分类鉴定[J]. 中国兽医杂志,2017,53(10):13-16.
[13]钟 维,杜雪梅,郝力力,等. 四川省阿坝州牦牛和藏绵羊梨形虫分子流行病学调查[J]. 中国兽医杂志,2019,55(1):20-22,27.
[14]Ge Y,Pan W Q,Yin H. Prevalence of Theileria infections in goats and sheep in southeastern China[J]. Veterinary Parasitology,2012,186(3/4):466-469.
[15]王 颖,王 勇,孙 超,等. 白纹伊蚊Cytb基因特异性引物的设计及评价[J]. 中国国境卫生检疫杂志,2020,43(4):259-261.
[16]王 颖,方绍庆,曲德鑫,等. 蚊的Cytb基因特异性引物筛选[J]. 中国国境卫生检疫杂志,2019,42(2):105-107,110.
[17]Sun E T,Li C P,Nie L W,et al. The complete mitochondrial genome of the brown leg mite,Aleuroglyphus ovatus (Acari:Sarcoptiformes):evaluation of largest non-coding region and unique tRNAs[J]. Experimental and Applied Acarology,2014,64(2):141-157.
[18]Saito S,Tamura K,Aotsuka T.Replication origin of mitochondrial DNA in insects[J]. Genetics,2005,171(4):1695-1705.
[19]王天葆,楊红远,信爱国,等. 云南绵羊感染吕氏泰勒虫的鉴定及其遗传进化分析[J]. 上海畜牧兽医通讯,2020(3):13-16.
[20]王坤轮,周永春,赵姗姗,等. 陕西麟游县山羊吕氏泰勒虫感染调查及其遗传进化分析[J]. 动物医学进展,2020,41(4):123-126.
[21]Thompson J D,Gibson T J,Plewniak F,et al. The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research,1997,25(24):4876-4882.
[22]Burger T D,Shao R F,Beati L,et al. Phylogenetic analysis of ticks (Acari:Ixodida) using mitochondrial genomes and nuclear rRNA genes indicates that the genus Amblyomma is polyphyletic[J]. Molecular Phylogenetics and Evolution,2012,64(1):45-55.
[23]李中波,侯强红,尧国民,等. 四角赖利绦虫(Raillietina tetragona)ITS-1 rDNA序列的扩增及分析[J]. 经济动物学报,2020,24(2):107-110.
[24]Li Z B,Cheng T Y,Xu X L,et al. Genetic variation in mitochondrial genes of the tick Haemaphysalis flava collected from wild hedgehogs in China[J]. Experimental & Applied Acarology,2017,71(2):131-137.
[25]李有全,关贵全,马米玲,等. 两种羊泰勒虫的形态学观察和比较[J]. 中国寄生虫学与寄生虫病杂志,2009,27(2):184-186.
[26]孟林明,李有全,何海宁,等. 甘肃河西四地市羊泰勒虫病的流行病学调查[J]. 中国兽医科学,2012,42(11):1195-1199.
[27]Yi J N,Jin Y C,Liu J H,et al. Genetic variation in three mitochondrial genes among cattle tick Rhipicephalus microplus originating from four provinces of China[J]. Trop Biomed,2019,36(1):297-303.
[28]Blouin M S.Molecular prospecting for cryptic species of Nematodes:mitochondrial DNA versus internal transcribed spacer[J]. International Journal for Parasitology,2002,32(5):527-531.
[29]Yuan M L,Wei D D,Wang B J,et al. The complete mitochondrial genome of the Citrus red mite Panonychus citri (Acari:Tetranychidae):high genome rearrangement and extremely truncated tRNAs[J]. BMC Genomics,2010,11:597.
[30]Ball S L,Armstrong K F. DNA barcodes for insect pest identification:a test case with tussock moths (Lepidoptera:Lymantriidae)[J]. Canadian Journal of Forest Research,2006,36(2):337-350.71B92BC9-5A5F-449D-8132-6887D5119BAA
