血清Gli1 和VEGF 水平与前列腺癌转移的相关性研究
2022-06-08熊永高彭丽红张勇科李林株
熊永高 彭丽红 张勇科 李林株
广东医科大学附属佛山高明医院,广东 佛山 528500
研究表明,超过80%的前列腺癌患者伴有转移[1]。前列腺癌患者是否发生转移,对治疗方案的选择和患者五年生存率均至关重要。长期以来,研究者对癌症转移的预测因子关注较多。研究表明,胃癌根治术后预后不良组的患者血清胶质瘤相关癌基因1(glioma-associated oncogene 1,Gli1)水平高于预后良好组,其水平高低对预测胃癌术后复发和远处转移具有重要参考价值[2];前列腺癌转移患者血清血管内皮生长因子(vascular endothelial growth factor,VEGF)升高,其水平可作为总生存率的独立预测因子[3]。研究证实,与肿瘤转移密切相关的Hh-Gli1 信号通路中,Gli1 靶基因研究涉及与血管生成相关的VEGF[4-6]。基于上述研究,本研究通过检测前列腺癌患者血清Gli1 和VEGF 水平,分别比较低Gli1 组和高Gli1 组、低VEGF 组和高VEGF 组患者的病理特征分布差异,比较转移和未转移患者两个指标差异,并探讨两个指标与前列腺癌转移可能存在的相关性,利用ROC 曲线评估二者对前列腺癌转移的诊断价值,为诊断前列腺癌转移提供更多有价值的检测指标。
1 资料与方法
1.1 一般资料 取2015 年1 月至2020 年12 月于我院确诊为前列腺癌的患者174 例,年龄55~75 岁,平均(65.21±8.32)岁,Gleason 评分<8 分100 例,≥8 分74 例;临床T 分期,T1/T2 期共94 例,T3/T4 期共80 例。按照有无转移分组,转移组70 例,年龄55~75 岁,平均(66.14±8.41)岁;未转移组104 例,年龄55~75 岁,平均(65.01±8.22)岁,两组年龄比较无统计学差异(P>0.05)。
1.2 入选标准 纳入标准:①年龄55~75 岁;②所有患者均经直肠超声引导下行前列腺穿刺活检,一部分初次病理诊断为原发性局限性前列腺癌,另一部分患者初次确诊为转移性前列腺癌,可通过全身骨扫描以及X 线、CT 和MRI 检查明确诊断[7],且在本次确诊前从未采取任何手术和药物治疗;③所有患者的临床病理资料完整,包括Gleason 评分、临床T 分期和转移情况;④依从性较好,患者愿意配合抽血检测;⑤愿意签署知情同意书。排除标准:①合并有其他肿瘤病史者;②有前列腺手术史者;③合并有严重心肺肾功能障碍者。
1.3 检测方法 所有患者抽取空腹肘静脉血5mL,置于抗凝管中,离心取上清液于-80℃保存,分批检测。采用ELISA 法,检测血清Gli1 水平采用双抗体夹心法,试剂盒购自北京中衫金桥生物技术有限公司,检测血清VEGF 水平采用双单抗夹心法,试剂盒购自上海瑶韵生物科技有限公司,均严格按照操作说明书操作。
1.4 观察指标 收集所有患者的临床病理资料,检测所有患者血清Gli1 和VEGF 水平,分析上述两个指标与临床病理特征的相关性,根据血清Gli1 水平的中位数(8.35ng/mL),将前列腺癌组分为低Gli1 组(<8.35ng/mL)和高Gli1 组(≥8.35ng/mL),根据血清VEGF 水平的中位数(159.30ng/mL),将前列腺癌组分为低VEGF 组(<159.30ng/mL)和高VEGF 组(≥159.30ng/mL)。比较前列腺癌转移和未转移患者血清Gli1 和VEGF 水平差异,分析前列腺癌患者血清Gli1 和VEGF 水平的相关性,分析二者是否是前列腺癌转移的危险因素,采用ROC 曲线评估血清Gli1 和VEGF 水平以及联合诊断对前列腺癌转移的诊断价值。
1.5 统计学分析 采用SPSS 24.0 进行统计分析。计量资料采用t 检验,计数资料采用χ2检验,相关性分析采用Pearson 相关分析,采用二元多因素Logistic 回归分析血清Gli1 和VEGF 水平是否是前列腺癌转移的独立危险因素,采用ROC 曲线评估血清Gli1 和VEGF水平以及联合检测对前列腺癌转移的诊断价值。
2 结果
2.1 血清Gli1 和VEGF 水平与前列腺癌患者病理特征分布差异 高Gli1 组的Gleason 分级≥8 分、T3/T4 期、前列腺癌已转移的比例显著高于低Gli1 组,高VEGF 组上述指标比例显著高于低VEGF 组(均P<0.05)。见表1。
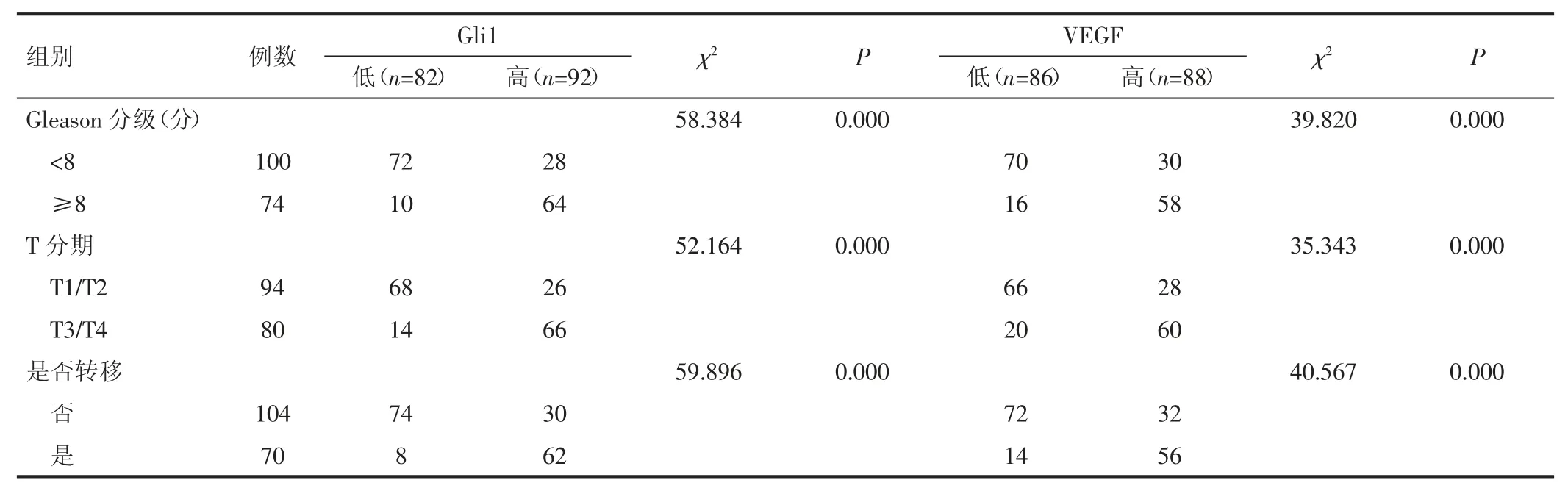
表1 血清Gli1 和VEGF 水平与前列腺癌患者病理特征分布差异(例)
2.2 两组血清Gli1 和VEGF 水平比较 前列腺癌转移组血清Gli1 和VEGF 水平均高于未转移组,差异有统计学意义(P<0.05)。见表2。
表2 两组血清Gli1 和VEGF 水平比较(ng/mL,±s)
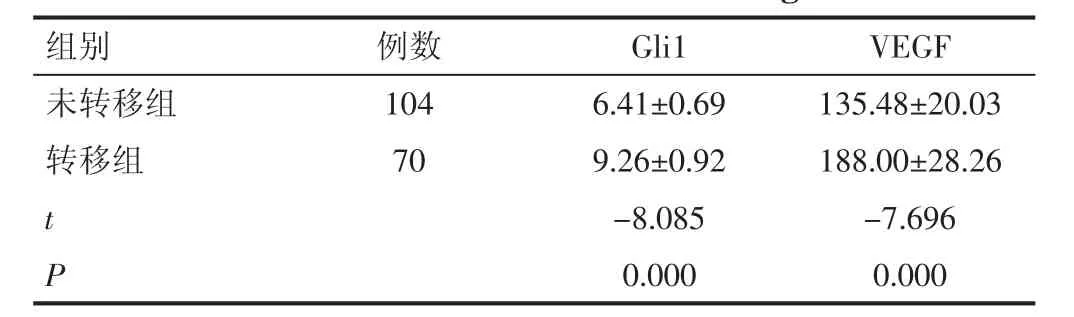
表2 两组血清Gli1 和VEGF 水平比较(ng/mL,±s)
组别 例数 Gli1 VEGF未转移组 104 6.41±0.69 135.48±20.03转移组 70 9.26±0.92 188.00±28.26 t-8.085 -7.696 P 0.000 0.000
2.3 前列腺癌患者血清Gli1 和VEGF 水平的相关性前列腺癌患者血清Gli1 和VEGF 水平呈显著正相关(r=0.811,P=0.000)。
2.4 危险因素分析 以血清Gli1 和VEGF 水平作为自变量,以前列腺癌是否转移作为因变量,进行二元多因素Logistic 回归分析,结果显示血清Gli1 和VEGF水平是前列腺癌是否转移的独立危险因素(OR=1.011,P=0.036;OR=1.931,P=0.001)。
2.5 血清Gli1 和VEGF 水平以及联合检测对前列腺癌转移的诊断价值 ROC 曲线分析结果显示,血清Gli1 和VEGF 水平诊断前列腺癌转移的临界值(cut-off值)分别为8.26ng/mL 和179.45ng/mL,灵敏度分别为100%和60.0%,特异度分别为61.5%和100%,曲线下面积(AUC)分别为0.898、0.879,二者联合检测的AUC 为0.932,灵敏度和特异度分别为88.6%和84.6%。见图1。

图1 血清Gli1 和VEGF 水平对前列腺癌转移的ROC曲线分析
3 讨论
近年来,我国前列腺癌发病率逐年上升,前列腺癌转移患者亦逐年升高[8]。前列腺癌转移包括前列腺癌原发病灶具有转移特征,突破基底膜内渗入血管,经过血液转运,再外渗出血管,远处转移并逐渐生长形成转移瘤[7]。为了适应转移过程中不断变化的周围环境,细胞要有较高的可塑性,而细胞去分化过程,如上皮细胞-间充质细胞转化,可以促进肿瘤细胞从原位分离、迁移、重新分化或者进行间质-上皮细胞转变,最终定植于转移部位[8]。研究发现,Hh-Gli1 信号通路以及下游靶基因VEGF 可能参与前列腺癌转移[9]。Gli1 可以促进肿瘤细胞发生上皮细胞间质转化,促进肿瘤细胞侵袭、转移[10],Gli1 表达上调可促进前列腺癌细胞的增殖分化以及疾病发展进程[11],抑制Gli1 的表达可以降低肿瘤细胞的侵袭、转移能力[5]。VEGF 通过作用相应受体来调节和促进血管内皮细胞增殖、分化和新生血管生成[12],前列腺肿瘤细胞的生长、浸润、转移等生理学变化均依赖微血管为其供血[7]。研究表明,高表达的Gli1 与晚期原发肿瘤分期、阳性淋巴结转移、晚期临床分期显著相关,Gli1 阳性组微血管密度明显高于阴性组[13]。前列腺癌组织中VEGF 高表达,微血管密度显著增高,密度水平和血清VEGF 水平与肿瘤分级和病理分期密切相关[3,8]。
本研究结果显示,高Gli1 组的Gleason 分级≥8 分、T3/T4 期、前列腺癌已转移的比例显著高于低Gli1 组,高VEGF 组上述指标比例显著高于低VEGF 组,提示前列腺癌患者血清Gli1 和VEGF 水平越高,Gleason评分越高,T 分期越大,转移发生率越高。施雪松等[2]研究发现胃癌根治术后7 天,预后不良组的血清Gli1水平显著高于预后良好组,其水平高低是影响术后复发和转移的重要因素。Duque JL 等[3]研究发现,前列腺癌转移患者血清VEGF 浓度显著高于局限性前列腺癌患者和健康者,VEGF 浓度的高低可用于区分转移性和局限性前列腺癌。本研究结果发现前列腺癌转移患者血清Gli1 和VEGF 水平显著高于未转移者,与上述研究结论一致。
研究发现,Glil 可以促进VEGF 的表达从而提升肿瘤细胞的侵袭、转移能力[5],阻断Hh 通路后,Gli1和VEGF 基因mRNA 和蛋白水平显著下降[4],可抑制血管生成和肿瘤细胞侵袭。本研究结果显示,前列腺癌患者血清Gli1 和VEGF 水平呈显著正相关,二者水平的高低是前列腺癌是否转移的危险因素,说明VEGF很大可能是Gli1 的下游靶基因,通过激活Hh-Gli1 信号通路,增强Gli1 基因表达从而上调VEGF 的表达以促进血管生成和前列腺癌转移,二者是靶基因调节关系,亦提示血清Gli1 和VEGF 的高水平与前列腺癌转移存在显著相关性。谢喜等[14]研究结果亦显示前列腺癌转移患者血清VEGF 水平与骨转移的发生具有一定相关性。本研究进一步进行ROC 曲线分析,结果显示血清Gli1 和VEGF 联合检测诊断前列腺癌转移的诊断性能优于单独指标检测,提示联合检测血清Glil 和VEGF 水平对前列腺癌转移具有较好的诊断价值。
综上所述,血清Gli1 和VEGF 水平与前列腺癌转移存在相关性,二者联合检测对前列腺癌转移具有一定的诊断价值。目前国内有关血清Gli1 和VEGF 水平与前列腺癌转移的相关性研究报道较少,本研究样本量较少,需进行临床多中心大样本研究进一步验证。
