低剂量X线辐射损伤后IFN-γ分泌性T、NK细胞修复能力及熟地的保护作用
2022-06-10陈祥静孔令婉申加兴郭钰琪姚成芳
张 珊,张 玥,陈祥静,王 悦,孔令婉,申加兴,王 丽,刘 承,郭钰琪,姚成芳
[1.山东第一医科大学(山东省医学科学院)基础医学院,山东 济南 250117;2.山东中医药大学,山东 济南 250399]
γ干扰素(interferon-γ,IFN-γ) 是调控天然免疫和获得性免疫的重要细胞因子,也是机体抗肿瘤、抗病毒免疫反应的主角,主要由T细胞(Th1、Tc1)、NK1、NKT1和I型固有淋巴样细胞等淋巴细胞分泌。其中,T、NK细胞分泌的IFN-γ可占IFN-γ总体水平的80%以上。天然免疫过程中,IFN-γ可促进巨噬细胞、NK细胞活化,并促进天然免疫细胞抗肿瘤、抗病毒免疫应答[1-2]。在获得性免疫反应过程中,IFN-γ可辅助B细胞产生抗体,加速Th1活化,促进Tc细胞激活和记忆T细胞增殖,增强抗肿瘤免疫的特异性和持久性[3-4]。此外,IFN-γ可提高肿瘤对放疗的敏感性[5]。因此,辐射损伤后IFN-γ分泌性T、NK淋巴细胞的修复能力,决定了辐射后机体抗肿瘤免疫反应的整体水平。
机体正常组织遭受低剂量辐射带来的免疫损伤是肿瘤放疗病人和从业人员面临的常见问题。特别是肿瘤病人,在肿瘤精准放疗时,正常组织也可遭受低剂量辐射。肿瘤组织局部IFN-γ分泌性淋巴细胞缺失,依赖正常组织中IFN-γ分泌性淋巴细胞的填充,辐射后正常组织IFN-γ分泌性淋巴细胞快速恢复对肿瘤组织抗肿瘤能力的重建至关重要。辐射(irradiation,IR)诱发淋巴细胞减少已成定论,然而,IFN-γ分泌性淋巴细胞不同亚群对低剂量辐射的敏感性和修复能力结论不一,且现有的研究数据有限。IFN-γ分泌性T、NK细胞主要由IL-12、IL-15等细胞因子激活或维持增殖[6],这些细胞因子可进一步激活T-bet、STAT4等转录信号[7]。尽管NKT细胞、活化巨噬细胞和B细胞等可产生少量IFN-γ,但占比较少。IFN-γ分泌性T、NK细胞是抗肿瘤免疫的主力军,即使在辐射条件下也在维持有效的抗肿瘤免疫功能中发挥关键作用[8]。明确这些细胞应对低剂量辐照的反应状态和修复能力,有助于有效地保护和重建机体抗肿瘤实力。
熟地(PreparedRadixRehmanniae,PRR)是经典的补阴中药。肿瘤患者放疗后多属虚证,对于肿瘤放疗后的虚证患者,熟地配伍应用可对抗骨髓抑制反应[9]。现代研究发现,熟地能够促进小鼠的淋巴细胞增殖,增强免疫反应[10]。以熟地为主要成分的中药复方可以提高淋巴细胞数量,但熟地对辐射后IFN-γ分泌性T、NK细胞的作用尚不清楚。本研究利用小鼠单次低剂量(2.5Gy)全身照射模型,分析Th1、Tc1和NK1细胞比例和数量变化,检测这些细胞IL-12R、IL-15R等细胞因子受体的表达变化,探讨熟地对这些细胞应对辐射损伤的保护作用和药效机制。通过辐照小鼠肿瘤模型,我们发现辐射造成IFN-γ分泌性T、NK细胞减少,可增加肿瘤转移风险;而熟地的治疗可有效促进辐射后IFN-γ 分泌性T、NK细胞比例和数量,减少肿瘤转移风险,这一结果为改善放射治疗后IFN-γ+细胞重建提供新的思路。
1 材料与方法
1.1 材料
1.1.1实验动物 SPF级♀ C57BL/6小鼠(SYXK鲁20180007,SCXK20190003),6~7周龄,体质量(20±2)g,购买于济南朋悦实验动物繁育中心。适应性喂养1周,自由饮水,昼夜交替光照,温度维持在(20~25)℃,相对湿度45%~55%。
1.1.2实验试剂与仪器 佛波酯(phorbol myristate acetate,PMA,货号:16561-29-8) 、离子霉素(ionomycin,货号:56092-81-0)、Dispase酶Ⅱ(货号:42613-33-2)均购自Sigma 公司,蛋白转运抑制剂(美国Thermo公司,货号:2330518),流式抗体CD3-BV421(货号:562600)、CD8-V500(货号:560778)、NK1.1-PerCP-cy5.5(货号:551114)、CD212-PE(货号:551974)、IFN-γ-APC(货号:562018)均购自美国BD公司,CD4-APC-cy7(美国eBioscience公司,货号:A15384),CD215-Alexa Flour 488(美国R&D system公司,货号:FAB5511G),PRR(购于山东省建联中药股份有限公司,产地,河北),乙二胺四乙酸(EDTA)(北京索莱宝科技有限公司,货号:E1170),胶原酶D(瑞士Roche公司,货号:11088858001),新生胎牛血清(美国Gibco公司,货号:16010159)和RPMI 1640培养基(美国Gibco公司,货号:2286515),破膜液(美国BD公司,货号:554714),TRIzol(美国Invitrogen公司,货号:15596018),RevertAid逆转录酶(美国Thermo公司,货号:EP0442),RNA酶抑制剂(碧云天公司,货号:R0102-2kU),脱氧核糖核苷(dNTP)(北京康为世纪公司,货号:CW0941),SYBR Green master(ROX)(美国Bio-Rad公司,货号:1725124),PCR扩增仪(德国Whatman Biometra公司),FACSAria III流式细胞仪(美国BD公司),荧光定量PCR仪(瑞士Roche公司),RS2000 Pro225生物学X射线辐照仪(美国,Rad Source)。
1.2 方法
1.2.1熟地的提取及含量测定 称取中药熟地200 g,按中国药典方法进行水提、醇沉,生药提取率为2 kg·L-1(地黄苷D含量为2.64 g·L-1)。
1.2.2X线辐照 使用RS2000 Pro225生物学X射线辐照仪,对小鼠进行全身照射,总照射剂量2.5Gy(剂量率,1.3 Gy/min),辐照距离为170 mm。
1.2.3动物模型构建、分组处理方法 C57BL/6小鼠60只,分为正常对照组、辐照模型组、辐照PRR治疗组、肿瘤辐照PRR治疗组、肿瘤模型组和辐照后肿瘤模型组等6组,自由饮水、摄食1周后,除正常组小鼠外,其余各组小鼠均给予X线辐照;肿瘤辐照+PRR治疗组、肿瘤模型组和辐照后肿瘤模型组小鼠尾静脉注射B16黑色素瘤细胞(2×105),建立对照肿瘤模型和辐照后肿瘤模型;PRR给药剂量经预实验(10、20、40 g·kg-1)处理后,基于IFN-γ表达水平的变化,选择疗效最佳浓度20 g·kg-1(结果未展示)。辐照PRR治疗组和肿瘤辐照PRR治疗组小鼠进行PRR灌胃治疗(20 g·kg-1),连续灌胃8 d,至实验前12 h。实验前小鼠禁食12 h,自由饮水。
1.2.4流式细胞术检测IFN-γ分泌性T、NK细胞 在辐照后d 2、4、8,分别处理5只辐照小鼠和5只对照小鼠;肿瘤模型小鼠在造模后d 8处理。取小鼠脾脏,制备单细胞悬液,将淋巴细胞按照每孔2×106个细胞接种于24孔板,加入PMA (30 μg·L-1)、离子霉素(1 mg·L-1)和蛋白转运抑制剂(1 mL·L-1),置37 ℃、5%CO2刺激培养5 h后,收集细胞,1×PBS洗2遍,Fc Block阻断非特异性结合后,再次洗涤,加入外标抗体(CD3-BV421、CD4-APC-cy7、CD8-V500、NK1.1-PerCP-cy5.5、CD212-PE、CD215-Alexa Flour 488),4 ℃避光孵育1 h。PBS洗涤后加入破膜液破膜40 min,再次洗涤后加入内标抗体(IFN-γ-APC)4 ℃避光孵育1 h,洗涤后,上机检测。
1.2.5RT-qPCR检测细胞因子IL-12、IL-15及转录因子T-bet、STAT4的mRNA水平 分离小鼠脾脏淋巴细胞,制备单细胞悬液,1×PBS洗2遍后,加入TRIzol,提取总RNA,紫外分光光度计检测RNA浓度和纯度。将RNA反转录合成cDNA,进行实时荧光定量PCR。RT反应条件:总反应体系30 μL,2 μg总RNA,以oligo dT为RT反应引物,70 ℃,5 min;5×RT buffer 6 μL、dNTP 3 μL、RNA酶抑制1.5 μL、RevertAid逆转录酶1.5 μL,42 ℃,60 min。RT-qPCR反应体系为:总反应体系20 μL,包括cDNA 1 μL,无RNase水7 μL,上下游引物各1 μL,SYBR®Green master(ROX)10 μL,反应条件为:94 ℃,10 min;95 ℃,10 s;60 ℃,40 s;72 ℃,5 min;40个循环,以GAPDH为内参,采用2-ΔΔCt计算基因相对表达量。引物序列见Tab 1。

Tab 1 Sequence of PCR primer

2 结果
2.1 X线辐照后不同时间点T、NK等淋巴细胞的修复状态与对照组相比,辐照后d 2,脾脏总淋巴细胞数量和T淋巴细胞亚群CD3+CD4+(Th)、CD3+CD8+(Tc)细胞数量和比例明显下降(P<0.05,P<0.01),从d 4开始逐渐恢复,到d 8恢复到基础水平。而NK细胞比例在d 2明显增加(P<0.01),但其细胞数量下降(P<0.05),d 4细胞比例和数量均恢复到基础水平。结果显示T淋巴细胞对辐照损伤更为敏感(Tab 2)。

Tab 2 Difference in number and proportion of splenic lymphocyte subsets at different time after irradiation in mice
2.2 X线辐照后IFN-γ分泌性T、NK细胞的免疫修复能力差异T细胞和NK细胞是IFN-γ的主要生成细胞。流式细胞术分析IFN-γ+Th(Th1)、Tc(Tc1)、NK(NK1)细胞在辐照损伤后的修复情况,发现辐照后d 2,小鼠脾脏中IFN-γ+细胞(Fig 1B,P<0.01)和Th1、Tc1、NK1细胞比例和数量均下降(Fig 1C,P<0.05,P<0.01)。Tc1和NK1细胞在辐照后d 4逐渐恢复,其中Tc1到d 8恢复到正常水平,NK1细胞的比例和数量则在d 8高于对照组(Fig 1C,P<0.05,P<0.01);而Th1细胞在辐照后4~8 d细胞比例和数量仍然低于对照组(Fig 1C,P<0.01,P<0.05)。结果表明:Th1细胞较Tc1和NK1细胞对辐照的敏感性更强,免疫修复能力较弱。

Fig 1 Proliferation of IFN-γ-secreting Th1,Tc1 and NK1 cells measured by flow cytometry in spleen after X-ray
2.3 X线辐照后IL-12和IL-15及其受体和转录因子的变化特点IL-12和IL-15是调控IFN-γ分泌性T、NK细胞增殖分化的重要细胞因子。RT-qPCR结果显示,辐照后,IL-12和IL-15mRNA水平呈现动态性变化特点。在辐照后d 2,IL-12和IL-15 mRNA的表达量明显升高(Fig 2A,P<0.01),而在4 d后的恢复阶段逐渐降低。IFN-γ特异性转录因子T-bet和STAT4 mRNA的表达水平在辐照后降低(Fig 2A,P<0.05,P<0.01)。流式结果显示,辐照后,Th1细胞IL-12R(CD212)和IL-15R(CD215)等细胞因子受体表达水平明显低于基础水平;而Tc1和NK1细胞在辐照后d 4~8修复期,明显高于基础水平(Fig 2B,P<0.05,P<0.01)。结果表明:辐照后,微环境中IL-12、IL-15表达水平下降和Th1细胞IL-12R、IL-15R的低表达状态,使Th1对细胞因子的利用能力明显下降,阻碍Th1的快速修复。

Fig 2 Cytokine,receptor and specific transcription factors related to IFN-γ producing T and NK cells after X-ray
2.4 中药PRR调节IFN-γ分泌性T、NK细胞辐照后免疫重建作用与辐照模型相比,PRR处理组小鼠IFN-γ+细胞比例和数量明显增多,IFN-γ分泌性Th1、Tc1和NK1的细胞比例和数量也明显增加(Fig 3A,P<0.05,P<0.01),表明PRR能够有效促进辐照后IFN-γ分泌性Th1、Tc1和NK1细胞的增殖。与B16黑色素瘤肺癌小鼠相比,辐照小鼠的肺肿瘤克隆数明显增多(Fig 3B,P<0.01),而经过PRR处理的辐照小鼠肺肿瘤克隆数明显减少(Fig 3B,P<0.05)。结果表明:PRR可有效促进辐照后IFN-γ分泌性T、NK细胞的免疫重建。
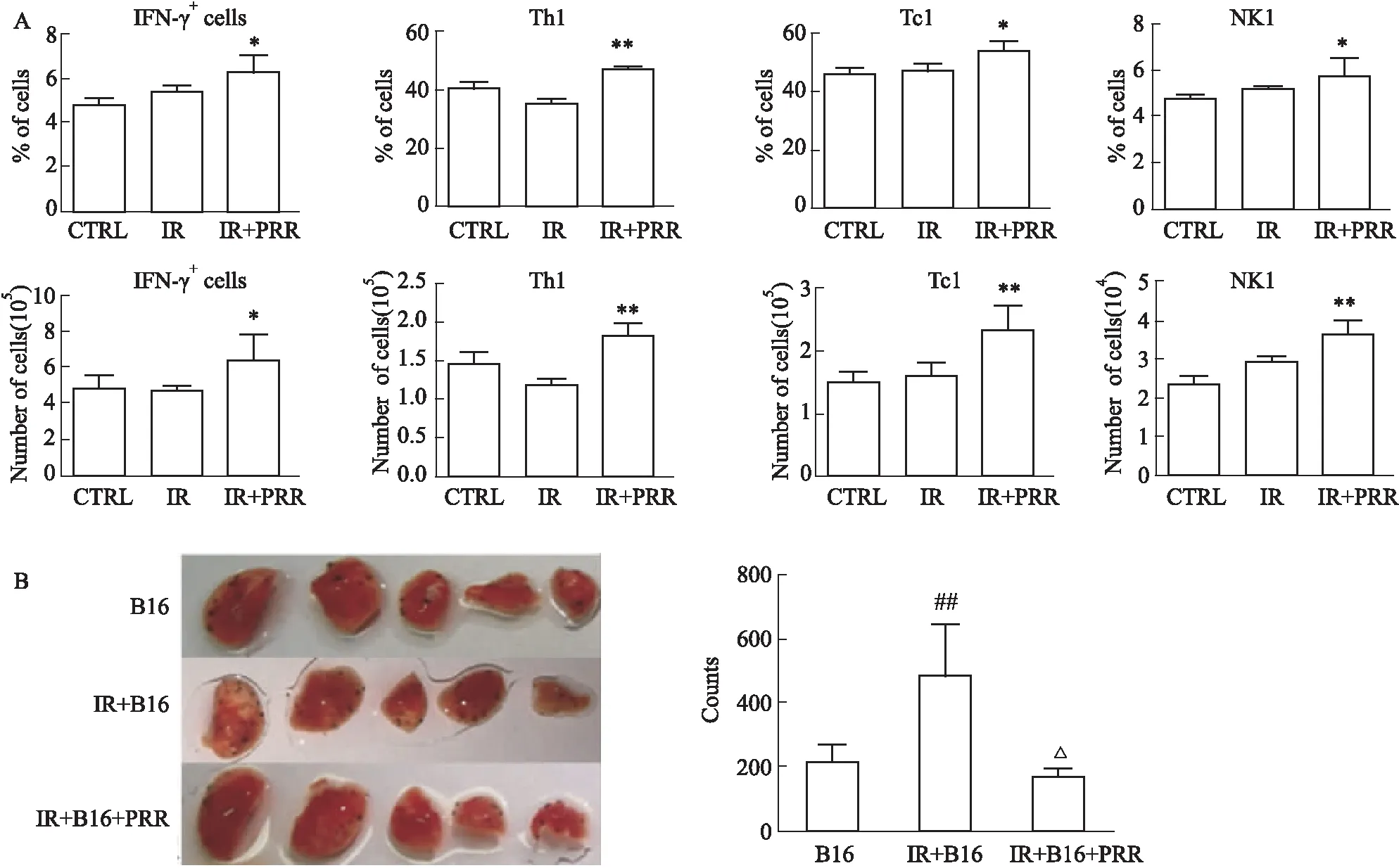
Fig 3 Effects of PRR on IFN-γ-secreting T and NK cells in irradiated and B16 melanoma metastatic mice
3 讨论
T细胞和NK细胞分别是获得性免疫和天然免疫的重要细胞群,也是机体抗癌免疫的主体细胞,特别是IFN-γ分泌性T细胞和NK细胞,发挥着重要的抗肿瘤作用[11-12]。辐射后,T细胞和NK细胞IFN-γ的分泌能力直接影响抗肿瘤免疫功能。正常组织中分布着大量的淋巴细胞,这些细胞对辐射损伤的反应状态和修复能力,决定了机体的整体免疫功能,同时也影响正常组织免疫细胞对病变组织的补充和调控能力。我们发现,淋巴细胞对辐照损伤表现出极强的敏感性(Tab 1)。虽然,辐射损伤后d 8,淋巴细胞总数恢复到正常水平,但IFN-γ+T细胞亚群和NK细胞辐射损伤后的修复能力明显不同。在IFN-γ+细胞中,T细胞对辐射损伤更为敏感;与Tc1和NK1细胞相比,Th1细胞在辐照损伤后恢复能力较低,这一现象虽然与Th1活化的第一信号(TCR-MHC-Ⅱ)和第二信号(CD80/86)等有关,但细胞因子第三信号(IL-12,IL-15)也起到了关键作用。Tc1与NK1高表达IL-12R和IL-15R,特别是在辐射损伤修复阶段(4~8 d),是Th1的3~7倍(Fig 2B),使Tc1与NK1可优势利用环境中低转录水平的IL-12和IL-15,而Th1缺少这一优势,不能充分利用辐射后有限的细胞因子资源,导致修复能力低下。这一结果,使机体抗肿瘤免疫反应缺少了特异性和长效性,辐射后肺转移克隆数的明显升高(Fig 3B),为这一结果提供了有力证据。Tc1与NK1在修复期的相对优势,并不能逆转肿瘤肺转移的升高,从另一方面证明了Th1抗肿瘤特异性免疫的重要性。有关中药抗辐射研究报道较少,虽有研究显示中药川芎提取物对辐射损伤的保护作用,也只是观察该提取物对γ射线损伤的小鼠可能通过上调Bcl-2蛋白,下调p53蛋白的表达起到辐射保护作用,没有针对IFN-γ+细胞的相关研究结果[13]。我们之前的研究也发现肉桂可以提高辐照后IFNγ的分泌,上调Th1,修复辐射损伤后Th1、Th2、Treg和Th17等T细胞亚群的平衡,与熟地作用相似,可以减少辐射后B16黑色素瘤的肺脏转移[12],但熟地作用更强(结果未展示)。本研究进一步发现,熟地在增强辐射后Th1修复能力的同时,也可上调Tc1和NK1对IFN-γ的分泌能力,全面提高机体抗肿瘤的天然免疫和获得性免疫的能力,明显减少辐射后的肺转移克隆形成,进一步证实了辐射后IFN-γ分泌性T、NK细胞修复能力的重要性。
越来越多的证据表明,Th2、Treg和Th17等T细胞亚群在共同的环境刺激下表现出不同的特征,包括凋亡、增殖和执行特定生物学功能[14-15]。T细胞亚群之间的竞争进一步削弱了Th1细胞的早期发育。有报道发现,辐射后增加的Treg和Th17亚群,也限制Th1的恢复,破坏T细胞亚群的稳态[16-17]。也是机体抗肿瘤能力下降的重要原因。这些研究与我们的研究结果一致,强调了辐射后Th1在抗肿瘤特异性免疫中的关键作用。
中医药在生命健康保障中做出了巨大贡献,积累了丰富的临床实践经验。在辐射损伤中,补益类中药得到了广泛应用,多用于淋巴细胞辐射性损伤后的快速修复[18]。熟地是经典的滋补肾阴类药物,常与其他药物配伍,用于辐射后免疫修复。本研究结果证明,促进IFN-γ分泌性T和NK辐射后的快速修复、提高是熟地发挥药效的重要免疫药理基础。但其药效物质基础和中药药效靶点,还有待进一步研究。
