环孢素与伏立康唑联用致血液系统疾病患者肝损伤的相关性研究
2022-06-08倪斌方春云高畅郭春钰
倪斌,方春云,高畅,郭春钰
赣南医学院第一附属医院,江西 赣州 341000
环孢素(cyclosporine A,CsA)能特异性地抑制辅助T 淋巴细胞的活性,恢复骨髓造血功能,并可免疫刺激促进生长因子合成释放,加速造血干细胞增殖[1-2],目前已成为自身免疫性溶血性贫血、再生障碍性贫血、血小板减少性紫癜及造血干细胞移植患者的常用药。伏立康唑(voriconazole,VRZ)作为第二代三唑类抗真菌药物,其特点是抗真菌谱广、生物利用度高、安全且可通过血脑屏障等,目前已成为血液系统疾病的首选药物[3],故临床常将环孢素与伏立康唑联合应用于血液系统疾病。
CsA 治疗窗较窄,同时免疫抑制的效果和不良反应都呈量效依赖型,剂量过大、应用时间过长有可逆性肝肾损伤[4]。CsA 是CYP3A4 和CYP3A5 的底物,VRZ 通过细胞色素P450 同工酶代谢,并抑制细胞色素P450 同工酶的活性,包括CYP2C19、CYP2C9 和CYP3A4,因此CsA 与VRZ 联用,导致CsA 血药浓度的升高,增加患者发生肝损伤的可能性。本文通过回顾性分析血液系统疾病患者联合使用CsA 与VRZ 所致肝损伤的临床特点及危险因素,探讨CsA 与VRZ 联合治疗与肝损伤之间的相关性研究,以期为临床合理用药提供依据。
1 资料与方法
1.1 资料来源
通过信息系统提取赣南医学院第一附属医院(以下简称我院)2019 年1 月至2021 年6 月联合使用CsA 与VRZ 治疗血液系统疾病患者病历,对药物性肝损伤进行回顾性分析研究。
1.2 研究方法
对入选病历逐一进行查阅和分析,根据国际医学组织理事会(CIOMS)进行临床分型,按照我国药物性肝损伤指南进行严重程度分级,对发生药物性肝损伤的患者的相关危险因素进行分析。
1.2.1 病例排除标准有如下因素之一者排除:(1)联合使用CsA 与VRZ 前无肝功能检查值;(2)联合使用CsA 与VRZ 前肝功能指标丙氨酸转氨酶(Alanine aminotransferase,ALT)、碱性磷酸酶(Alkaline phosphatase,ALP)、总胆红素(total bilirubin,TBIL)等高于正常值上限;(3)入院诊断已有肝损伤的相关诊断,如肝功能不全、肝硬化等;(4)合并其他易致肝功能损伤的药物。
1.2.2 药物性肝损伤病例纳入标准在住院期间联合使用CsA 与VRZ 前肝功能正常的患者,用药后ALT≥3 倍正常值上限(upperlimit of normal,ULN)和(或)ALP≥2 ULN[5]。ALT 正常参考范围(9~50)U/L,ALP 正常参考范围(45~125)U/L。
1.2.3 药物性肝损伤分型及严重程度分级按照CIOMS的判断标准分为[6]:(1)肝细胞损伤型:ALT≥3 ULN,且R≥5;(2)胆汁淤积型:ALP≥2 ULN,且R≤2;(3)混合型:ALT≥3 ULN,ALP≥2 ULN,且2<R<5。R=(ALT实测值/ALT ULN)/(ALP实测值/ALP ULN)。严重程度分级按照我国药物性肝损伤指南由轻到重分为0~5 级[5],其中轻度、中度和重度肝损伤诊断标准如下:1 级(轻度肝损伤):血清ALT 和/或ALP 呈可恢复性升高,TBIL<2.5 ULN,且凝血酶原时间国际标准化比率(international normalized ratio,INR)<1.5,多数患者可适应,可能有乏力、虚弱、恶心、厌食、右上腹痛、黄疸、瘙痒、皮疹或体质量减轻等症状。2 级(中度肝损伤):血清ALT 和/或ALP 升高,TBIL≥2.5 ULN,或虽无TBIL 升高但INR≥1.5,上述症状可有加重。3 级(重度肝损伤):血清ALT 和/或ALP 升高,TBIL≥5 ULN,伴或不伴INR≥1.5,患者症状进一步加重,需要住院治疗,或住院时间延长。
1.2.4 用药方案和血药浓度监测选取CsA 软胶囊(北京双鹭药业股份有限公司,国药准字H20093398,规格:50 mg)与VRZ 治疗血液系统疾病患者病历,对药物性肝损伤进行回顾性分析研究。其中VRZ 包含注射用伏立康唑(晋城海斯制药有限公司,国药准字H20058963,规格:0.2 g);伏立康唑胶囊(四川美大康华康药业有限公司,国药准字:H20080787,规格:50 mg)。注射用VRZ和VRZ 口服剂型均按照药品说明书治疗方案进行给药(静脉滴注:第1 个24 h 6 mg/kg,每12 h 1 次,24 h 后4 mg/kg,每12 h 1 次;口服或鼻饲:第1 个24 h 400 mg,每12 h 1 次,24 h 后200 mg,每12 h 1 次,其中体质量小于40 kg 的患者负荷剂量和维持剂量均减半);CsA 软胶囊初始给药剂量为(3~6)mg·kg-1·d-1,患者结合治疗反应、肝功能变化及血药浓度结果进行剂量调整。根据药品说明书,已接受CsA 治疗患者开始应用VRZ 时,CsA 软胶囊给药剂量减半,并监测CsA 的血药浓度。在联合用药3~5 d 达到稳态血药浓度及怀疑药物浓度异常波动时监测CsA 的血药谷浓度及肝功能。
发生药物性肝损伤时,出现以下情况之一考虑停用肝损伤药物:(1)血清ALT 或AST>8 ULN;(2)ALT 或AST>5 ULN,持续2 周;(3)ALT 或AST>3 ULN,且TBil>2 ULN 或INR>1.5;(4)ALT 或AST>3 ULN,伴逐渐加重的疲劳、恶心、呕吐、右上腹疼痛或压痛、发热、皮疹和/或嗜酸性粒细胞增多(>5%)[7]。
1.3 统计学方法
采用Excel 软件对数据进行收集整理,采用SPSS 19.0 软件进行分析。符合正态分布的计量资料采用表示,非正态分布采用中位数及上下四分位数M(Q1,Q3)表示;组间比较采用t检验或单因素方差分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 一般资料
共21 例患者联合使用CsA 与VRZ 治疗,按照排除标准排除7 例,实际纳入研究病例14 例(注射用伏立康唑7 例,伏立康唑胶囊7 例)。14 例患者均无饮酒史及乙肝病史,具体信息见表1。
表1 纳入研究病例患者特征()

表1 纳入研究病例患者特征()
2.2 肝损伤发生情况
病例分析结果显示联合使用CsA 与VRZ 相关肝损伤6 例,发生率为42.9%(6/14)。按照国际医学组织理事会(CIOMS)的判断标准进行计算,结果显示4 例为肝细胞损伤型肝损伤,2 例为胆汁淤积型肝损伤;严重程度分级评估结果显示中度肝损伤2 例,轻度肝损伤4 例,其中2 例出现乏力、食欲减退、厌油等消化道症状。6 例病例中有4 例总胆汁酸含量显著升高。详细结果见表2。
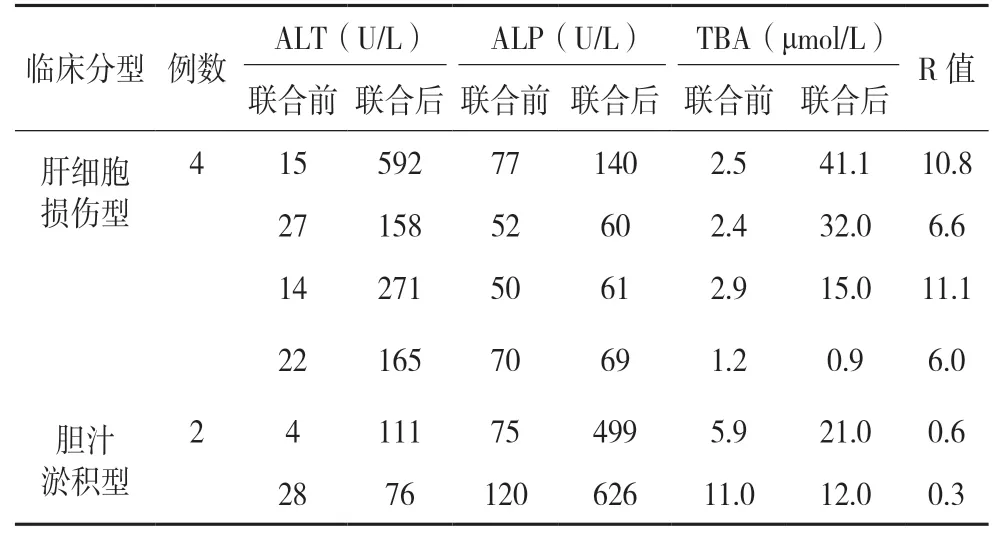
表2 联合使用CsA、伏立康唑相关肝损伤的临床分型及其肝功能指标比较
2.3 肝损伤发生时间及转归
6 例患者联合使用CsA 与VRZ 后最早3 d 发生肝损伤,最迟12 d,肝损伤发生时间中位数4 d,其中使用3 d 发生肝损伤3 例。在住院期间,4 例肝细胞损伤型患者中3 例经过处理后恢复正常,平均处理周期(11±1)d,其处理措施分别为1 例继续联合使用(CsA 调整给药剂量)并给予护肝药物治疗;1 例停用CsA 并给予护肝药物治疗;1 例停用VRZ并给予护肝药物治疗;1 例中度肝损伤肝细胞损伤型患者停用VRZ、调整CsA 给药剂量并给予护肝药物治疗后未恢复至正常。在住院期间,2 例胆汁淤积型肝损伤患者经过处理后转氨酶恢复正常,而ALP>2 ULN,其处理措施为1 例调整CsA 给药剂量并给予护肝药物治疗12 d 出院、1 例停用CsA。
2.4 CsA 稳态血药浓度谷浓度分布
14 例患者联合使用CsA 与VRZ 治疗时,根据药品说明书,接受CsA 治疗患者开始应用VRZ 时,CsA 软胶囊给药剂量减半[8]。14 例患者CsA 稳态谷浓度最低107.9 ng/mL,最高为1 473.6 ng/mL,中位数175.7 ng/mL,2 例CsA 稳态谷浓度>200 ng/mL;其中肝损伤阳性CsA 稳态谷浓度最低为163.1 ng/mL,最高为1 473.6 ng/mL,中位数193.4 ng/mL,除1 例浓度异常升高至1 473.6 ng/mL,浓度集中于100~200 ng/mL;CsA 联合VRZ 治疗患者中肝损伤阴性CsA 稳态谷浓度最低为107.9 ng/mL,最高为420.4 ng/mL,谷浓度中位数151.9 ng/mL,除1 例浓度异常升高至420.4 ng/mL,浓度集中于100~200 ng/mL 之间。排除2 例CsA 谷浓度异常升高,阳性组与阴性组CsA 稳态谷浓度差异有统计学意义(P=0.008),详见表3。

表3 患者肝功能与CsA血药谷浓度的变化
3 讨论
3.1 相关肝损伤结果分析
本研究结果显示CsA 联合VRZ 有关肝损伤发生率42.9%,高于CsA、VRZ 药品说明书和相关文献中肝损伤发生率[9-10],其原因可能是CsA 与VRZ 联用导致CsA 血药浓度升高,增加患者发生不良反应的可能性[11]。本研究参照CIOMS 的临床分型、严重程度标准进行研究,诊断和分型标准更加规范,对CsA 联合VRZ 临床运用更具有参考意义。
本研究显示CsA 联合VRZ 有关肝损伤ALT、ALP 均有升高且以转氨酶升高为主。按照CIOMS 标准计算结果显示,肝损伤临床分型以肝细胞损伤型为主,多数伴有总胆汁酸升高,可能是由于CsA 与VRZ 均经肝细胞色素酶代谢而增加肝毒性相关[12]。CsA 引发肝细胞早期以线粒体粗面内质网、滑面内质网、细胞核的改变为主,肝细胞及毛细胆管内胆汁疲积,溶酶体及微体增多集中于细胞核周围[13]。本研究中患者肝损伤主要为轻中度为主,经过护肝药物治疗的患者肝功能多数能够恢复正常;若患者出现TBIL、ALP 显著升高,与仅ALT、AST 升高的肝损伤比,其恢复周期较长。
3.2 相关肝损伤发生时间
本研究显示,患者联合使用CsA 和VRZ 后发生肝损伤中位数4 d(3~12 d),且66.7%发生于联合用药5 d 之内,提示在联合用药期间特别是前5 d内需要加强ALT、ALP 及TBIL 等指标的监护,发生肝损伤后需要护肝治疗,根据肝损伤严重程度和发展趋势等决定继续使用或更换药物。
3.3 CsA、VRZ 相关肝损伤危险因素分析
既往研究中CsA 有关肝损伤的影响因素主要包括CYP3A5 基因多态性、CsA 血药峰浓度及CsA血药谷浓度等。何晓静,菅凌燕[14]的研究表明,CYP3A5 基因型多态性对CsA 血药浓度有显著影响,慢代谢性人群发生肝功能异常的比例显著增加。王欣晨、商玉萍[10]研究表明,CsA 的肝毒性与其血药浓度存在一定相关性,峰浓度值可能是更有价值的药物性肝损伤预测指标。
VRZ 有关肝损伤的影响因素主要包括CYP2C19基因多态性、低蛋白血症、炎症以及VRZ 血药谷浓度等。王百乔等[15]研究表明,CYP2C19 基因型多态性对VRZ 血药浓度有显著影响,慢代谢人群导致肝损伤风险增加。徐丙发等[16]研究表明,低蛋白血症患者降低伏立康唑血浆蛋白结合率,血清中游离药物浓度和不良反应发生率均显著升高。赵博欣等[17]研究表明,重度炎症(CRP≥100 mg/L)抑制伏立康唑代谢,增加稳态谷浓度,增加不良反应发生率。赵全凤等[9]伏立康唑所致肝损伤的主动监测研究亦表明,当伏立康唑谷浓度高于5 mg/L时肝损伤风险显著增加。
伏立康唑主要通过肝脏细胞色素P450 同工酶CYP2C19、CYP3A4 和CYP2C9 代谢,其中CYP2C19是其主要代谢途径,同时伏立康唑也是细胞色素CYP3A4 的强抑制剂,是CYP2C19、CYP2C9 的弱抑制剂[18],故伏立康唑可能通过抑制相关代谢酶,与经CYP3A4 和CYP3A5 代谢的环孢素发生相互作用。未调整环孢素给药剂量时,联合用药环孢素的药时曲线下面积是合用伏立康唑前的1.7 倍,血药峰浓度是合用前的1.13 倍[19]。Kikuchi 等[20]研究表明,环孢素的血药浓度/剂量比值的增加与伏立康唑血药浓度无相关性。环孢素联用伏立康唑时,使环孢素的血药浓度/剂量显著提高,导致肝酶升高的比例增加。本研究中患者接受环孢素与伏立康唑联合治疗时,当环孢素给药剂量减半,大部分患者环孢素血浆谷浓度处于指南推荐浓度范围(100~200 ng/mL)。肝损伤阳性患者与阴性患者比较,环孢素谷浓度显著升高,对肝损伤发生有显著影响。肝脏对血中氨基酸浓度相对稳定有重要作用,近30 种血浆蛋白是在肝细胞合成,特别是白蛋白,每天约合成12 g,占肝合成蛋白的25%,肝损伤使白蛋白合成减少,产生低蛋白血症。肝损伤阳性患者与阴性患者比较,血清白蛋白水平显著下降,对肝损伤发生有显著影响。提醒临床对联合使用环孢素与伏立康唑的患者需要密切监测肝功能指标、血清白蛋白水平和血药浓度。
本研究局限于回顾性研究,因患者例数少、未进行伏立康唑血药浓度和基因监测,对伏立康唑血药浓度、基因多态性未进行因素分析,可能对分析造成一定影响。
