齐墩果酸纳米结构脂质载体的制备与药效学评价
2022-06-08邢小燕果秋婷
邢小燕,董 舒,果秋婷
1.咸阳职业技术学院,咸阳 712000;2.咸阳市中心医院,咸阳 712000
齐墩果酸(oleanolic acid,OA)是从女贞子果实中提取分离得到的一种五环三萜类化合物,具有广谱抗菌活性[1],临床上已用于肺炎、急性扁桃体炎、牙周炎以及泌尿系统感染等疾病的治疗,近年来的研究发现齐墩果酸能够抑制血糖升高[2]。齐墩果酸在水中的溶解性较差,且是P-糖蛋白(P-gp)的底物,存在外排现象[3],其口服生物利用度较差。已有文献报道将齐墩果酸制成不同种类的药物递送系统以提高药物的溶解性,包括固体分散体[4]、纳米混悬剂[5]、脂质体[6]、环糊精包合物[7]以及纳米粒[8]等。纳米结构脂质载体(nanostructured lipid carriers,NLCs)为新一代脂质纳米给药系统,它是将生物相容性良好的固体脂质与液体脂质作为载体,将药物包裹在混合脂质中,以增加药物的溶解度和生物利用度[9]。聚乙二醇1 000维生素E琥珀酸酯(D-α-tocopherol polyethyleneglycol 1 000 succinate,TPGS)亲水/亲脂平衡(hydrophile lipophilic balance,HLB)值为13.2,具有一定的乳化和增溶作用[10],更重要的是,TPGS能够逆转P-糖蛋白(P-glycoprotein,P-gp)对药物的外排作用,可提高药物的生物利用度[11]。本研究将齐墩果酸制备成纳米结构脂质载体(OA-NLCs),同时在处方中加入TPGS对OA-NLCs进行修饰,并通过Caco-2细胞单层模型、药效学实验评价TPGS-OA-NLCs的药物吸收效果,为改善齐墩果酸的临床疗效提供一种有效的解决方案。
1 仪器与材料
1.1 仪器
DH92-IIN型超声波破碎仪(上海狄昊实业有限公司);JEOL JEM-2100型透射电子显微镜(日本电子株式会社);Zetasizer Nano ZS 90型激光粒度测定仪(英国Malvern公司);DF-101S型集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);LC-100型高效液相色谱系统(上海伍丰科学仪器有限公司)。
1.2 试药
齐墩果酸原料药(质量分数为90.5%,批号1900214,艾美捷科技有限公司);齐墩果酸对照品(质量分数为91.1%,批号110709-201808,中国食品药品检定研究院);山嵛酸甘油酯(compritol-888 ATO,德国巴斯夫公司);丙二醇单辛酸酯(capryol 90,嘉法狮上海贸易有限公司);泊洛沙姆188(德国巴斯夫公司);TPGS(杭州乐信康宁医药科技有限公司);乙醇(国药集团化学试剂有限公司)。
1.3 细胞
Caco-2细胞购自空军军医大学细胞中心。
1.4 动物
SD大鼠购自空军军医大学实验动物中心,合格证号2145801474,许可证号SX-2007-004。
2 方法与结果
2.1 OA-NLCs与TPGS-OA-NLCs的制备
本研究采用改进的热熔乳化-超声波法制备OA-NLCs[12]。制备工艺:①称取处方量的Compritol-888 ATO 1.0 g和Capryol 90 0.5 g,加入5 mL乙醇中,搅拌溶解,再加入齐墩果酸原料药0.2 g,搅拌溶解,得到透明状油性溶液,放入75 ℃水浴中保温;②称取泊洛沙姆188 0.4 g加入纯化水20 mL中,搅拌溶解,得到透明状水相溶液,将溶液平均分成2份,一份置于75 ℃水浴中保温,另一份置于冰水浴(0~5 ℃)中保存,备用;③维持75 ℃恒温水浴,将油相溶液滴入热的水相溶液中,高速磁力搅拌,并在50 ℃减压下用旋转蒸发仪除去乙醇;④将混合物加入冷的水相溶液中,持续磁力搅拌30 min,形成乳状液体;⑤将混合物加入超声玻璃管中,通过超声波细胞破碎仪超声处理,超声参数设置为超声5 s,间歇5 s,超声功率200 W,超声时间5 min;⑥超声结束后,迅速将其置于冰水浴中,充分冷却,得到外观呈淡蓝色透明状的OA-NLCs溶液。
TPGS-OA-NLCs与OA-NLCs的处方组成、辅料用量以及制备工艺参数完全相同,只是在步骤②中将TPGS 0.1 g溶解于冰水中,最终制备得外观呈淡蓝色透明状的TPGS-OA-NLCs溶液。将制备得到的OA-NLCs与TPGS-OA-NLCs置于4 ℃保存,备用。
2.2 OA-NLCs与TPGS-OA-NLCs性质的研究
2.2.1粒径、Zeta电位的测定 用马尔文动态激光粒度仪检测OA-NLCs和TPGS-OA-NLCs的粒径分布、多聚分散系数(polydispersity index,PDI)和Zeta电位。在分析之前,将样品放置在25 ℃下平衡2 min。每个样品平行测量3次,结果见表1。

表1 OA-NLCs与TPGS-OA-NLCs制剂性质的测定结果
经测定,与OA-NLCs的粒径相比,TPGS-OA-NLCs的粒径减小,这可能是由于TPGS是表面活性剂,在处方中可进一步降低体系的界面张力,容易形成更小粒径的纳米粒,但是处方中加入TPGS也使其包封率出现降低的趋势。Zeta电位的绝对值越大,体系的稳定性越好,研究表明,只有当Zeta电位的绝对值超过30 mV时,通过静电斥力才能有效避免纳米粒聚集[13],经测定OA-NLCs和TPGS-OA-NLCs的Zeta电位绝对值均大于30 mV,有利于提高纳米粒的物理稳定性。
2.2.2微观结构观察 用透射电子显微镜观察OA-NLCs和TPGS-OA-NLCs的微观形态。分别取OA-NLCs和TPGS-OA-NLCs,经蒸馏水稀释后,各取1滴置于碳涂层的铜网格表面,水分自然挥干,滴加磷钨酸溶液(质量浓度为10 mg·mL-1)染色10 min,水分自然挥干,将2个样品放置在透射电镜下观察,并拍摄电镜照片,见图1。

注:A.OA-NLCs;B.TPGS-OA-NLCs。
由图1可见,OA-NLCs和TPGS-OA-NLCs均呈球状,视野中未观察到药物结晶颗粒,通过电镜照片比较可知,TPGS-OA-NLCs的大部分纳米粒粒径比OA-NLCs小,这也验证了Zetasizer Nano-ZS的测定结果。
2.2.3体外药物释放研究 用透析袋扩散法评价OA-NLCs和TPGS-OA-NLCs在体外的药物释放情况。取OA-NLCs、TPGS-OA-NLCs以及OA乙醇溶液(质量浓度为5 mg·mL-1)各2 mL分别放入透析袋中,释放介质为pH 6.8磷酸盐缓冲溶液200 mL,并加入质量浓度为5 mg·mL-1的Tween-80作为增溶剂,在37 ℃下以50 r·min-1的搅拌速度将透析袋完全浸入到释放介质中,并在固定的时间间隔(0.5、1、2、4、6、8、10、12、24 h)内取出释放介质3 mL(补加同温同体积空白介质),用0.45 μm微孔滤膜过滤,滤液经适当稀释后用HPLC法检测药物含量,计算药物质量浓度,绘制药物累积释放量-时间曲线,见图2。
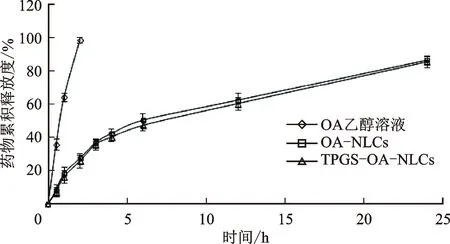
图2 OA乙醇溶液、OA-NLCs和TPGS-OA-NLCs的体外药物释放曲线
由图2可见,齐墩果酸乙醇溶液中的药物在2 h内释放完全,而OA-NLCs和TPGS-OA-NLCs均表现为持续、缓慢地药物释放过程,且药物释放量基本同步,在前2 h药物释放量基本一致,大约有25%的药物从载体中释放出来,在随后的24 h内累计约有85%的药物释放。
2.3 细胞转运研究
将Caco-2单层细胞用于研究OA-NLCs和TPGS-OA-NLCs从细胞顶端(apical,AP)到基底外侧(basolateral,BL)(AP→BL,表示吸收过程)和BL到AP(BL→AP,表示分泌过程)的细胞转运特征。将Caco-2细胞置于含有质量浓度为100 g·L-1的胎牛血清(100 u·mL-1青霉素和100 u·mL-1链霉素)的培养基中孵育21 d(孵化条件:37 ℃,二氧化碳体积分数为5%,测定跨上皮电阻(trans-epithelium electrical resistant,TEER)值为(456.5±27.6) Ω·cm-2,表明紧密的Caco-2单层细胞模型已成功构建[14],在转运实验开始前,用预热的(37 ℃)空白汉克平衡盐溶液(Hank’s balanced salt solution,HBSS)淋洗Caco-2单层细胞3次,备用。配制含有不同质量浓度OA原料药、OA-NLCs和TPGS-OA-NLCs的HBSS作为供试液,分别取各组溶液1.0 mL加入Caco-2单层细胞的顶端(AP),并向基底外侧(BL)加入空白HBSS 2.5 mL作为接收液,在固定的时间点从BL侧取接收液0.3 mL(同时补加同体积空白HBSS),离心后取上清液经HPLC法测定药物含量;按上述操作,测定各组溶液从BL侧向AP侧转运的药物含量,按照公式(1)和(2)计算表观渗透系数(apparent permeability coefficient,Papp)和外排比(efflux ratio,ER)。结果见表2。

表2 OA原料药、OA-NLCs和TPGS-OA-NLCs在Caco-2细胞单层中的渗透性
(1)
(2)
其中dQ/dt是接收液中齐墩果酸的稳态透过率,C0是供试液中齐墩果酸的初始质量浓度,A是Caco-2单层细胞的面积,Papp(AP→BL)是齐墩果酸从顶端转运到基底外侧的Papp值,Papp(BL→AP)是齐墩果酸从基底外侧转运到顶端的Papp值。
研究结果显示,OA原料药从BL侧到AP侧的Papp(BL→AP)值为(0.81±0.26)×10-6cm·s-1,而从AP侧到BL侧的Papp(AP→BL)值为(2.42±0.38)×10-6cm·s-1,ER值为2.99,该结果与文献报道的一致[15],表明齐墩果酸很可能是P-gp的底物[16];OA-NLCs的Papp(BL→AP)和Papp(AP→BL)值分别为(1.59±0.24)×10-6和(1.47±0.33)×10-6cm·s-1,ER值为1.08,与OA原料药相比降低了2.77倍,这是由于较小粒径的纳米颗粒容易被细胞内吞,促进药物吸收[17];TPGS-OA-NLCs的Papp(BL→AP)和Papp(AP→BL)值分别为(0.84±0.19)×10-6和(2.46±0.39)×10-6cm·s-1,其ER值为0.34,分别比OA原料药和OA-NLCs降低了8.79和3.18倍,一方面是由于TPGS-OA-NLCs通过细胞内吞作用进入细胞内,促进药物吸收,另一方面处方中加入TPGS,能够显著抑制P-gp的活性,降低了P-gp对齐墩果酸的外排作用[18]。
2.4 药效学评价
取SD大鼠,体质量为(220±20) g,雌雄各半,通过大鼠腹腔注射四氧嘧啶溶液诱发糖尿病,建立大鼠糖尿病模型(空腹血糖大于300 mg·dL-1)。将糖尿病大鼠随机分成4组,每组3只,第1组大鼠作为空白对照,灌胃给予饮用水,第2组大鼠灌胃给予OA混悬液(药物分散在质量浓度为5 mg·mL-1的羧甲基纤维素钠中),第3组大鼠灌胃给予OA-NLCs,第4组大鼠灌胃给予TPGS-OA-NLCs,给药剂量均为100 mg·kg-1,并在0、1、2、4、6、8、10、12、24 h经眼眶后神经丛采血0.1 mL,用葡萄糖检测试剂盒测定血糖水平,比较OA混悬液、OA-NLCs和TPGS-OA-NLCs降血糖的效果。结果见图3。

图3 口服OA混悬液、OA-NLCs和TPGS-OA-NLCs后大鼠体内的血糖水平比较
由图3可见,糖尿病大鼠在分别口服OA混悬液、OA-NLCs和TPGS-OA-NLCs后,血糖水平均出现降低趋势,口服TPGS-OA-NLCs大鼠在各时间点的血糖水平明显低于口服OA-NLCs和OA混悬液的大鼠,进一步说明TPGS-OA-NLCs促进了药物吸收,降血糖效果显著。
3 讨论
齐墩果酸自身的溶解度及其透过胃肠道黏膜的能力(渗透性)是影响药物口服生物利用度的2个最重要的因素。改善齐墩果酸的溶解度可以通过制剂技术,但是如何提高齐墩果酸的渗透性仍是一个难点。Caco-2细胞是来自于人类肠道的肿瘤细胞,通过体外培养即可得到在形态和功能上与人类小肠上皮层相似的单层结构,更重要的是,Caco-2细胞之间存在紧密连接,形成肠道吸收的限速屏障,这是小肠上皮层的特征,Caco-2单层细胞模型已广泛用于预测药物及制剂经口服给药的肠道渗透性。因此,本研究采用Caco-2单层细胞模型评价OA原料药、OA-NLCs和TPGS-OA-NLCs的细胞转运特征。
P-gp是一种存在于细胞膜上的转运蛋白,其功能是保护细胞免受外来有害分子的侵害[19]。由于齐墩果酸是P-gp的底物,存在外排现象,故严重影响了药物的肠道吸收。TPGS是一种安全的药用辅料,已被美国药典收录,且TPGS能够逆转P-gp的外排泵作用,促进药物吸收,因此,本研究将齐墩果酸制备成纳米结构脂质载体,在该处方的基础上加入TPGS,不仅可增加药物的溶解性,而且可提高药物的渗透性,最终通过大鼠药效学实验证实TPGS-OA-NLCs能有效提高药物的降血糖效果。本研究可为提高齐墩果酸的治疗效果奠定基础。
