肿瘤坏死因子-α调控血管平滑肌细胞向巨噬细胞表型转化及其在静脉血栓管壁重塑中的作用及机制
2022-06-08王鹏辉张琳杰崔超毅陆信武殷敏毅
王鹏辉 ,张琳杰 ,崔超毅 ,赵 振,陆信武,殷敏毅
1 上海交通大学医学院附属第九人民医院血管外科,上海 200011
2 上海交通大学血管病诊治中心,上海 200011
深静脉血栓形成(deep vein thrombosis,DVT)是深静脉系统内的血液异常凝结,通常发生在上肢或者下肢[1]。DVT 的主要并发症包括肺栓塞(pulmonary embolism,PE)和血栓形成后综合征(post-thrombotic syndrome,PTS)[2],其中PTS 是DVT 最常见的中长期并发症。目前,PTS 的治疗方法主要包括弹力袜压迫疗法、抗凝、溶栓和支架成形术等,上述方法虽有一定疗效,但均存在不足之处,如弹力袜的疗效尚存在争议[3]、支架成形术存在一定再闭塞发生率等。因此,深入研究PTS 发病机制,探寻预防和治疗PTS 的靶标,对于阻止和缓解PTS 的发生发展有着重要的临床价值。传统观点认为,血栓阻塞静脉管腔和血栓破坏静脉瓣膜引起的静脉高压是血栓形成后引起PTS 的主要发生机制[4]。但DVT 后即使经过早期规范化抗凝治疗仍有近一半的患者发展为PTS[5-7]。近期研究也表明,血栓形成8 d 后即便完全移除血栓,也不能减少PTS 的发生[8]。近年来,血栓后静脉管壁炎症[9]和纤维化重塑[10]逐渐成为PTS 发生的机制研究焦点之一,纤维化的静脉血管缺乏正常静脉管壁的弹性和舒缩功能,静脉回流功能受损进而导致静脉高压使PTS 发生[11]。但静脉管壁炎症的主要病理机制和炎症细胞来源,目前尚无定论。血管平滑肌细胞(vascular smooth muscle cell,VSMC)作为血管中膜的主要细胞组成部分,是一类高度分化的、主要负责血管收缩与舒张的细胞类型。在生理状态下,VSMC 保持收缩表型,发挥其收缩功能以调节血压和维持血管张力[12]。而在血管损伤、炎症等病理状态下,VSMC 可转化为成骨细胞、成软骨细胞、脂肪细胞、巨噬泡沫细胞等多种细胞表型,驱动血管疾病的发生发展过程[13]。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)作为主要由巨噬细胞分泌的炎症调节因子,可以通过TNF-α/TNF-R p55轴加速小鼠静脉血栓的消退[14],但其在PTS 静脉管壁VSMC 表型转化中的作用还知之甚少。本研究旨在探讨血栓后静脉管壁中TNF-α 调节VSMC 向炎症细胞表型转变的作用及相关机制,以期为临床上防治PTS 提供新思路,现报道如下。
1 对象与方法
1.1 研究对象
选取2020年6—12月上海交通大学医学院附属第九人民医院收治的16例血栓性浅静脉炎患者为研究对象。纳入标准:(1)下肢浅静脉曲张合并浅静脉炎,可表现为患肢浅静脉区局部红肿、疼痛,行走时加重,可触及痛性索状硬条或串珠样结节;(2)首次浅静脉炎发作,且浅静脉炎发生时间大于2周;(3)超声示静脉管腔内可见回声略增强的血栓影,静脉管壁呈现1处或者多处增厚现象,部分血栓再通的部位出现不规则的、细小的分支状血流。排除标准:(1)合并全身结缔组织病,如马方综合征等;(2)外伤性浅静脉炎;(3)局部曲张浅静脉全程血栓,缺乏未受血栓累及的曲张浅静脉作为对照;(4)既往反复血栓性浅静脉炎发作。静脉样本小心去除管腔内血栓(血凝)块及管壁外膜组织,随后用手术刀片轻刮管腔内侧2~3次去除管腔内皮细胞,以获取较为均一的静脉管壁中膜样本。静脉管壁样本液氮保存,以备后续试验使用。16例患者中,以血栓累及下肢浅静脉中膜部分作为试验组,邻近未受血栓累及的正常浅静脉中膜部分作为对照组,将16例血栓性浅静脉炎患者中的6例进行基因芯片分析,剩余10例患者进行巨噬细胞表型标志物的检测。从上海交通大学医学院实验动物中心获得清洁级雄性SD大鼠22只,4~6周龄,体重(200±50)g,将下腔静脉血栓造模成功的SD大鼠随机分为血栓组(n=12)和实验组(n=10)。所有患者均签署知情同意书并获得上海交通大学医学院附属第九人民医院伦理委员会批准。本研究已获得上海交通大学医学院动物伦理委员会审批。
1.2 主要试剂
TNF-α购于美国Peprotech公司,氯化钙(CaCl2)购于生工生物工程(上海)股份有限公司,磷酸酶抑制剂(β-glycerophosphate)购于Merck,L-Ascorbic Acid购于碧云天生物技术有限公司,胰岛素(insulin)购于上海源培生物科技有限公司,地塞米松(dexamethasone,DXMS)购于麦克林公司,胎牛血清(fetal bovine serum,FBS)购于Sigma公司,达尔伯克改良伊格尔培养基(Dulbecco's modified Eagle's medium,DMEM)培养基购于上海源培生物科技有限公司,0.5%胰酶购于Gibco 公司,青/链霉素购于Gibco 公司,Trizol购于美国英杰生命技术有限公司,反转录试剂盒购于全式金公司,SYBR Green试剂盒购于Thermo 公司。
1.3 方法
1.3.1 人静脉管壁样本试验
(1)应用Agilent基因芯片技术,从基因水平分析试验组和对照组浅静脉标本中差异基因的表达。筛选t检验中上调或下调倍数变化值≥1.5且P≤0.05的差异基因,热图显示与巨噬细胞表型和功能相关的差异基因表达。(2)逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测人静脉管壁巨噬细胞表型标志物mRNA的表达:使用Trizol法抽提人静脉管壁样本RNA,静脉管壁样本剪碎后,加入Trizol冰上研磨并裂解,添加氯仿后振荡摇匀并离心。移取上清后用等量异丙醇沉淀RNA,再分别使用75%和100%乙醇洗涤,晾干后加入去RNA酶的水,待RNA完全溶解后测量RNA浓度。每个样本按1 μg RNA进行反转录合成cDNA后,通过RT-PCR进行扩增。人目的基因的特异性引物序列见表1。

表1 人RT-PCR引物序列
1.3.2 体外细胞实验
(1)细胞培养:人脐静脉平滑肌细胞(human umbilical vein smooth muscle cell,HUVSMC)使用完全培养基(含5% FBS、1%青/链霉素)于37 ℃、5% CO2培养箱内培养HUVSMC,待细胞密度达到80%~90%后,按1 ∶3的比例进行传代扩增。HUVSMC 以7.5×104个/孔的密度接种在12孔板上,置于37 ℃、5% CO2培养箱中培养24 h。(2)分组及处理:HUVSMC贴壁后,将完全培养基换成分化诱导培养基[含CaCl2(4 mm)、β-glycerophosphate(5 mm)、L-Ascorbic Acid(50 µg/ml)、insulin(1 µm),dexamethasone(0.1 µm)、5% FBS]。TNF-α(20 ng/ml)作用24 h以模拟炎症应激模型,随后分为两组。对照组只在分化诱导培养基下培养,试验组添加TNF-α(20 ng/ml)继续刺激,每24 小时换液,处理3~4 d 后提取细胞RNA。(3)RT-PCR 检测HUVSMC 巨噬细胞表型标志物的表达:使用Trizol 裂解HUVSMC 并提取RNA,具体步骤详见1.3.1。
1.3.3 动物实验
(1)大鼠下腔静脉血栓模型建立及分组:大鼠下腔静脉造模方法参考文献[15],适应性喂养大鼠2周后,腹腔注射0.6%戊巴比妥钠进行麻醉,常规剪毛、消毒、铺巾。剪开皮肤、浅筋膜,显露下腔动、静脉后,分别游离下腔静脉主干长约1 cm,以6-0丝线于静脉起始处结扎,并蚊式血管钳钳夹结扎处静脉3次,造成机械性损伤,冲洗并缝合伤口。待大鼠完全苏醒后,转移至鼠笼内正常喂养。下腔静脉血栓造模成功的SD 大鼠随机分为血栓组(n=12)和实验组(n=10)。造模成功14 d后,使用0.6%戊巴比妥钠腹腔麻醉后,再次打开大鼠腹腔。游离下腔静脉结扎线远心端及后腹膜间的腔隙后,于该腔隙内给药(血栓组仅注射水凝胶,实验组注射含TNF-α 的水凝胶),待2~4 min 凝胶凝固后即可关腹。待水凝胶局部作用血管24~48 h后,在紧邻下腔静脉结扎线近心端和右侧分支分出部位近心端之间取材。(2)RT-PCR 检测大鼠下腔静脉管壁巨噬细胞表型标志物mRNA 的表达:大鼠下腔静脉管壁剪碎后,加入Trizol 在冰上研磨并充分裂解,提取RNA,具体步骤详见1.3.1,目的基因引物序列见表2。

表2 大鼠RT-PCR引物序列
1.4 观察指标
比较人血栓段静脉管壁与正常段静脉管壁巨噬细胞表型标志物(CD68、LGALS3)的mRNA 表达水平。测定并比较TNF-α培养后HUVSMC 的表型标志物(ACTA2、TAGLN、COL1A1)和巨噬细胞表型标志物(CD68、LGALS3、TNF)的mRNA表达水平。最后比较大鼠下腔静脉血栓组与实验组静脉管壁内VSMC表型标志物(Acta2、Tagln和Col1a1)和巨噬细胞表型标志物(Cd68、Lgals3和Tnf)的mRNA 表达水平。
1.5 统计学方法
使用Graphpad Prism 8软件进行统计分析,计量资料以()表示,组间比较采用两独立样本t检验。P<0.05差异有统计学意义。
2 结果
2.1 人静脉管壁中膜巨噬细胞表型标志物mRNA 表达的比较
基因芯片差异基因热图结果显示,试验组静脉管壁中膜内巨噬细胞表型标志物CD68、内质网与线粒体接触复合物调控因子1(endoplasmic reticulum-mitochondria encounter structure regulator 1,EMR1)、LGALS3中mRNA表达均高于对照组(图1)。收集10例患者血栓性和非血栓性浅静脉炎的静脉管壁样本,选择芯片数据中表达量相对较高的CD68、LGALS3基因进一步验证,RT-PCR 结果显示,试验组人静脉管壁中膜巨噬细胞表型标志物CD68mRNA 表达高于对照组,差异有统计学意义(P<0.05);两组LGALS3mRNA表达水平比较,差异无统计学意义(P>0.05)(表3)。
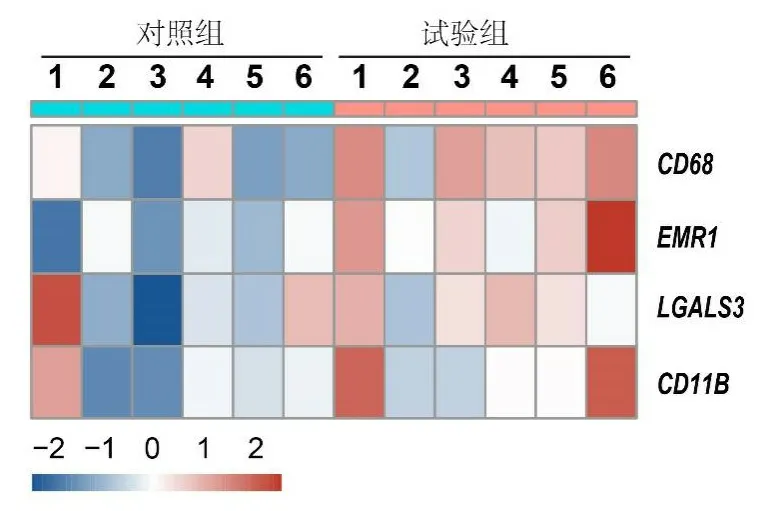
图1 人静脉管壁中膜巨噬细胞表型标志物mRNA的表达情况
表3 人静脉管壁CD68、LAGALS3的mRNA表达比较()

表3 人静脉管壁CD68、LAGALS3的mRNA表达比较()
2.2 经TNF-α 刺激HUVSMC 后细胞表型标志物mRNA表达的比较
TNF-α刺激HUVSMC 3~4 d后,试验组收缩表型ACTA2、TAGLN和合成表型标志物COL1A1mRNA均低于对照组,差异均有统计学意义(P<0.05),其中收缩表型标志物的变化更为明显。RT-PCR结果显示,TNF-α作用HUVSMC后,试验组巨噬细胞表型相关标志物CD68、LGALS3和炎症因子标志物TNFmRNA 均明显高于对照组,差异均有统计学意义(P<0.01)。(表4)
表4 经TNF-α刺激HUVSMC后细胞表型标志物mRNA表达的比较()

表4 经TNF-α刺激HUVSMC后细胞表型标志物mRNA表达的比较()
2.3 大鼠经TNF-α 处理下腔静脉血栓形成后静脉管壁VSMC 表型标志物mRNA 表达的比较
TNF-α 处理下腔静脉血栓形成静脉管壁24 h后,实验组大鼠静脉管壁VSMC 表型标志物中TAGLNmRNA明显低于血栓组,差异有统计学意义(P<0.01);而两组大鼠Acta2、Col1a1mRNA 比较,差异均无统计学意义(P>0.05)(表5)。TNF-α 处理下腔静脉血栓形成静脉管壁24 h后,实验组大鼠巨噬细胞表型标志物分子Cd68、Lgals3、TnfmRNA均明显高于血栓组,差异均有统计学意义(P<0.01);TNF-α处理下腔静脉血栓形成静脉管壁48 h后,实验组大鼠巨噬细胞表型标志物分子Cd68、Lgals3mRNA均明显低于血栓组,而TnfmRNA明显高于血栓组,差异均有统计学意义(P<0.01)(表6)。
表5 大鼠经TNF-α处理下腔静脉血栓形成静脉管壁VSMC表型标志物mRNA表达的比较()
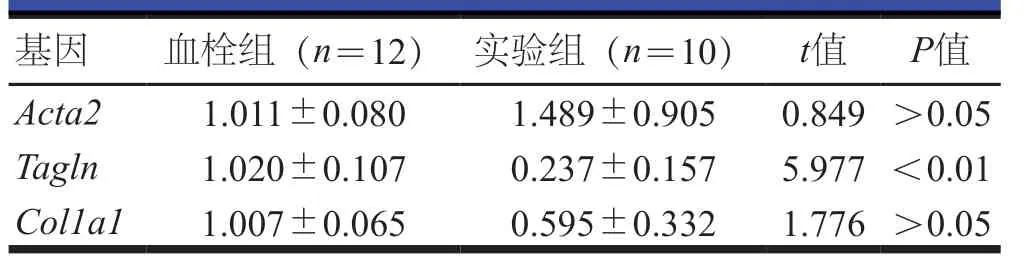
表5 大鼠经TNF-α处理下腔静脉血栓形成静脉管壁VSMC表型标志物mRNA表达的比较()
表6 大鼠经TNF-α处理下腔静脉血栓形成静脉管壁巨噬细胞表型标志物mRNA表达的比较()
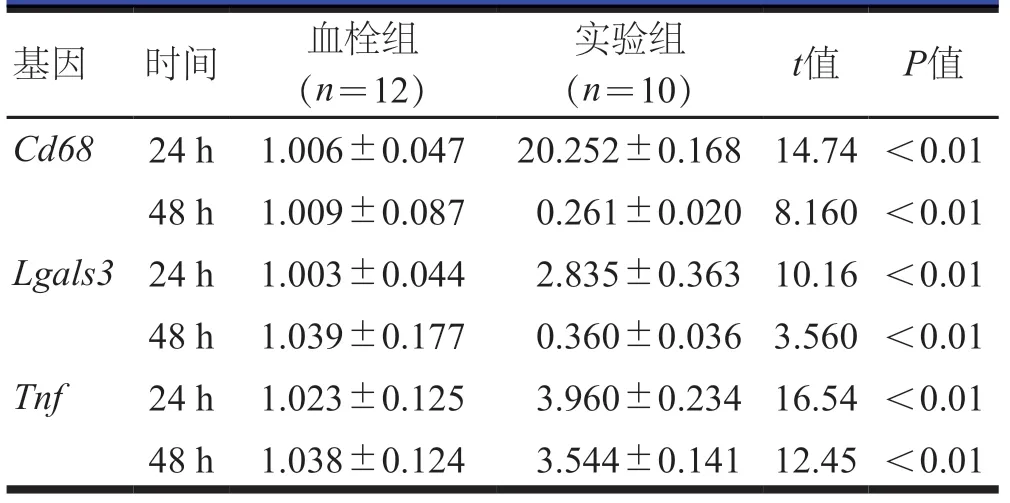
表6 大鼠经TNF-α处理下腔静脉血栓形成静脉管壁巨噬细胞表型标志物mRNA表达的比较()
3 讨论
VSMC作为血管中膜主要的细胞组分,可以去分化成具有成纤维细胞、成骨细胞及巨噬细胞样特征的细胞[16]。在VSMC去分化为巨噬细胞样表型的过程中,VSMC不仅可以获得吞噬的特性,而且能参与同血管组织原位或招募来的免疫细胞的相互作用,在血管组织稳态中起重要作用[17]。此外,也有研究表明,巨噬细胞样VSMC也可表现出非典型吞噬细胞的特征,导致血管局部出现慢性、非消退性的炎症状态。该过程主要与吞噬细胞的招募和大量细胞因子释放引起的免疫活性细胞迁移密切相关[18]。现有的研究主要集中在动脉粥样硬化等动脉相关的慢性炎性疾病,但炎症调节VSMC 表型在静脉管壁重塑中的研究还很少。
炎症是导致血栓后静脉高压并诱发PTS后管壁重塑的重要原因[9],在血管损伤修复的过程中,炎症因子TNF-α可以参与调节VSMC 表型转化[19],如促进细胞外基质的合成和分泌[20],增加VSMC 增殖、迁移能力;诱导VSMC 从收缩表型向成骨/成软骨细胞表型转化[21],增加血管钙盐沉积,造成管壁顺应性下降和功能改变。本研究发现,伴随血栓段静脉管壁内VSMC 收缩表型标志物表达的下调,TNF-α在静脉中膜VSMC 内表达明显增加。据此推测,TNF-α可能通过调节血栓后静脉管壁内VSMC收缩表型向巨噬细胞样表型分化,加剧了静脉管壁的损伤,影响静脉功能的恢复。
本研究首先从临床血栓性浅静脉炎静脉管壁样本入手,发现与巨噬细胞表型相关标志物CD68的表达水平出现明显上调,提示血栓后静脉管壁炎症反应增强。体外结果表明,TNF-α 作用HUVSMC后,平滑肌细胞内收缩及合成表型标志物表达均下降,但以收缩表型下降更为明显。与此同时,TNF-α 作用下平滑肌细胞内巨噬细胞表型标志物CD68、LGALS3mRNA的表达增加,提示炎症因子TNF-α 可能是导致VSMC 出现去分化表现并向巨噬细胞样表型转变的重要因素。本研究结果显示,试验组炎症因子TNF-α 的表达显著增强,初步提示,此状态下的VSMC 拥有巨噬细胞分泌炎症因子的能力。炎症反应作为静脉血栓形成和消退的核心环节,在DVT 早期加剧血栓形成,而在中晚期有促进血栓机化再通的作用,并在血栓形成后相当长的一段时间内持续存在[22]。为了更好地模拟PTS 发生时持续存在的慢性炎症病理状态,本研究体外细胞实验设计中先用TNF-α 统一处理HUVSMC 24 h,再进行后续实验。有关研究结果显示,大鼠下腔静脉结扎第7天血栓开始出现部分溶解和机化再通,静脉血栓进入慢性期[15]。因此,本研究选择进入慢性消融期,即下腔静脉结扎第14天的大鼠下腔静脉血栓模型进行水凝胶载药局部处理血管展开研究。本研究结果显示,相较于对照组,TNF-α 处理下腔静脉血栓形成后,实验组静脉管壁收缩型标志物TaglnmRNA 显著下降,巨噬细胞表型标志物mRNA 表达明显增强,VSMC 向巨噬细胞表型转变。提示,TNF-α 可能是调节血栓后静脉管壁VSMC 向巨噬细胞表型转化的重要因子之一。然而本研究也存在一定的不足之处,纳入患者数量相对较少,体内试验、体外实验仅检测了mRNA 水平的改变。后续将进一步扩大样本量,并在体外体内实验部分继续探索蛋白水平上的变化,使研究结论更具信服力。
综上所述,血栓后静脉管壁VSMC 可在TNF-α 刺激下向巨噬细胞样表型转化,且该巨噬细胞样VSMC 拥有分泌TNF-α 的能力,并可能成为管壁炎症反应的重要细胞来源,加重炎症反应,为PTS 的防治干预靶点提供新策略。
