切花非洲菊不同外植体初代培养的比较研究
2022-06-08李学铃张莹莹陈晓雯王麒麟钱晶晶张雪平安徽科技学院安徽合肥230041
李学铃,张莹莹,陈晓雯,王麒麟,钱晶晶,张雪平(安徽科技学院,安徽合肥 230041)
非洲菊(Gerbera jamesonii Bolus)又称波斯花、千日菊,是一种多年生草本植物[1]。非洲菊来源于南非地区,在阳光充足、通风环境下生长好,适合生长温度为20~25℃[2]。非洲菊花大,花茎耸立,花的颜色多样,切花率高,作为鲜切花材料,是世界各国常用的切花,盆栽或庭院栽培也深受人们的欢迎。非洲菊是一种异花授粉且自交不孕植物,幼苗不能保持母株的优良特性,分株繁殖速度较慢,不能够满足市场需求。为了避免这些缺点,通过组培技术,能加快非洲菊繁殖速度,从而提高经济效益。因此,组培技术是提高繁殖速度、满足市场需求的有效途径[3]。
非洲菊组培方面的研究报道,大多数以离体快繁方面的内容为主[4];近年来,过聪[5]等用非洲菊的嫩叶诱导出愈伤组织。毛红丽[6]于2011 年以非洲菊的芽作为外植体进行组织培养,诱导成苗。高绍良[7]等以非洲菊的花托,通过不同激素配比培养基的组培试验,诱导成苗。成晟[8]等以花托为外植体,通过组织培养获得再生植株,建立了快速繁殖体系。Sina Khalili[9]等利用非洲菊离体多倍体诱导方法,对诱导的外植体进行处理,从而诱导生根。组织培养技术提高了繁殖速率,促进了非洲菊产业体系的发展[10]。本研究以非洲菊‘大雪橘’品种的茎尖、叶片和花托为外植体,探讨了不同取材部位、不同激素浓度及配比的诱导比较研究,旨在为非洲菊组培快繁研究提供依据。
1 材料与方法
1.1 不同外植体的选择与处理
选取生长健壮的非洲菊‘大雪橘’品种的茎尖、叶片和花托为外植体,自来水冲洗3 次后,蒸馏水冲洗,然后放置超净的工作台上消毒;75%的酒精浸泡20 s,无菌水冲洗2 次;0.1%氯化汞溶液用力摇晃8 min,最后用无菌水冲洗4 次。茎尖留5 mm 长,叶片切为8 mm×8 mm 的小块,花托切为5mm×5mm 的方块,进行接种。
1.2 不同外植体的初代培养基
1.2.1 茎尖的丛生芽诱导培养。以MS 为基本培养基,琼脂均为6.0 g/L,糖均为30 g/L,将茎尖接种在5 种不同培养基上,分别为:
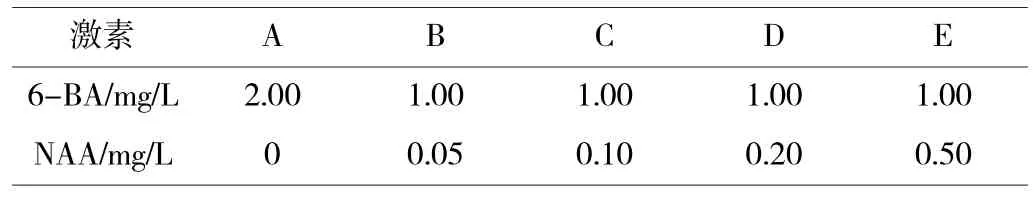
表1 非洲菊丛生芽的5 种不同激素配比
接种30d 后,计算丛芽数和启动率(出现丛生芽的茎尖数/接种茎尖总数),观察丛生芽生长状况,从以上5 种培养基中筛选出丛生芽诱导的最佳培养基。
1.2.2 叶片愈伤组织的诱导。将叶片接种在不同浓度的细胞分裂素和生长素的培养基上接种,其激素配比为:①6-BA 2.0 mg/L、NAA 1.0 mg/L;②6-BA 1.5 mg/L、NAA 0.5 mg/L;③6-BA 1.5 mg/L、NAA 0.2 mg/L;④6-BA 1.0 mg/L、NAA 0.5 mg/L;⑤6-BA 1.0 mg/L、NAA 0.2 mg/L;培养基pH 6.0,蔗糖30 g/L,琼脂6.0 g/L。每瓶接种4 片。在5 种不同培养基中进行叶片促愈伤组织的培养,接种26 d 后,统计愈伤率,观察愈伤组织生长状况,选择最佳的培养基。
1.2.3 花托愈伤组织的诱导。将非洲菊花托接种在2 种不同处理的培养基上,以MS 为基本培养基,激素配比分别为A:6-BA 0.5 mg/L、NAA 0.5 mg/L;B:6-BA 0.5 mg/L、2,4-D 0.5 mg/L。培养基的pH 值6.0,蔗糖30 g/L,琼脂6.0 g/L。每瓶培养基接种2 个。置于培养室内,经过26 d 培养,计算愈伤率,观察愈伤组织生长状况,确定最佳培养基。
1.3 数据统计分析
用Excel 进行数据整理和图表绘制,用SPSS 19.0进行方差分析(ANOVA)和多重比较,检验差异显著性,显著水平均为P <0.05。
2 结果与分析
2.1 茎尖丛生芽诱导情况
由表2 可知,培养基中不添加NAA,可以获得一定的丛生芽,但培养基中芽数较少,丛生芽生长较差(图1)。适当添加生长素后,增殖芽的数量增加。在6-BA 浓度相同的情况下,随着NAA 浓度的增加,增值的丛芽数降低。切花非洲菊在B 培养基中的启动率分别比A、C、D、E 培养基中的高55.56%、55.56%、55.56%和75.02%,均差异显著,可知丛生芽诱导阶段的最适培养基为MS+6-BA 1.0 mg/L+NAA 0.05 mg/L。由图1 可知,5 种培养基均能促进茎尖丛生芽的发生,但不同激素配比对芽增殖的影响不同。A 的非洲菊丛生芽生长状态较弱,植株瘦弱矮小;B 的非洲菊幼苗色泽更健康,无枯死叶片,长势更旺。C、D、E 的植株生长较差,幼苗色泽较黄,有枯萎和坏死的叶片,生长发育不良,成活率低。因此,MS+6-BA 1.0 mg/L+NAA 0.05 mg/L 是非洲菊茎尖诱导丛生芽较适合的培养基。

表2 不同处理对非洲菊组培丛生芽的影响

图1 非洲菊丛生芽生长状态
2.2 叶片的诱导培养效果
由图2 可知,叶片诱导愈伤组织培养基配方①的愈伤率比配方⑤增高23.81%,达显著差异;比配方②、③和④的愈伤率分别增高6.67%、11.11%和16.67%;培养基配方①和配方②差异较小。即MS+6-BA 2.0 mg/L+NAA 1.0 mg/L 和MS+6-BA 1.5 mg/L+NAA 0.5 mg/L 均可作为非洲菊叶片愈伤的培养基。结合非洲菊叶片愈伤的生长状态图(图3)可知:培养基配方①非洲菊的愈伤量小、叶黄,生长较差,但愈伤率较高;配方②非洲菊的愈伤虽生长健壮,但褐化率较高,增殖率相对而言比配方①要低;配方③非洲菊的愈伤量较大、偏黄,生长不良;配方④非洲菊的愈伤生长瘦小,叶黄,容易产生褐化;配方⑤非洲菊的愈伤生长不良、叶黄。由愈伤组织生长状况可知,6-BA 1.5 mg/L、NAA 0.5 mg/L 的激素配比对非洲菊叶片愈伤诱导效果相对较好。

图2 不同处理对非洲菊愈伤率的影响
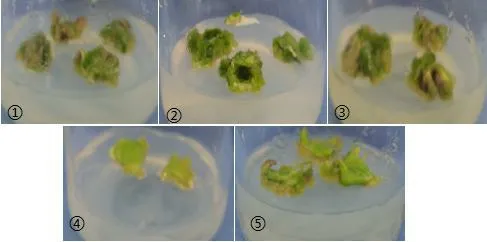
图3 非洲菊愈伤增殖的状态
2.3 花托的愈伤组织诱导情况
由表3 可知,非洲菊的花托培养在6-BA 浓度均为0.5 mg/L 的情况下,加入2,4-D 培养基的愈伤组织诱导率比加入NAA 的高23.91%,差异显著。即MS+6-BA 0.5 mg/L+2,4-D 0.5 mg/L 对非洲菊花托愈伤组织的诱导效果相对较好。花托诱导的愈伤组织状态图4 所示,图A 是在6-BA 0.5 mg/L、NAA 0.5 mg/L 激素配比上愈伤组织的生长状态,花托呈现继续生长状态,表面愈伤组织疏松,颜色为白色,数量较少;图B 愈伤组织是在MS+6-BA 0.5 mg/L+2,4-D 0.5 mg/L 培养基上生长的状态,花托表面愈伤组织结构较为紧密,颜色为绿色,外部组织较为疏松,颜色为乳黄色,愈伤组织量较多。即MS+6-BA 0.5 mg/L+2,4-D 0.5 mg/L 诱导出的愈伤组织生长情况相对较好。

图4 花托诱导的愈伤组织状态
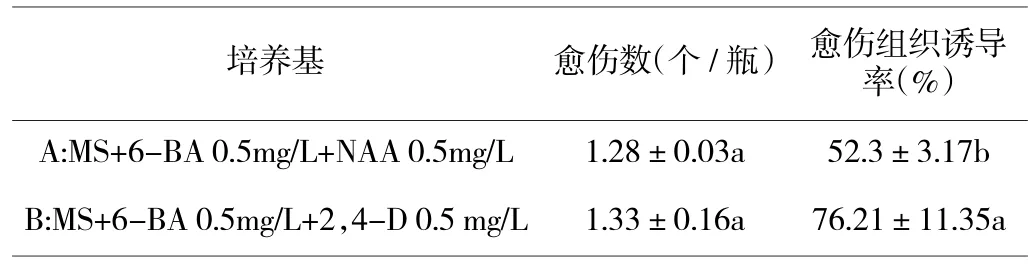
表3 不同培养基对非洲菊花托愈伤组织诱导的影响
3 讨论
3.1 非洲菊的丛生芽诱导
从非洲菊茎尖诱导丛生芽的情况可知,在5 种不同培养基中,丛生芽长势最好的培养基为MS+6-BA 1.0 mg/L+NAA 0.05 mg/L。试验发现,茎尖的芽基部有少量的愈伤组织能够促进丛生芽生长。这与于非等[14]的试验研究结果一致。非洲菊初代培养用茎尖作为外植体,筛选出适宜的增殖配方,可以直接获得较多的组培苗,但是非洲菊植株丛生状,能取用的茎尖较少。
3.2 愈伤组织诱导和增殖的影响因子
彭儒胜[15]等的试验研究表明,不同培养基状态对非洲菊愈伤组织诱导的影响不同,固体培养基有利于愈伤组织诱导培养。因此,本试验直接采用固体培养基。
在叶片愈伤增殖诱导中可以看出,6-BA 2.0 mg/L、NAA 1.0 mg/L 的激素配比即细胞分裂素与生长素比例为2∶1 时,愈伤增殖率达到66.67%,但愈伤组织生长状态不佳,在6-BA 1.5 mg/L、NAA 0.5 mg/L 的激素配比的培养基中,非洲菊叶片的愈伤率略低,而愈伤组织生长状况更好,针对出现褐化的情况,可以在之后优化配方的试验中进行防褐化处理。花托愈伤增殖诱导的培养基配方中2,4-D 的效果优于NAA,与梁俊香等[16]的研究结果一致。
非洲菊初代培养中,筛选出适宜的配方,叶片和花托均可诱导出量较多、生长状态较好的愈伤组织,拟进一步比较2 种外植体的诱导效果,还需分别用诱导出的愈伤组织为外植体,比较叶片和花托诱导出的愈伤组织的分化诱导情况。
4 结语
非洲菊的组培苗初代培养阶段,为了比较不同外植体的促生效果,对茎尖、叶片和花托3 种外植体进行了培养基配方对比试验,结果表明,非洲菊茎尖诱导丛生芽的最佳激素配比为6-BA1.0 mg/L、NAA 0.05 mg/L,叶片愈伤组织诱导的最适宜培养基为MS+6-BA 1.5 mg/L+NAA 0.5 mg/L,花托愈伤诱导的最佳激素配比为6-BA 0.5 mg/L、2,4-D 0.5 mg/L,筛选出各外植体适宜的培养基。
