青少年不同程度高度近视患者视网膜微血管变化情况分析
2022-06-07吉艳艳李忠庆崔迎春陆诗林袁海燕
吉艳艳 李忠庆 王 甲 康 烨 崔迎春 陆诗林 袁海燕 陈 松
目前,青少年近视率持续上升,并且呈现低龄化,高度近视(HM)患者占比出现逐渐增加的趋势,到2050年中国儿童青少年近视患病率将达到84%[1]。预计到2050年,HM有可能会成为全球首要致盲原因[2]。 HM可引起一系列眼底并发症,包括脉络膜新生血管化和黄斑出血[3]、视网膜变性[4]、视网膜脱离[5]等。 Verhoeven等[6]对55~85岁的视力障碍人群进行调查发现,严重视力损害的主要原因是HM患者的黄斑变性,且随着屈光度或眼轴长度(AL)增加,视力损害显著增加。
有研究显示,HM患者黄斑血管密度降低[7],提示血管可能在近视的病理生理过程中起重要作用。 光学相干断层扫描血流成像(OCTA)是一种可重复、快速和无创的技术[8]。 以往研究表明,OCTA能够快速准确地检测黄斑区血管形态和血管密度,并可提供三维血流图像,在视网膜血管检测中发挥重要作用[9]。 以往研究对于青少年超HM(SHM)患者的微血管系统研究较少。本研究主要针对AL≥27 mm,屈光度≤-9.00 D的SHM青少年患者[10-11],利用OCTA评价不同程度HM青少年患者黄斑区微循环,为探索和干预青少年近视的发病机制提供指导。
1 资料与方法
1.1 一般资料前瞻性观察研究。本研究共选取37例(64眼)患者,男17例,女20例,年龄(15.47±3.81)岁。2021年1月至2021年10月在聊城爱尔眼科医院诊断为HM或SHM的患者,但不伴有病理性改变。 根据平均等效球镜度(MSE)和AL,将患者分为HM组(23例41眼,-9.0 D< MSE≤-6.0 D且25 mm≤AL≤27 mm)和SHM组(14例23眼,MSE≤-9.0 D且AL>27 mm),排除标准包括玻璃体视网膜疾病者、青光眼者、神经系统疾病者、弱视者、有眼内手术史者、视网膜激光治疗或眼外伤者、可能影响眼循环的系统性疾病者。 本研究方案经聊城爱尔眼科医院伦理委员会批准,并在研究开始前取得所有受试者及其监护人的书面知情同意书。
1.2 方法所有患者均接受系统的眼科检查,包括最佳矫正视力(BCVA)、睫状肌麻痹下的屈光状态评估、使用球镜屈光度加1/2柱镜屈光度计算得到MSE、眼压、裂隙灯评估和AL。使用Cirrus HD-OCT 5000(卡尔蔡司医疗仪器有限公司,德国)进行检查,Macular cube 512×128模式采集OCT图像,Angiography 6 mm×6 mm模式采集OCTA图像。 使用Cirrus OCTA软件(AngioPlexTM,卡尔蔡司医疗仪器有限公司,德国)分析所有扫描结果,包括黄斑中心凹无血管区(FAZ)面积。扫描区域自动分区,分区方法与ETDRS分区标准[12]一致,将测量区域划分为:以黄斑中心凹为中心,直径为1 mm、3 mm和6 mm的3个同心圆,分别定义为中心凹、内环区和外环区,并将视网膜厚度、浅层视网膜血管长度密度(SRVD)和浅层视网膜血液灌注密度(SBPD)的内环区和外环区进一步划分为4个扇区进行象限分析(上方、鼻侧、下方、颞侧)(图1)。对各个区域内SRVD和SBPD,直径6 mm完整图像(整体黄斑区)的SRVD和SBPD和视网膜厚度的数值进行分析。SRVD是计算区域内线性的长度与区域面积的比值,主要反映血管数量的变化。SBPD是计算血管管径在区域内的覆盖面积与区域面积的比值,反映血管内的血流灌注量。OCT和OCTA检查均由同一位眼科医生完成。
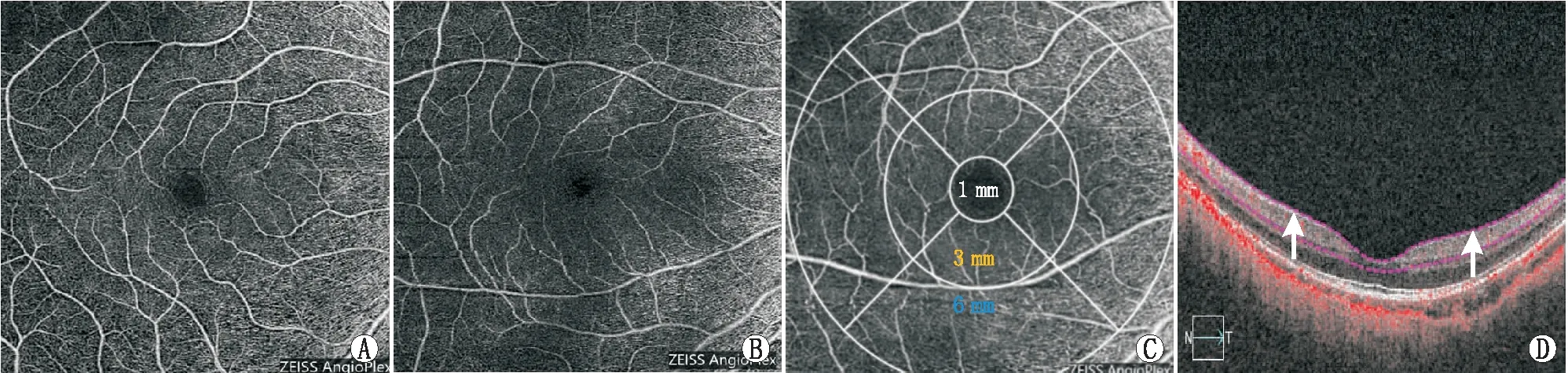
图1 SHM组和HM组患者的视网膜及其分区图 A:HM组患者浅层视网膜;B:SHM组患者浅层视网膜;C:视网膜分区图;D:OCTA示浅层视网膜厚度(白色箭头表示内界膜至内丛状层的测量距离)。
2 结果
2.1 患者一般资料比较HM组共纳入23例(41眼)患者 ,其中男11例,女12例, 年龄为(15.13±4.45)岁,眼压为(14.64±2.17)mmHg(1 kPa=7.5 mmHg),BCVA(logMAR)为0,AL为(25.98±0.51)mm。SHM组共纳入 14例(23眼)患者,其中男6例,女8例 ,年龄为(15.93±3.50)岁,眼压为 (14.0±2.54) mmHg,BCVA(logMAR)为0, AL为(28.10±0.18)mm。 两组患者年龄、性别分布、眼压和BCVA差异均无统计学意义 (均为P>0.05), 但患者AL差异有统计学意义(P<0.05)。
2.2 SHM组和HM组患者SRVD比较分析HM组与SHM组患者整体黄斑区及黄斑中心凹、内环区和外环区SRVD比较差异均有统计学意义(均为P<0.05)。SHM组和HM组患者除外环的鼻侧和下方区域SRVD差异无统计学意义(P=0.072、0.218)外,其余区域SHM组患者SRVD均低于HM组,差异均有统计学意义(均为P<0.05)(表1)。
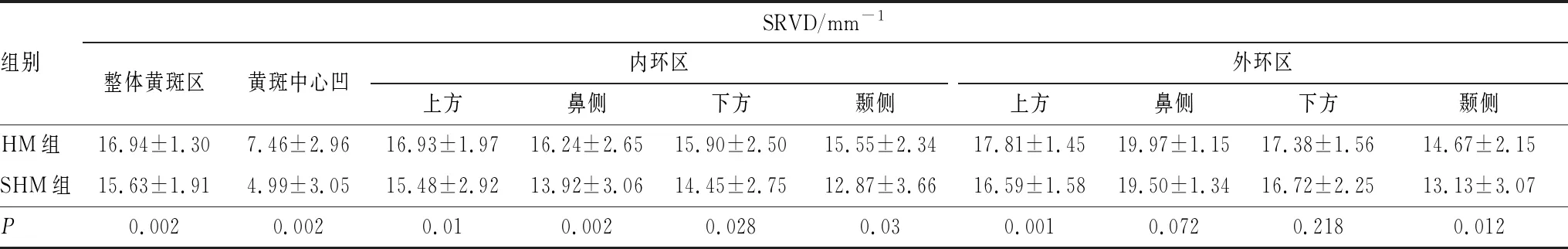
表1 HM组和SHM组患者SRVD比较
2.3 SHM组和HM组患者SBPD比较分析HM组和SHM组患者整体黄斑区、黄斑中心凹、内环区和外环区SBPD比较差异均有统计学意义(均为P<0.05)。SHM组和HM组患者外环区鼻侧和下方SBPD 比较差异均无统计学意义(P=0.210、 0.092),与HM组相比,SHM组患者除内环区下方外的其余区域SBPD均降低,差异均有统计学意义(均为P<0.05)(表2)。
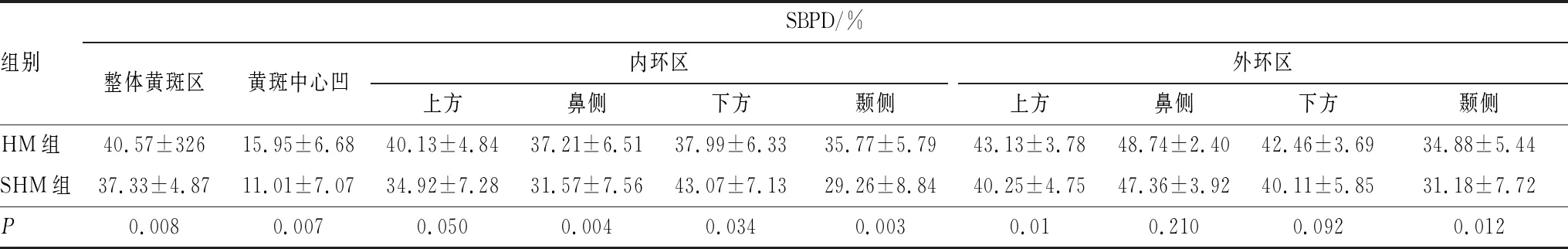
表2 HM组和SHM组患者SBPD比较
2.4 SHM组和HM组患者视网膜厚度和FAZ面积比较分析HM组和SHM组患者黄斑部各区域的视网膜厚度和FAZ面积差异均无统计学意义(均为P>0.05) (表3)。
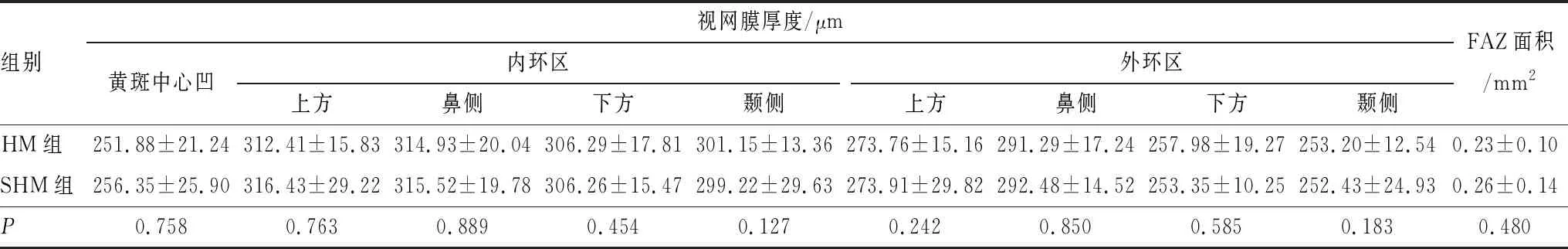
表3 HM组和SHM组患者视网膜厚度和FAZ面积比较
3 讨论
AL>27 mm或近视≤-9.00 D的SHM引起的并发症已成为我国第3类致盲性眼病[13]。 黄斑区是视力最敏锐的区域,并且HM和SHM患者的对比敏感度下降,SHM的视觉质量明显下降[14]。 对近视患者眼底黄斑微循环的研究将有助于揭示近视患者的发生发展机制,为青少年近视的防治提供理论依据。 本研究显示,SHM组患者整体黄斑区及黄斑中心凹、内环区和外环区SRVD和SBPD均明显降低,提示SHM患者更容易发生黄斑病变,进而导致视力下降。 在以往的研究中,近视患者BCVA下降发生前可能已发生眼底结构改变,并可能存在一定程度的光敏感度和视功能损伤[15-16]。Zhang等[17]认为HM患者眼血管内皮生长因子和房水的降低也可能导致毛细血管网丢失。另一项研究也得到类似的结果,年轻HM患者的视网膜微血管减少,而视网膜微血管流速保持恒定[18]。田春柳等[19]在基于OCTA的HM患者黄斑区血管密度的研究中发现,HM患者的黄斑区浅层血管密度随着AL和年龄的增加而下降。本研究结果显示,相对于HM患者,SHM患者因AL增加导致的血管密度下降更为明显。
FAZ的形状和大小改变可引起严重的视觉功能损害, 有研究表明,FAZ参数对视网膜疾病的诊断和预后有重要价值[20]。 FAZ对维持视功能有重要作用,黄斑区视网膜厚度的变化会影响FAZ参数的变化[21]。 Yang等[22]观察到FAZ面积随近视度数的增加和AL的拉长而减少。 FAZ面积大小受许多因素的影响[23]。Golebiewska等[24]发现近视儿童的视网膜浅层血管密度和FAZ均降低。 Yanni等[25]在5~15岁的儿童视网膜测量中发现年龄与黄斑区视网膜厚度显著正相关。刘玉婷等[26]在对不同屈光度青少年近视患者的黄斑血管密度和视网膜厚度的研究中发现,随着近视度数的增加,浅层和深层毛细血管密度均降低,视网膜厚度降低。另一项研究发现,单纯HM进展为病理性近视的过程中,患者会出现近视加深,AL增长,BCVA下降,视网膜厚度和脉络膜厚度下降[27]。本研究中,HM组和SHM组患者视网膜厚度和FAZ的差异均无统计学意义, 可能是因为入组的患者均未发生病理改变,因此,SHM患者视网膜血管密度的降低尚未引起视网膜厚度和FAZ面积的改变,进而能保持视网膜功能和BCVA的稳定。
综上所述,青少年SHM患者的SRVD和SBPD比HM患者明显降低,而视网膜厚度和FAZ改变趋于稳定。 因此,青少年SHM患者在产生病理性病变之前先发生视网膜微循环的变化,最后出现视网膜的厚度变化和FAZ的变化。因此,及时检测青少年SHM患者的眼底微循环和视网膜厚度的变化,并及时进行干预可能会减少病理性近视的发生。
