HP联合MNNG对人食管上皮细胞周期及增殖影响①
2022-06-07李思瑶
雷 毅,张 晨,李思瑶,陈 艳
(1新疆医科大学公共卫生学院卫生毒理学教研室,乌鲁木齐 830011;2嘉兴学院医学院,浙江 嘉兴 314000)
食管癌(Esophageal cancer,EC)是全球八大常见恶性肿瘤之一,我国食管癌发病率居各类肿瘤第5位,病死率居第4 位[1]。幽门螺杆菌(Helicobacter pylori,HP)是一种厌氧型革兰氏阴性菌,主要定居于胃黏膜细胞中并与消化系统相关疾病密切相关。细胞毒性相关因子(CagA)是幽门螺杆菌中特有的毒力因子,Li等[2]发现,在食管癌患者中CagA检出率增高,在食管癌高发地区,食管癌患者中CagA 阳性率高达79.5%,幽门螺杆菌感染可以促进细菌的过度生长和内源性亚硝胺物质的生成,从而促进食管鳞状细胞癌的产生[3]。尽管HP 与胃内相关性疾病的关系已被证实,但其与食管的病变及癌症的关系尚不明确。亚硝胺是一大类具有强致癌性的化学物质,广泛分布于生活中。单功能烷化剂N-甲基-N'-硝基-N-亚硝 基 胍 (N-Methyl-N'-Nitro-N-Nitrosoguanidine,MNNG)是一种常用来诱导细胞癌变的亚硝胺类物质,常被用于食管癌、胃癌等细胞模型和动物模型[4-6]的建立。目前普遍认为癌症是多种因素共同作用的结果,因此采用HP 联合MNNG 染毒人食管上皮细胞,观察多种外界不良因素对细胞增殖及周期的影响,为探索食管癌病因及预防提供依据。
1 材料、仪器及方法
1.1 材料及仪器人食管上皮细胞(HEEC)来自ATCC,幽门螺杆菌标准菌株(ATCC26695)来源于广东省微生物菌种保藏中心。MNNG(上海罗恩)、RPMI 1640(Gibco)、胎牛血清(Gibco)、PBS(Gibco)、胰蛋白酶(Gibco)、巧克力血琼脂平板(郑州安图生物)、细胞增殖试剂盒(MCE)、细胞周期试剂盒(联科生物)、抗体Cyclin B1(CST)、抗体GAPDH(ABclonal)等。酶标仪、倒置荧光显微镜、CO2培养箱、BD 流式细胞仪、厌氧培养箱等。
1.2 方法
1.2.1 细胞培养及细菌培养HEEC 细胞培养采用T25细胞瓶,加入5 mL 含10%胎牛血清和1%双抗的RPMI 1640 培养基,联合感染时采用无双抗培养基,于37℃、5%CO2的细胞培养箱中培养。HP 接种于巧克力血琼脂平板中,放入37℃厌氧培养箱中培养,调整厌氧箱气体浓度至5%O2,10%CO2和85%N2。
1.2.2 HP 浓度测定HP 采用稀释涂布平板法接种于巧克力血琼脂平板中,于厌氧箱内生长3~5 d 后,平板内长出透明针尖状菌落,于超净工作台内用一次性接种棉签轻轻刮取菌落于PBS 中,2500 rpm/min,离心5 min 后,PBS 重悬,紫外分光光度计测其OD660,1OD660=1×108CFU/mL,取感染复数(MOI)=100∶1,即细菌∶细胞=100∶1加入到细胞中。
1.2.3 MNNG 半数抑制浓度(IC50)测定HEEC 细胞正常培养至80%左右,胰蛋白酶消化,采用血平板计数法调整细胞浓度至3×104个/mL,轻轻吹打均匀后,取100µL/孔接种于96孔板,24 h弃去原培养液,采用倍比稀释法配置MNNG 浓度为0、10、20、40、80、120、160、200 µmoL/L 的 培 养 基,染 毒24 h 后 弃 去 含MNNG的培养基,加入CCK8试剂,并计算抑制率。抑制率=[(OD 对照-OD 实验)/(OD 对照-OD 空白)]×100%。
1.2.4 细胞形态学观察 HEEC 细胞分组为对照组、MNNG 处理组、HP处理组以及HP与MNNG 联合处理组(简称联合组),待细胞生长至80%以上时,取出细胞,于超净工作台内PBS 清洗2 次后补加5 mL 培养液,在显微镜下观察并拍照。
1.2.5 细胞增殖测定 细胞分组同上,分别感染1、6、12 h 后,消化离心,并于每孔5000 个接种于96 孔 板,并 设 置4 个 复 孔,24 h 后,每100 µL 培养基加入10 µL CCK8 试剂,37℃孵育1~2 h 后用酶标仪测OD450。
1.2.6 细胞周期测定HEEC 消化计数后以每孔4×104个每孔接种于六孔板,MNNG浓度为1/2 IC50,HP感染复数(MOI)=100∶1,分组同上,分别感染1、6、12 h 后收集细胞,PBS 清洗2 次,70%乙醇固定过夜,离心弃去乙醇,PBS清洗并室温放置10~15 min使细胞水化,然后加入1 mL 1×staining buffer,室温孵育30 min 后,采用最低上样速度上机检测。
1.2.7 细胞周期蛋白Cyclin B1 测定 细胞染毒处理后,胰酶消化并用PBS 重悬,加入裂解液与蛋白酶抑制剂,于冰上裂解30 min,每隔10 min涡旋混匀,裂解完成后离心收集上清。采用蛋白质免疫印迹法(Western blot)检测Cyclin B1蛋白表达量。
1.3 统计学处理应用SPSS21.0 软件进行统计学分析,采用单因素方差分析及趋势性检验,均数两两比较采用LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1 MNNG 对人正常食管上皮细胞IC50值测定不同浓度MNNG 对HEEC 细胞处理后,采用CCK8 法测定其OD450,根据公式计算其抑制率,经计算得出MNNG对HEEC 半数抑制浓度IC50=40.90 µmoL/L,采用1/2 IC50为MNNG染毒浓度。见图1。

图1 不同浓度MNNG对人正常食管上皮细胞的抑制率
2.2 细胞形态学变化经1 h处理后,各组细胞形态未有明显变化,经6、12 h 处理后HP 处理组和联合组细胞形态发生变化,对照组和MNNG 处理组无明显变化,下图为处理12 h 后各组细胞形态。HEEC 细胞正常形态呈梭型(图a),为典型的“上皮样”细胞,细胞大小均匀,长满后呈“铺路石”样排列,细胞边缘清晰,胞质均匀,细胞核位于细胞中心位置。偶见有巨大型细胞,为该细胞株特有,数量在10%左右均为正常。经HP 处理后(图b),可见细胞内胞质紊乱,且伴随有空泡生成,细胞出现“蜂鸟样”变化。MNNG处理后的细胞形态(图c)未发生明显变化。HP 联合MNNG 处理后的细胞形态(图d),出现细胞质不均匀、空泡样变化等。见图2。

图2 不同处理组12 h细胞形态(×200)
2.3 HP 联合MNNG 对人正常食管上皮细胞增殖的影响HEEC 细胞正常情况下生长速度较快,给予HP与MNNG 处理后随着染毒时间的延长,增殖速度减慢。经1、6、12 h 处理后,各组细胞增殖速度差异均有 统 计 学 意 义(F=20.46,P<0.001;F=151.10,P<0.001;F=484.73,P<0.001);经过1、6、12 h 处理时间后,经趋势性检验发现其增殖速度为联合组<HP处理组<MNNG 处理组<对照组(F1 h趋势=1089.3,P<0.001;F6 h趋势=322.78,P<0.001;F12 h趋势=50.01,P<0.001)。随着处理时间的延长,对照组增殖速度无明显变化,其余各处理组增殖速度逐渐变缓,经趋势性检验有统计 学 意 义(FMNNG=65.01,P<0.001;FHP=370.44,P<0.001;F联合=98.46,P<0.001)。见表1。
表1 不同处理组不同时间对人正常食管上皮细胞增殖速度的影响(±s,n=3)

表1 不同处理组不同时间对人正常食管上皮细胞增殖速度的影响(±s,n=3)
注:与对照组相比,**P<0.01;与联合组相比,#P<0.05,##P<0.01。
组别对照组HP处理组MNNG处理组联合组FP 1 h OD值1.04±0.03##0.93±0.07**#0.90±0.01**##0.82±0.02**20.46<0.0016 h OD值1.04±0.02##0.75±0.02**#0.77±0.02**#0.70±0.02**151.10<0.00112 h OD值1.03±0.03##0.69±0.01**0.72±0.01**0.65±0.01**484.73<0.001 F 0.0435.31197.5752.33 P 0.958<0.001<0.001<0.001
2.4 HP 联合MNNG 对人正常食管上皮细胞周期的影响经1 h 处理后,4 组G0/G1、S、G2/M 细胞周期差异 有 统 计 学 意 义(F=22.33,P<0.001;F=11.57,P<0.001;F=11.90,P<0.05),主要为G0/G1 期所占比例的减小与G2/M 期的阻滞;经6 h 处理后,4 组G0/G1、S、G2/M细胞周期差异均有统计学意义(F=133.48,P<0.001;F=4.74,P<0.05;F=39.55,P<0.001),主要为G0/G1期所占比例的减小与S期、G2/M 期的阻滞;经12 h处理后,4 组G0/G1、S、G2/M 细胞周期差异有统计学意 义(F=104.36,P<0.001;F=63.80,P<0.001;F=55.91,P<0.001),此时G0/G1 期所占比例更小,G2/M期阻滞更严重。见表2。随着染毒时间的延长,其周期差异主要表现为G2/M 期的变化,作用时间越长,G2/M 期阻滞越严重,经趋势性检验有统计学意义(FHP=238.76,P<0.001;FMNNG=182.47,P<0.001;F联合=58.43,P<0.001),分别在1、6、12 h 处理后对各处理组的G2/M期阻滞情况进行趋势检验发现呈线性上升趋势(F1 h=32.73,P<0.001;F6 h=70.37,P<0.001;F12 h=125.41,P<0.001),联合组对G2/M 的阻滞效果大于HP和MNNG单独处理组。见图3。
表2 不同处理组不同时间对人正常食管上皮细胞周期变化的影响(±s,n=3)

表2 不同处理组不同时间对人正常食管上皮细胞周期变化的影响(±s,n=3)
注:与对照组相比,*P<0.05,**P<0.01;与联合组相比,#P<0.05,##P<0.01。
实验分组对照组HP处理组MNNG处理组联合组FP 1 h G0/G1/%59.14±0.31##62.12±2.20##48.08±3.03*#39.41±5.17**22.33<0.001 S/%31.88±0.63#26.28±2.17*##35.84±3.3236.52±2.62*11.57<0.001 G2/M/%8.70±0.65##9.07±1.74##12.82±0.54*#16.55±3.15**11.900.0036 h G0/G1/%58.95±0.42##28.30±0.31**30.69±4.11**30.28±0.97**133.48<0.001 S/%29.96±1.77#42.29±0.63**41.07±8.22*39.01±2.76*4.740.003 G2/M/%10.74±1.44##29.12±0.32**25.30±4.00**29.61±2.36**39.55<0.00112 h G0/G1/%58.62±6.93##39.21±2.40**##9.63±1.95**8.05±3.82**104.36<0.001 S/%26.01±4.60##25.44±0.51##48.34±3.12**48.78±1.26**63.80<0.001 G2/M/%10.56±2.43##33.88±2.91**#39.79±1.28**39.53±5.02**55.91<0.001
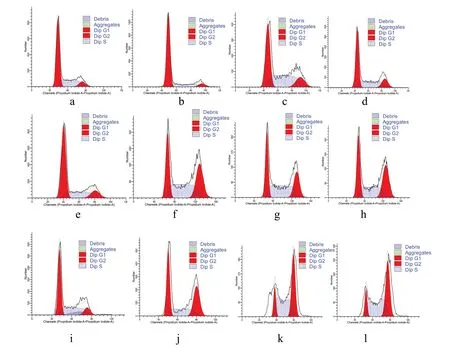
图3 不同处理组不同时间对人正常食管上皮细胞周期影响
2.5 HP 联合MNNG 对人正常食管上皮细胞周期蛋白表达的影响不同组别染毒后,提取蛋白并检测Cyclin B1 蛋白表达量,与对照组相比,其余3 组细胞Cyclin B1 蛋白表达量均显著升高,差异有统计学意义(P均<0.001),以联合组Cyclin B1 表达最高,差异有统计学意义(P<0.001),见图4、5。

图4 不同处理组Cyclin B1蛋白表达量

图5 不同处理组Cyclin B1蛋白表达量的比较
3 讨论
食管癌是在多种因素共同作用下发生的。食管癌的发展是食管上皮细胞在酸性条件下或营养不良,逐渐柱状化,并最终恶化。食管癌发生的危险因素包括吸烟、饮酒、亚硝胺摄入等[7-8],现在越来越多的证据也表明食管微生物失调也可能是食管癌病因的一个潜在危险因素[9]。
在食管癌高发地区的食物和水中检测发现硝酸盐、亚硝酸盐含量显著增高,这些物质摄入后在体内和胺类在酸性条件下生成亚硝胺类。国际癌症研究机构(IARC)得出结论,没有实质性证据表明硝酸盐是动物致癌物[10],但亚硝酸盐与胺或酰胺的结合物已被证明对动物有致癌作用。大多数亚硝胺可通过引起基因突变和DNA 加合物发挥对动物的致癌作用,流行病学证据也表明摄入过多的硝酸盐、亚硝酸盐与食管癌、胃癌等相关疾病[11]的发生呈正相关。MNNG 是一种具有强大的诱变和致癌作用的亚硝基化合物,MNNG具有使真核生物诱变和染色体断裂的能力,与食管癌和胃癌的形成密切相关,并被广泛用来诱导胃黏膜上皮细胞[12]和食管上皮细胞[13]的恶性转化和大鼠胃肠道癌变模型[14-15]等。
幽门螺杆菌(HP)是唯一被认定为人类I 类致癌物的细菌,与胃炎、胃溃疡、胃萎缩和胃腺癌的发生发展密切相关[16]。世界上有超过一半的人口感染幽门螺杆菌[17],并继续传播。虽然幽门螺杆菌主要存在于胃黏膜,但其定植会影响胃和食管的微生物种群,并可能影响食管的癌变。其内部分子机制仅被部分揭示[18],幽门螺杆菌能分泌一些导致慢性炎症和癌症的毒素,例如细胞毒素相关基因A(CagA)、空泡细胞毒素(VacA)和黏附素。其中VacA 可以使被侵入的细胞产生酸性空泡,因此,在幽门螺杆菌处理组和联合组细胞形态发生改变,胞质出现细胞空泡等变化。幽门螺杆菌可以通过激活核转录因子(NF-κB)来促进炎症反应,并诱导某些细胞因子的产生,如IL-1β、IL-2、IL-8 和肿瘤坏死因子(TNF-α),从而触发胃上皮的炎症反应。幽门螺杆菌还可以直接损伤宿主DNA,使DNA 转录因子如尾端同源框2(Cdx2)失调,并诱导上皮损伤和酸分泌功能[19]。
细胞周期(Cell cycle)是细胞生命活动的基本过程,指从细胞分裂开始到下一次分裂结束为止的基本过程,其中DNA 合成和细胞分裂是两个主要事件。随着进一步的研究发现,肿瘤的发生与完整的细胞周期被破坏息息相关。本研究通过对人正常食管上皮细胞HEEC 经过MNNG 和幽门螺杆菌处理,模仿进食亚硝基类化合物和被感染幽门螺杆菌后的人正常食管上皮细胞的周期变化,发现随着处理时间的延长G2/M期出现阻滞,这与先前的相关研究趋势相同,均为联合处理组较为明显[20],结合本次细胞增殖实验说明经过不同处理的各组细胞均对细胞的生长起着一定的抑制作用,并且随着染毒时间的延长,细胞的生长更加缓慢,且联合处理组的生长最慢,提示HP能协同促进MNNG 抑制细胞增殖,促进细胞周期的紊乱。细胞周期蛋白(Cyclin)与周期蛋白依赖性蛋白激酶(Cyclin-dependent protein kinases,Cdks)是细胞周期调控中的重要因子,周期蛋白家族包括(Cyclin)A、B1、B2、C、D1、D2、D3、E、F 等,其中Cyclin B1 是与细胞周期G2/M 期密切相关,当G2/M 期升高时,其含量明显增加,本次研究结果表明细胞处于正常生长状态时,Cyclin B1蛋白表达量较少,HP或MNNG处理后随着G2/M 期阻滞增大,Cyclin B1 的表达量也随之升高,且以HP 联合MNNG 组的Cyclin B1 的蛋白表达量最高。Lin等[12]研究发现幽门螺杆菌联合MNNG 处理后的胃黏膜上皮细胞Cyclin D1 表达明显增高,而单独感染时Cyclin D1 正常表达,提示幽门螺杆菌联合MNNG 能促进细胞周期的紊乱,因此在幽门螺杆菌联合MNNG 处理人食管上皮细胞后,周期紊乱的机制可能与周期蛋白的表达失调相关,其如何影响细胞周期的内在分子机制还需进一步深入研究。
