36型人腺病毒E4ORF1真核表达载体的构建及其促进前脂肪细胞3T3-L1对葡萄糖利用的作用初探①
2022-06-07王冰丽艾柯代姆阿卜杜克热木刘迪晖赵炳尧关亚群
王冰丽,陈 哲,艾柯代姆·阿卜杜克热木,刘迪晖,赵炳尧,关亚群
(新疆医科大学基础医学院生物化学与分子生物学教研室,省部共建中亚高发病成因与防治国家重点实验室,乌鲁木齐 830011)
肥胖症是一种与生活方式和遗传因素密切相关的代谢性疾病,是引起2 型糖尿病、高血压等疾病的重要因素之一,病原微生物感染所引起的肥胖具有其自身特点[1-2]。其中36 型人腺病毒(human adenovirus type 36,Ad36)感染导致人类及实验动物肥胖的现象已被许多国内外研究证实[3-4]。Ad36可以通过增加单核细胞趋化蛋白1(Monocyte chemoattractant protein-1,MCP-1)的表达介导炎症反应,引起机体的肥胖状态[5]。虽然Ad36 感染可引起肥胖,但是Ad36 感染的肥胖患者并未出现血糖、血脂等指标异常升高的现象,提示Ad36 编码的部分基因可能对血糖或血脂有一定调控作用。Ad36 早期基因4 开放读码框1(Early region 4 open reading frame 1,E4ORF1)编码少数氨基酸的蛋白质,Rogers等[6]认为,E4ORF1是Ad36基因组中促进细胞脂质积累及葡萄糖摄取的功能基因[7-8]。本研究拟通过构建Ad36 E4ORF1 的真核表达载体pcDNA3.1-E4ORF1,探究E4ORF1 在前脂肪细胞3T3-L1 中对糖代谢的调节作用,为糖尿病治疗提供新思路。
1 材料与方法
1.1 材料3T3-L1小鼠胚胎成纤维细胞购自中国医学科学院基础医学研究所细胞资源中心;人36 型人腺病毒病毒悬液购自美国ATCC 公司;pcDNA3.1(-)质粒为本实验室保存;限制性内切酶EcoRI、BamHI购自美国Thermo 公司;T4 连接酶购自美国NEB 公司;2×Taq Mix、质粒小量提取试剂盒购自天根生化科技有限公司;DNA 凝胶回收试剂盒购自北京全式金生物;高糖培养基(DMEM)购自以色列BI 公司;胎牛血清购自美国Gibco 公司;EZ Trans II 转染试剂购自上海李记生物公司;TRIzol RNA 提取试剂购自美国Invitrogen 公司;Revert Aid First Strand cDNA Synthesis Kit 逆转录试剂盒购自日本Takara 公司;SYBR Green Real time PCR 试剂盒购自德国QIAGEN 公司;GYS1、FLAG 标签抗体购自博士德公司;HSP90 抗体购自Proteintech 公司;HRP 标记的山羊抗小鼠IgG 抗体购自中杉金桥公司;4%多聚甲醛、ECL发光液购自Biosharp 公司;葡萄糖检测试剂盒、油红O 染液购自南京建成公司。
1.2 方法
1.2.1 E4ORF1 基因扩增 载体构建方法与文献[9]描述的一致,具体如下:根据NCBI GenBank 数据库中Ad36 的基因组序列及注释(GQ384080.1)提取出E4ORF1 的基因序列。利用primer5 软件设计Ad36 E4ORF1 的上下游引物,并在上游引物5'端插入FLAG(DYKDDDDK 肽)标签序列,在上下游引物中分别加入EcoRI 和BamHI 酶切位点和保护碱基序列。E4ORF1 上游引物序列:5'-GAATTCGCCACCATGGATTACAAGGATGACGACGATAAGGCTGAATCTCTGTATGCTTTCATA-3',下游引物序列:5'-CGGGATCCCTAAACCAGGGTGGCTATTCT-3',扩增长度418 bp。待前脂肪细胞3T3-L1 汇合率达80%后,更换不含血清的高糖培养基饥饿2 h 后,加入5 MOI(Multiplicity of infection,病毒感染复数)的Ad36病毒悬液感染1h,更换为含10%胎牛血清的完全培养基继续培养4 d后,利用Trizol 法提取Ad36 感染前脂肪细胞3T3-L1的总RNA,先行反转录成cDNA,再以cDNA 为模板进行PCR 反应,扩增E4ORF1 编码序列。50 µLPCR 反应体系如下:2×Taq Master Mix 25 µL,ddH2O 20 µL,cDNA 模板1 µL,上游引物(10 µmol/L)2 µL,下游引物(10 µmol/L)2 µL。按以下程序进行PCR 扩增:95℃预变性5 min,95℃变性30 s,57℃退火30 s,72℃延伸30 s,共30 个循环,最后72℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳,凝胶成像仪上观察扩增结果,切取含目的片段的凝胶,用DNA凝胶回收试剂盒回收纯化PCR产物。
1.2.2 pcDNA3.1-E4ORF1的构建和鉴定 用限制性内切酶EcoRI 和BamHI 于37℃双酶切PCR 扩增产物与pcDNA3.1(-)空载2 h,琼脂糖凝胶电泳后切胶回收E4ORF1 基因片段和空载片段,用于连接反应。用T4 DNA 连接酶将E4ORF1 基因片段和pcDNA3.1(-)空载片段以1∶3 摩尔比于25℃连接4 h,将连接产物加入到DH5α(感受态细胞)中进行转化,涂布于含氨苄青霉素的LB 固体平板上,37℃培养过夜。次日从平板中随机挑取单克隆菌落,分别接种于5 mL 含氨苄青霉素的LB(细菌基础培养基)中,充分混匀,37℃220 r/min 振荡培养过夜。按照质粒提取试剂盒说明书提取pcDNA3.1-E4ORF1 重组质粒。重组质粒经过限制性内切酶EcoRI和BamHI双酶切鉴定,DNA测序由生工生物工程(上海)有限公司完成。
1.2.3 转染pcDNA3.1-E4ORF1 质粒 将前脂肪细胞3T3-L1 用含10% 胎牛血清和1% 双抗的DMEM 完全培养基,置于5%CO2、37℃恒温恒湿的培养箱内培养。待细胞汇合率达到80%,弃去培养基,每个3.5 cm 培养皿加入200µL Opti-MEM 培养基。按照EZ Trans II 转染试剂说明书将无内毒素质粒pcDNA3.1-E4ORF1 和对照空载pcDNA3.1(-)分别转染细胞,12 h 后同时换为新鲜的完全培养基,置于培养箱中继续培养。
1.2.4 RNA 提取和RT-qPCR 扩增 使用TRIzol试剂提取细胞总RNA,检测RNA 浓度及A260/A280。利用Perlprimer 软件设计引物并由上海生工合成,序列见表1。使用Revert Aid First Strand cDNA Synthesis 试剂盒进行逆转录,应用SYBR Green Real time PCR 试剂盒进行qPCR 扩增,检测以下基因mRNA 水平表达变化。使用(RQ)=2-ΔΔCt计算目的基因相对表达量。

表1 实时荧光定量PCR 引物序列
1.2.5 免疫印迹(Western-Blot)待前脂肪细胞3T3-L1 汇合达80%时,弃去培养基,PBS 清洗3 次,加入100 µL RIPA 裂解液,冰上裂解30 min 后,用BCA 法对蛋白进行定量;使用12%的SDS-PAGE(聚丙烯酰胺凝胶电泳)进行电泳后电转至硝酸纤维素膜,使用5%的脱脂奶进行封闭。将一抗按照Anti-FLAG(1∶5000)、Anti-HSP90(1∶5000)用5%脱脂奶稀释。4℃摇床上,孵育一抗12 h。然后用5 mL TBST 清洗4次,每次5 min;室温摇床,孵育二抗1 h,接着用5 mL TBST清洗4次,每次5 min。用ECL(增强型化学发光液)进行显色,Image J软件进行光密度分析。
1.2.6 培养基葡萄糖浓度检测 前脂肪细胞3T3-L1分别转染pcDNA3.1-E4ORF1 和pcDNA3.1(-)质粒12 h后换液,开始检测培养基中葡萄糖浓度,每隔8 h 测一次葡萄糖浓度直至72 h。取100µL 细胞培养基于1.5 mL EP 管中,1000 r/min,离心10 min。在96 孔板中分别加入200 µL 的底物溶液R1,空白孔中加入2µL的ddH2O,标准孔中加入2µL葡萄糖标准品,样本孔中加入2 µL 待测培养基上清。震荡混匀后,37℃孵育3 min,使用酶标仪测定340 nm 处吸光度值为A1。每孔中加入50 µL 的己糖激酶溶液R2,震荡混匀后,37℃孵育5 min,测定340 nm 处吸光度值为A2。ΔA=A2-A1。计算公式为:葡萄糖浓度(mmol/L)=ΔA(待测)-ΔA(空白)/ΔA(标准)-ΔA(空白)×标准品浓度(mmol/L)。
1.2.7 油红O 染色 分别收取转染pcDNA3.1-E4ORF1后第0、1、2、3、4 天的细胞,用PBS 清洗2 次,加入4%多聚甲醛室温固定30 min,弃去4%多聚甲醛后用PBS清洗2次,加入油红O染色液(试剂储备液与试剂稀释液按5∶2 比例配制并充分混匀),室温静置20 min 后,弃去染液,用PBS 清洗2 次,在莱卡倒置显微镜下观察并拍照。
1.3 统计学处理采用SPSS 26.0 统计软件对数据进行处理和分析,计量资料以均数±标准差(±s)表示,两组间均数比较采用两独立样本t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 pcDNA3.1-E4ORF1 真核表达载体的构建
PCR产物电泳可见约418 bp特异性条带,符合目的基因预期大小(图1A)。将重组质粒进行EcoRI 和BamHI双酶切鉴定,可在5000 bp 和400 bp 观察到特异性条带,片段大小与预期结果完全相符(图1B),表明E4ORF1 基因序列已插入到pcDNA3.1(-)空载。DNA 测序比对结果显示,重组质粒中插入的DNA 序列与E4ORF1基因的编码序列完全一致(图1C),证明成功构建pcDNA3.1-E4ORF1真核表达载体。

图1 pcDNA3.1-E4ORF1真核表达载体的构建及鉴定
2.2 前脂肪细胞3T3-L1 中E4ORF1 对其培养基葡萄糖含量的影响与对照组相比,转染组E4ORF1 的mRNA 和蛋白表达水平均显著增高,差异有统计学意义(P<0.05),见表2及图2A、2B。前脂肪细胞3T3-L1中表达E4ORF13d 后,细胞培养基的颜色变黄(图2C)。与对照组相比,E4ORF1 转染组培养基中葡萄糖浓度随培养时间延长下降更快,从第2天开始两组间差异具有统计学意义(P<0.01)(表3、图2D)。

图2 3T3-L1前脂肪细胞中E4ORF1对其培养基葡萄糖浓度的影响
表2 E4ORF1过表达效率(±s)

表2 E4ORF1过表达效率(±s)
组别对照组E4ORF1转染组tP第1天1.00±0.343.06±0.401.3570.673第2天1.00±0.424.83±0.452.3120.041第3 天1.00±0.546.93±0.562.5730.007第4 天1.00±0.459.45±0.544.3610.005
表3 培养基葡萄糖浓度测定(mmol/L,±s)

表3 培养基葡萄糖浓度测定(mmol/L,±s)
时间第0小时第8小时第16小时第24小时第32小时第40小时第48小时第56小时第64小时第72小时对照组22.71±0.3822.27±0.1620.30±0.4320.46±0.3020.63±0.2918.64±1.2719.77±0.5216.32±1.7315.60±0.3415.12±1.98 E4ORF1转染组22.60±0.3622.72±0.5619.02±0.2518.03±0.7415.52±0.8813.54±0.967.03±1.497.47±0.903.88±1.455.14±0.74 t 1.5871.5321.4901.5971.5641.8544.3922.5763.1382.783 P 0.9820.8710.8230.7820.6550.5280.0050.0070.0060.007
2.3 E4ORF1 对HK2 和GYS1 基因表达的 调节作用
RT-qPCR 和Western-Blot结果显示,与对照组相比,E4ORF1转染组从第2天起,HK2的mRNA 和蛋白质的表达水平均显著上调,在第3、4 天GYS1 的mRNA 和蛋白质的表达水平均显著上调,且差异均有统计学意义(P均<0.05)(表4、图3)。

图3 E4ORF1对HK2和GYS1基因表达的调节作用
表4 HK2和GYS1 mRNA表达水平(±s)
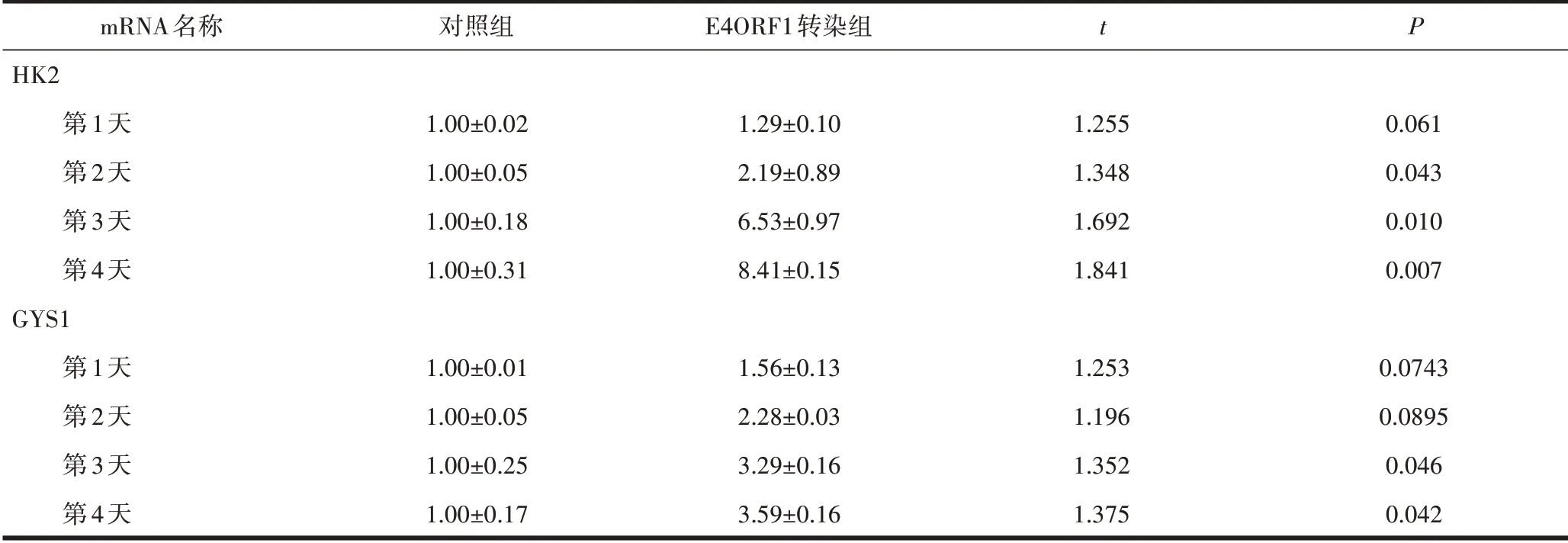
表4 HK2和GYS1 mRNA表达水平(±s)
mRNA名称HK2第1天第2天第3天第4天GYS1第1天第2天第3天第4天对照组1.00±0.021.00±0.051.00±0.181.00±0.311.00±0.011.00±0.051.00±0.251.00±0.17 E4ORF1转染组1.29±0.102.19±0.896.53±0.978.41±0.151.56±0.132.28±0.033.29±0.163.59±0.16 t 1.2551.3481.6921.8411.2531.1961.3521.375 P 0.0610.0430.0100.0070.07430.08950.0460.042
2.4 E4ORF1对前脂肪细胞成脂分化的作用通过油红O 染色观察细胞形态发现,对照组和E4ORF1 转染组第1、2、3、4天,细胞内脂滴并没有随培养天数延长而产生积聚,提示3T3-L1 前脂肪细胞未向成熟脂肪细胞分化(图4)。

图4 E4ORF1对前脂肪细胞成脂分化的影响(×200)
2.5 E4ORF1 对前脂肪细胞成脂分化相关基因PPARγ、C/EBPα、FABP4、FASN、ACC 表达的调节作用RT-qPCR 和Western-Blot 结果显示,与对照组相比,E4ORF1 转染组PPARγ、C/EBPα、FABP4、FASN和ACC 在第1、2、3、4 天的mRNA 和蛋白表达水平均差异无统计学意义(P>0.05)(表5及图5、图6)。

图5 E4ORF1对前脂肪细胞成脂分化相关基因PPARγ、C/EBPα、FABP4、FASN、ACC表达的影响

图6 E4ORF1对前脂肪细胞成脂分化相关基因PPARγ、C/EBPα、FABP4、FASN、ACC表达的影响
表5 前脂肪细胞成脂分化相关基因mRNA表达水平(±s)
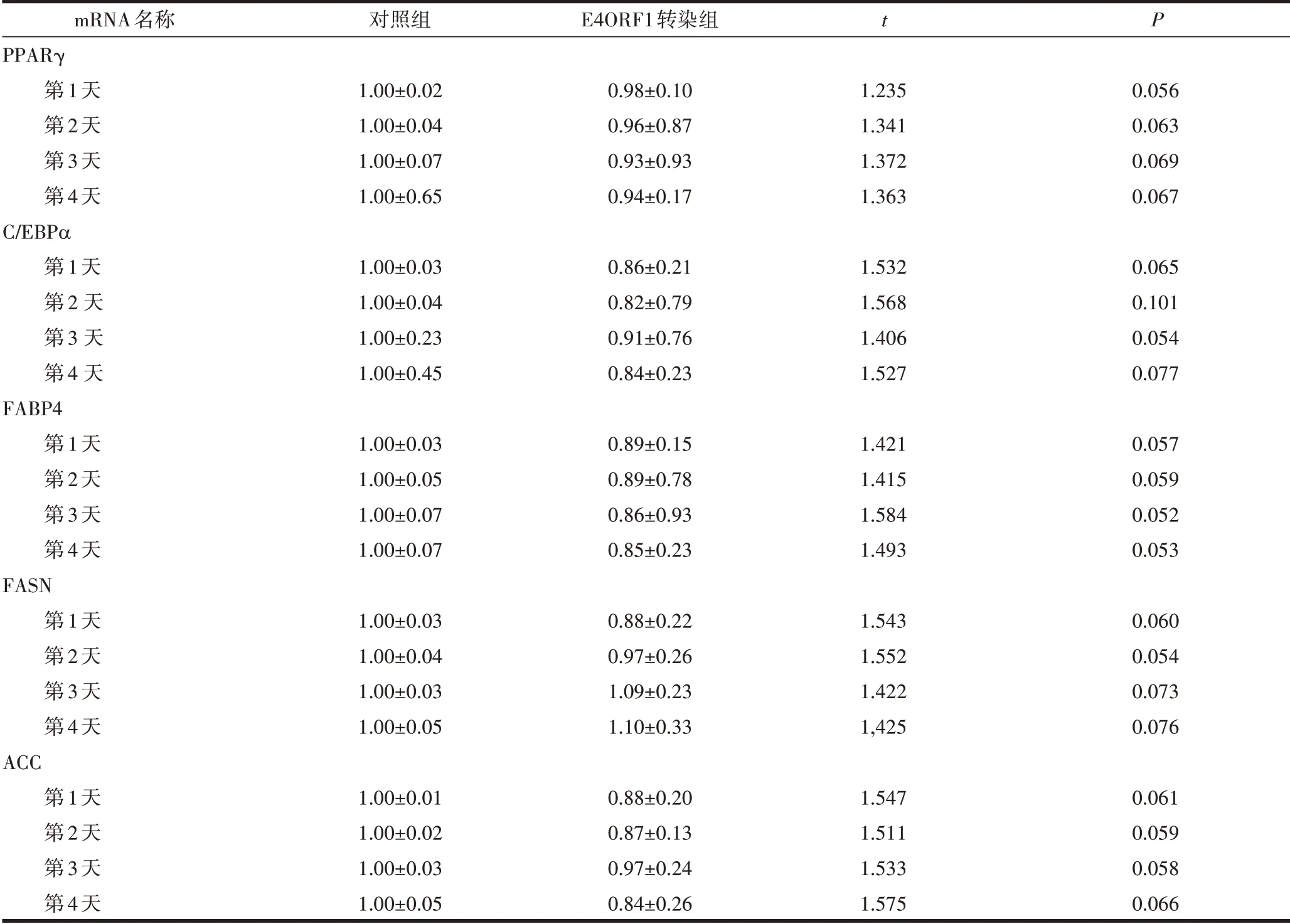
表5 前脂肪细胞成脂分化相关基因mRNA表达水平(±s)
mRNA名称PPARγ第1天第2天第3天第4天C/EBPα第1天第2 天第3 天第4 天FABP4第1天第2天第3天第4天FASN第1天第2天第3天第4天ACC第1天第2天第3天第4天对照组1.00±0.021.00±0.041.00±0.071.00±0.651.00±0.031.00±0.041.00±0.231.00±0.451.00±0.031.00±0.051.00±0.071.00±0.071.00±0.031.00±0.041.00±0.031.00±0.051.00±0.011.00±0.021.00±0.031.00±0.05 E4ORF1转染组0.98±0.100.96±0.870.93±0.930.94±0.170.86±0.210.82±0.790.91±0.760.84±0.230.89±0.150.89±0.780.86±0.930.85±0.230.88±0.220.97±0.261.09±0.231.10±0.330.88±0.200.87±0.130.97±0.240.84±0.26 t 1.2351.3411.3721.3631.5321.5681.4061.5271.4211.4151.5841.4931.5431.5521.4221,4251.5471.5111.5331.575 P 0.0560.0630.0690.0670.0650.1010.0540.0770.0570.0590.0520.0530.0600.0540.0730.0760.0610.0590.0580.066
3 讨论
随着经济的飞速发展和人们生活方式的改变,肥胖症已成为一种全球范围内发病率不断升高的慢性代谢性疾病[10-11]。其中病原微生物感染是引起肥胖的重要原因之一[12-13],以Ad36 引起的肥胖最为典型。研究报道,Ad36 的E4 区基因可读框1(E4ORF1)通过激活磷脂酰肌醇3 激酶(PI3K)/蛋白激酶B(PKB)信号途径,上调远端胰岛素信号通路,增强葡萄糖转运蛋白4(GLUT4)从胞质到胞膜的易位,促进前脂肪细胞对葡萄糖的摄取,并引起脂肪细胞分化[14-15]。体外实验研究表明,在阻断E4ORF1表达后,可以消除Ad36 的成脂以及降糖功能。E4ORF1独特的降血糖功能可能成为治疗2型糖尿病的新思路,而目前对于E4ORF1 调节前脂肪细胞中对糖代谢的作用尚不明确。
为探究E4ORF1 在前脂肪细胞3T3-L1 中对糖代谢及成脂分化的影响,本实验利用分子克隆技术构建E4ORF1 真核表达载体,为后续研究E4ORF1 蛋白的生物功能提供实验基础及思路。本研究在3T3-L1前脂肪细胞中过表达E4ORF1 后发现,E4ORF1 转染组与对照组相比培养基中葡萄糖浓度在第2 天后显著下降(P<0.01)。培养基中葡萄糖浓度降低,培养基变黄,提示细胞对葡萄糖的分解能力增强。己糖激酶2(Hexokinase 2,HK2)是糖酵解途径中的第一个关键酶,其功能是催化葡萄糖磷酸化生成葡糖-6-磷酸,研究发现HK2 的活性降低可以使细胞糖原合成减少,线粒体氧化磷酸化减弱,是最终导致胰岛素抵抗的原因之一[16-17]。糖原合成起始于糖酵解的中间产物葡糖-6-磷酸,糖原合酶1(GYS1)属于糖基转移酶,是糖原合成过程中的关键酶。在本研究中,E4ORF1转染组中HK2和GYS1表达水平均高于对照组(P<0.05)。提示在3T3-L1前脂肪细胞中,E4ORF1可能通过促进HK2 和GYS1 的基因表达,从而参与葡萄糖的吸收并促进糖原合成。本研究结果中E4ORF1 的靶基因HK2 与Thai 等[18]的研究发现一致,E4ORF1 定位于细胞核,并作为转录因子MYC(原癌基因MYC 的蛋白质产物)的辅因子发挥转录激活作用。本研究结果中HK2作为E4ORF1的靶基因,且两者表达水平的一致性和基于腺病毒E4ORF1 基因的高度保守性,推测E4ORF1 可能作为某些转录因子的辅助因子参与基因的转录过程,上调糖酵解相关基因HK2 的表达,进而增强前脂肪细胞3T3-L1 的糖酵解,降低葡萄糖水平。
细胞分化过程中涉及各种转录因子诱导特定基因程序化表达[19-21]。过氧化物酶体增殖物激活受体γ(PPARγ)、CCAAT 增强子结合蛋白α(C/EBPα)是脂肪细胞分化必需的调控因子。脂肪酸结合蛋白4(FABP4)负责游离脂肪酸的转运和储存,其升高与肥胖、胰岛素抵抗和动脉粥样硬化有关[22]。乙酰辅酶A羧化酶(ACC)是以乙酰辅酶A 为底物促进脂肪酸合成的主要限速酶。乙酰辅酶A 可在的羧化作用下生成丙二酸单酰辅酶A(Malonyl Coenzyme A,MA),ACC作为长链脂肪酸合成的二碳单位的供体,可以促进甘油三酯的合成。但本研究中未见细胞成脂分化明显的形态学特征,并在E4ORF1 过表达后4 d 内脂肪细胞成脂分化相关基因PPARγ、C/EBPα、FABP4、FASN、ACC 的mRNA 和蛋白质表达水平均无显著变化(P>0.05)。提示E4ORF1 可能对前脂肪细胞3T3-L1 吸收葡萄糖具有正向调节作用,从而参与Ad36 引起的前脂肪细胞对葡萄糖代谢的调节,而并不足以促进前脂肪细胞的成脂分化。虽然Ad36感染能够引起人和实验动物肥胖已被证实,但脂肪细胞分化是一个多基因共同调控的过程[23],Ad36 引起肥胖的效应可能是其编码的多个基因共同作用引起的。
综上所述,本研究成功构建pcDNA3.1-E4ORF1真核表达载体,在前脂肪细胞3T3-L1 中,E4ORF1 可能通过正向调控HK2 和GYS1 的表达,利于细胞对葡萄糖的分解和利用,而不能促进前脂肪细胞的分化。E4ORF1 对糖代谢调控的作用机制有待进一步深入研究,并为后续可能的肽类降糖功能药物转化奠定基础。
