金雀异黄酮对脂多糖诱导的软骨细胞氧化应激和炎症因子的影响*
2022-06-07王勇麟王哲纬
王勇麟,王哲纬,2,杨 渊,2△
(1.广西医科大学第一附属医院骨关节外科,南宁 530021;2.广西医科大学再生医学与医用生物资源开发应用省部共建协同创新中心,南宁 530021)
骨关节炎(OA)是关节最常见的退行性疾病,致残率较高,其特征为进行性软骨破坏,软骨下骨板增厚,滑膜内不同程度的炎症导致关节僵硬、慢性疼痛和功能障碍[1-3]。活性氧(ROS)在OA的发病中起到关键作用。ROS含量过高时引起氧化应激,激活炎症通路,导致细胞外基质(ECM)降解和炎症发生[4-5]。虽然非甾体抗炎药、阿片类药物等能减轻OA 疼痛,但不能有效治疗OA,并且长期使用有较多副作用[6]。因此,寻找一种可以抑制氧化应激和炎症的OA治疗方法。
金雀异黄酮(化学名称为4',5,7-三羟基异黄酮)广泛存在于大豆、三叶草根及各种水果、蔬菜等天然植物中。豆科植物中金雀异黄酮含量较高,占人类膳食来源异黄酮的60%[7]。天然植物中异黄酮是多酚类混合物,主要包括金雀异黄酮和大豆黄素等。金雀异黄酮的结构与雌激素相似,并具有弱雌激素效应,故又称之为植物雌激素[8]。研究表明,金雀异黄酮具有预防骨质疏松症、降低心血管疾病风险、缓解绝经后症状和抗癌特性[9]。大量研究表明,金雀异黄酮具有抑制细胞凋亡、抑制神经炎症、诱导自噬等作用。但金雀异黄酮在OA中的作用鲜少报道。本研究旨在探讨金雀异黄酮对脂多糖(LPS)诱导的软骨细胞炎症及氧化应激的影响,为金雀异黄酮治疗OA提供实验和理论依据。
1 材料与方法
1.1 药物与主要试剂 金雀异黄酮(纯度≥97%,麦克林,中国);逆转录试剂盒(Fermentas Company,美国);LPS、青—链霉素、细胞计数试剂盒(CCK-8)检测、总RNA 提取试剂盒、番红O 染色试剂盒(Solarbio,中国);Calcein-AM/EthD-I染色试剂(百奥莱博,中国);基质金属蛋白酶(MMP)-13抗体、FITC免疫荧光抗体(博士德,美国);二型胶原酶(Sigma,美国);胎牛血清、DMEM 培养基(Gibco,美国);引物(金开瑞,中国)。
1.2 软骨细胞的提取、培养及鉴定 取3~5 日龄SD大鼠乳鼠(购自广西医科大学实验动物中心),过量麻醉处死,备皮,用75%酒精消毒背部及四肢皮肤,在无菌操作台上剪取双侧股骨头及膝关节(保留周围肌肉,软骨不能暴露),置于含1%青—链霉素的PBS 中,去除软骨周围组织,将软骨剪为1 mm×1 mm×1 mm的小块,胰蛋白酶消化30 min,含2 mg/mL的Ⅱ型胶原酶37 ℃下消化4 h,1 000 r/min离心5 min,收集并重悬细胞于DMEM 培养基,置于37 ℃、5% CO2细胞培养箱中培养。每两天换1 次液,细胞生长密度达到90%汇合度时进行传代,用第3 代细胞进行后续实验[10]。通过番红O 染色法进行软骨细胞鉴定。
1.3 CCK-8 法检测金雀异黄酮的细胞毒性 将软骨细胞按5 000 个/孔的密度接种于96 孔板,培养24 h 后,分别加入含0 µg/mL(对照)、2.5 µg/mL、5 µg/mL、10 µg/mL、20 µg/mL、30 µg/mL、40 µg/mL、50µg/mL、60µg/mL 金雀异黄酮的无血清培养基;继续培养24 h 后弃去原培养基,加入含10%CCK-8的DMEM培养基100 μL,继续避光孵育2 h;用酶标仪检测450 nm 波长处各孔的吸光度(OD)值。计算细胞存活率,细胞存活率=[(实验孔OD值-空白孔OD 值)/(对照孔OD 值-空白孔OD值)]×100%。
1.4 实验分组与处理 将软骨细胞分为空白对照组、模型组和实验组。空白对照组不作处理,模型组用含1µg/mL LPS 的完全培养基进行炎症诱导,实验组用1µg/mL LPS诱导建立软骨细胞炎症模型1 h后,加入20µg/mL的金雀异黄酮干预24 h。
1.5 Calcein-AM/EthD-I 染色检测细胞活性 将细胞接种于放置细胞爬片的6 孔板中,细胞密度约为2×105个/孔。分组处理后在暗室中加入0.05%Calcein-AM 和0.2%EthD-I 染色试剂37 ℃孵育5 min,PBS 清洗3 次,在荧光显微镜下观察细胞的生存情况并拍照,用Image J 软件统计活细胞和死细胞数目,计算细胞增殖率。
1.6 DCFH-DA 荧光探针检测软骨细胞内ROS 水平 避光条件下按1∶1 000的比例用无血清培养基稀释DCFH-DA。收集细胞,悬浮于1 mL 稀释好的DCFH-DA 中,避光处理后放入37 ℃细胞培养箱中孵育20 min。用无血清细胞培养液洗涤细胞3 次,以充分去除未进入细胞内的DCFH-DA。荧光显微镜下观察荧光强度,用Image J软件分析荧光强度的平均值,荧光强度越强,细胞内的ROS水平越高[11]。
1.7 免疫荧光染色检测软骨细胞内MMP-13 的分泌情况 细胞接种于6 孔板中,细胞贴壁80%时用含1 µg/mL LPS 的培养基诱导24 h,弃去孔板中培养基;用PBS 冲洗3 次,4%多聚甲醛固定15 min;PBS冲洗3次,滴加3%过氧化氢孵育20 min;PBS冲洗3 次,滴加适量山羊血清孵育15 min,弃去血清;滴加MMP-13一抗(1∶200)4 ℃孵育过夜,PBS冲洗3 次,加入荧光二抗避光孵育1 h;PBS 冲洗3 次,洗去多余荧光二抗,DAPI染核。荧光显微镜下观察,Image J 软件分析荧光强度。绿色荧光强度越强,MMP-13表达水平越高。
1.8 实时荧光定量聚合酶链式反应(RT-qPCR)法检测炎症基因和软骨特异性基因表达 提取各组软骨细胞总RNA,逆转录为cDNA,进行PCR 扩增。以GAPDH作为内参,检测炎症基因白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α、MMP-13以及软骨特异性基因Col2al的表达。引物序列见表1。采用2-ΔΔCT法计算目的基因相对表达量。

表1 PCR引物序列
1.9 统计学方法 使用GraphPad Prism 8.0软件处理数据,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 金雀异黄酮的细胞毒性 当金雀异黄酮浓度大于40µg/mL 时细胞存活率降至80%以下,金雀异黄酮浓度≤10 µg/mL 时无明显细胞毒性,见图1。因此,选择10 µg/mL 金雀异黄酮浓度进行后续实验。
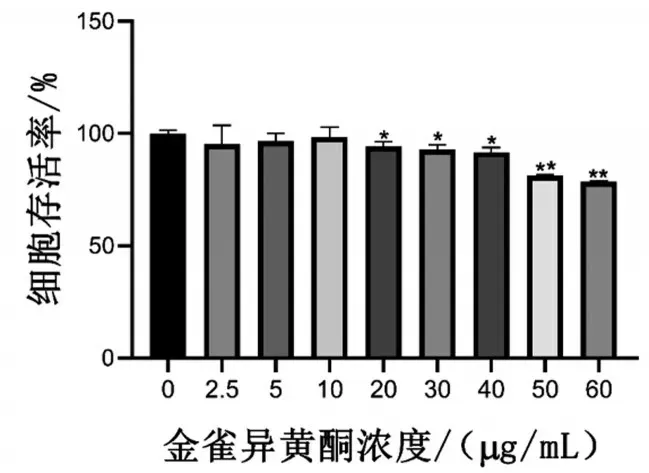
图1 CCK-8检测金雀异黄酮对软骨细胞的毒性作用
2.2 软骨细胞的鉴定结果及金雀异黄酮对LPS 诱导的软骨细胞蛋白多糖的影响 番红O染色中,碱性染料与细胞蛋白多糖结合,使细胞变为红色,细胞具有分泌蛋白多糖的功能,表明提取的细胞为软骨细胞。模型组红色细胞数量较空白对照组减少,实验组红色细胞数量较模型组增多,即蛋白多糖较模型组增多,提示金雀异黄酮能促进蛋白多糖的分泌,见图2。
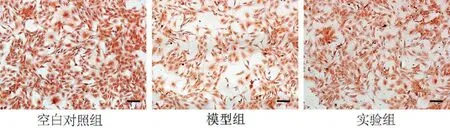
图2 软骨细胞番红O染色图(×100,标尺=400 μm)
2.3 金雀异黄酮对软骨细胞活力的影响 与空白对照组比较,模型组活细胞数量明显减少,死细胞数量增多,细胞增殖率下降(P<0.05);经金雀异黄酮处理后,细胞增殖率升高(P<0.05),见图3。
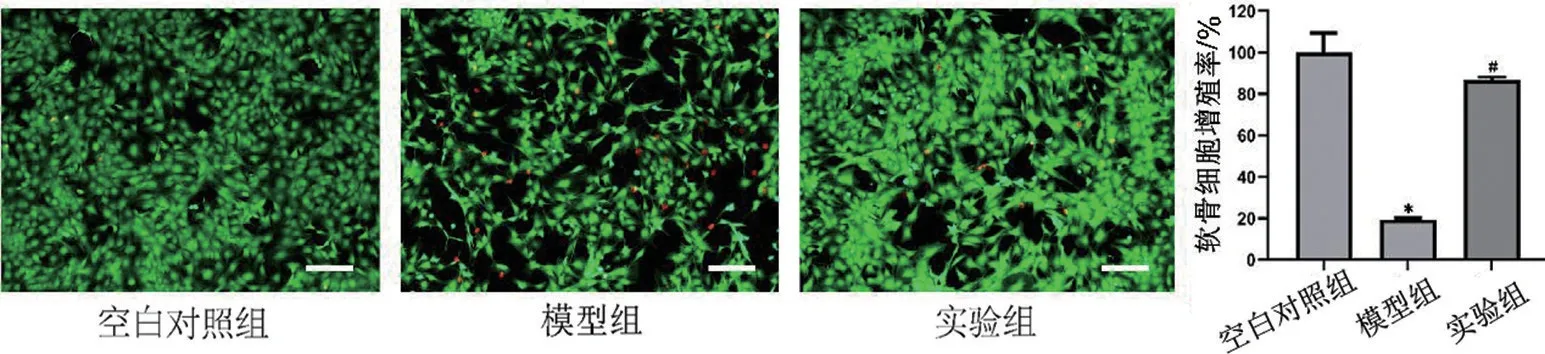
图3 Calcein-AM/EthD-I染色检测软骨细胞活性(×100,标尺=400 μm)
2.4 金雀异黄酮对软骨细胞内ROS 的影响 与空白对照组比较,模型组细胞内荧光强度提高(P<0.05),即软骨细胞内ROS 含量增高;与模型组比较,实验组荧光强度下降(P<0.05),即细胞内ROS含量降低,见图4。

图4 荧光探针检测软骨细胞内ROS水平(×100,标尺=400 μm)
2.5 软骨细胞内MMP-13 表达情况 与空白对照组比较,模型组绿色荧光强度升高,细胞内MMP-13表达升高(P<0.05);与模型组比较,实验组绿色荧光强度降低,细胞内MMP-13 表达降低(P<0.05),见图5。

图5 免疫荧光检测软骨细胞内MMP-13的表达(×100,标尺=400 μm)
2.6 各组软骨细胞IL-6、MMP-13、TNF-α、Col2al基因表达比较 与空白对照组比较,模型组IL-6、MMP-13、TNF-α基因表达上调,Col2al表达下调(均P<0.05);与模型组比较,实验组Col2al表达上调,IL-6、MMP-13、TNF-α基因表达下调(均P<0.05),见表2。

表2 各组软骨细胞IL-6、MMP-13、TNF-α、Col2a1基因表达比较-x±s,n=3
3 讨论
正常情况下,软骨细胞可以分泌大量的蛋白多糖,这些蛋白多糖能够被MMP降解,从而维持细胞支撑力量的循环和平衡;受损的软骨细胞可以分泌过量的MMP,导致上述平衡受到破坏,引起软骨细胞支撑力量缺失,诱导OA的发生[12]。MMP是ECM降解的重要源头,MMP-13能够将Ⅱ型胶原、Ⅰ型胶原和蛋白聚糖等降解,其中Ⅱ型胶原是软骨胶原的主要组成部分,其与蛋白聚糖共同维持软骨的弹性[13]。本研究结果显示,金雀异黄酮能够促进蛋白多糖的分泌,上调软骨细胞中Col2al的表达,抑制OA 软骨细胞中MMP-13 的表达。提示金雀异黄酮可通过抑制ECM降解发挥抗OA的作用。
TNF-α和IL-6等促炎细胞因子在OA中起着重要作用[14]。氧化应激是指机体受到炎症因子等有害刺激后导致机体内抗氧化能力降低,引起ROS的产生增多,从而导致氧化损伤。本研究发现,金雀异黄酮能下调LPS 诱导的软骨细胞IL-6、TNF-α基因表达,同时降低细胞内ROS 水平,提示金雀异黄酮可以发挥抗炎、抗氧化的作用。
综上所述,金雀异黄酮能够抑制炎性软骨细胞的炎症反应和氧化应激,上调软骨特异性基因的表达。这为今后研究金雀异黄酮抗OA的作用机制提供了依据,为OA的治疗提供了参考。
