谷氨酸及其受体在局灶性皮质发育不良模型大鼠大脑皮质中的表达
2022-06-07马勋泰陈林波周莎陶敏冯占辉
马勋泰,陈林波,周莎,陶敏,冯占辉
癫痫是神经内科最常见、最严重的慢性疾病之一,其中局灶性皮质发育不良是导致儿童和成人难治性癫痫的常见原因之一。针对该类型癫痫目前主要采取手术治疗,但普遍术后疗效欠佳。近年来科研工作者一直致力于局灶性皮质发育不良引起癫痫发病的研究,并尝试应用各种方式制作局灶性皮质发育不良的癫痫模型,本课题组也开展了相关工作。神经元兴奋和抑制失衡是皮质发育障碍引起癫痫发作的原因之一。神经元细胞表达神经递质的变化可能在癫痫发作中起到了相当重要的作用,而关于这方面的实验基础研究较为缺乏。可通过查阅文献发现,皮质发育障碍型癫痫微脑回及其周围可能存在兴奋性氨基酸与抑制性氨基酸水平失衡,可通过动物实验观察神经递质特点,分析局部致痫病灶,预测癫痫发作周期。研究抑制神经递质失衡的方法,达到治疗目的。同样通过探索微脑回及其周围神经递质分布特点,为外科手术治疗皮质发育障碍型癫痫提供方案。
1 材料与方法
1.1 动物实验模型的建立
建立局灶性皮质发育不良模型大鼠用于该实验,36只新生 Wistar大鼠(购自陆军军医大学大坪医院动物中心)随机分成手术组、假手术组及正常对照组共3组(各12只)。3组模型大鼠构建成功后均用于免疫组织化学研究。实验方法参照Dvorak和Feit修正方案及其后续改进的方案。手术组大鼠采取低温麻醉,常规碘伏消毒及铺巾,切开额顶处皮肤约0.4~0.6 cm,充分暴露额顶颅盖骨,把经液氮冷冻过的钝形铜针(直径约1 mm)置于额顶颅骨上8 s,以同样的方法在颅骨上形成3处损伤,其中两处损伤连线与颅中缝线平行,间距1.5 mm,术后缝合1针。假手术组采取相同方法,但铜针非冰冻处理,损伤的位点与手术组相同,正常对照组则不采取任何处理,在相同条件下喂养16~18周用于实验。
1.2 主要试剂
亲和纯化兔抗谷氨酸(Glutamate,Glu)、兔抗人、兔、大鼠、小鼠谷氨酸受体NMDAR1,兔抗人、大鼠及小鼠谷氨酸受体GluR2均购于中国武汉博士德生物工程有限公司。
1.3 实验方法
使用4%多聚甲醛PBS液经过心脏灌注后,固定取材,选取大脑中隔区后行石蜡切片,包括海马的层面,每只大鼠共取约10片,每片厚约5 μm,同时行链霉亲合素-生物素-过氧化酶复合物法(strept avidin-biotin-peroxidase complex,SABC 法),做免疫组化时,一抗浓度1∶50。通过肉眼观察和光镜观察大鼠切片标本免疫阳性细胞表达情况,每只大鼠随机取 3 张切片,每张切片取9个视野(3.3×10 倍),分别为小脑回或后肢代表皮质区、前额叶、躯体感觉代表皮质区(Par1、Par2)、海马(CA1、CA2、CA3、DG)及杏仁核。分析小脑回或后肢代表皮质区、前额叶、躯体感觉代表皮质区(Par1、Par2)、海马(CA1、CA2、CA3、DG)及杏仁核免疫阳性细胞的积分光密度值。
1.4 统计学方法

2 结果
2.1 苏木精-伊红染色法
手术组大鼠的大脑皮质具有典型的三、四层大脑皮质结构。但枕部新皮质结构被微脑回分裂开来,失去大脑正常皮层结构。微脑回皮质分层异常,细胞结构混乱,神经元轴突、树突异常。在微脑回周围见巨大神经元、巨大星形细胞和贝茨巨大嗜酸细胞(泡状细胞),皮质下白质也可见巨大的嗜酸性泡状细胞,同侧远离微脑回的海马CA3区亦可见细胞排列紊乱,细胞丢失,而其它海马区未观察到结构和细胞形态的明显改变(图1)。
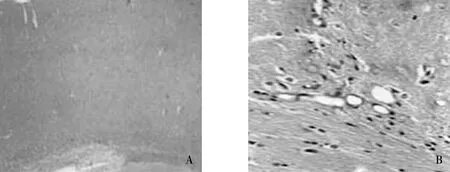
注:A为假手术组(3.3×4倍),B为手术组(3.3×20倍)。
2.2 Glu免疫阳性神经元的表达
3组大鼠大脑皮质和海马Glu免疫阳性着色神经元的表达是普遍存在的。正常对照组和假手术组的大脑皮质第二、三层、梨状皮质层和CA1-CA3区所有锥体细胞以及海马闩都观察到Glu免疫阳性神经元胞质及树突、轴突着色,且神经元胞体着色较深。大脑皮质第五层锥体神经元的胞体和树突可见浓密的神经元免疫阳性着色,而第一、四层和深层皮质及白质免疫阳性细胞最少。微脑回及周围皮质Glu免疫阳性神经元分布主要反映了皮质发育障碍的形态学变化,与正常大脑皮质比较差异小。微脑回及周围皮质:在微脑回皮质里,第一层没有阳性细胞着色,第二、三层仍有浓密的神经元纤维着色。第二层就可以找到朝微沟软膜表面的阳性着色小锥体细胞的树突棘。然而,在发育异常皮质的底侧周围有大量的Glu免疫阳性着色神经元,它们层次不清,树突方向紊乱,且可能找到Glu阳性的巨大锥体细胞。在微脑回皮质周围Glu能神经元数有所增多,而且在微脑回周围Glu阳性着色细胞表达显著增加,其它包括海马、杏仁核等脑区没有明显改变。结果详见表1。
2.3 NMDAR1免疫阳性神经元的表达
3组大鼠大脑皮质可见NMDAR1免疫反应阳性神经元是普遍存在的,在大脑皮质第二、三层和梨状皮质层可见神经纤维着色。大脑皮质二、三、五层和海马闩、梨状皮质、海马CA1-CA3区所有锥体细胞可见密集的神经元着色。而在第一、四层及较深的大脑皮质免疫反应阳性细胞最少。微脑回及周围皮质:在发育障碍的大脑皮质和周围,NMDAR1免疫阳性神经元分布主要反映了皮质发育障碍的形态学改变,与正常大脑皮质比较仅有较小的差异。在上面的大脑皮质层折叠,第二、三层组织有浓密的阳性神经纤维着色,而折叠的第一层未见有阳性着色。在第二层里小锥体细胞正如正常第三层皮质,发现有树突棘指向微沟的软膜表面,然而大量NMDAR1阳性细胞主要分布在微沟底部,细胞无明确的层次结构,树突棘的方向不清。发育异常的大脑皮质NMDAR1免疫反应阳性神经元形态没有多大的改变,微脑回周围NMDAR1阳性着色细胞表达显著增加,其它包括海马及杏仁核等脑区没有显著改变。结果详见表1。
2.4 GluR2免疫阳性神经元的表达
大鼠大脑皮质及海马:GluR2免疫反应阳性神经元胞体主要分布在大脑皮质和海马,在其他另外一些区域很稀疏。正常对照组和假手术组大脑皮质较上皮层或第五层可见层次清楚的免疫阳性着色。正常第六层(正如在灰质白质交界处)示一薄边小非锥体细胞层,为中度着色,在皮质发育障碍的第一层与第二层着色相似,几乎很少免疫阳性细胞着色。微脑回及周围皮质:在微沟底GluR2阳性细胞相对减少,没有检测到免疫阳性神经元。免疫反应巨大的锥体细胞与正常细胞着色相同,但胞体较大。微脑回周围GluR2阳性着色细胞表达显著增加(图2),其它包括海马、杏仁核等脑区没有明显改变。结果详见表1。
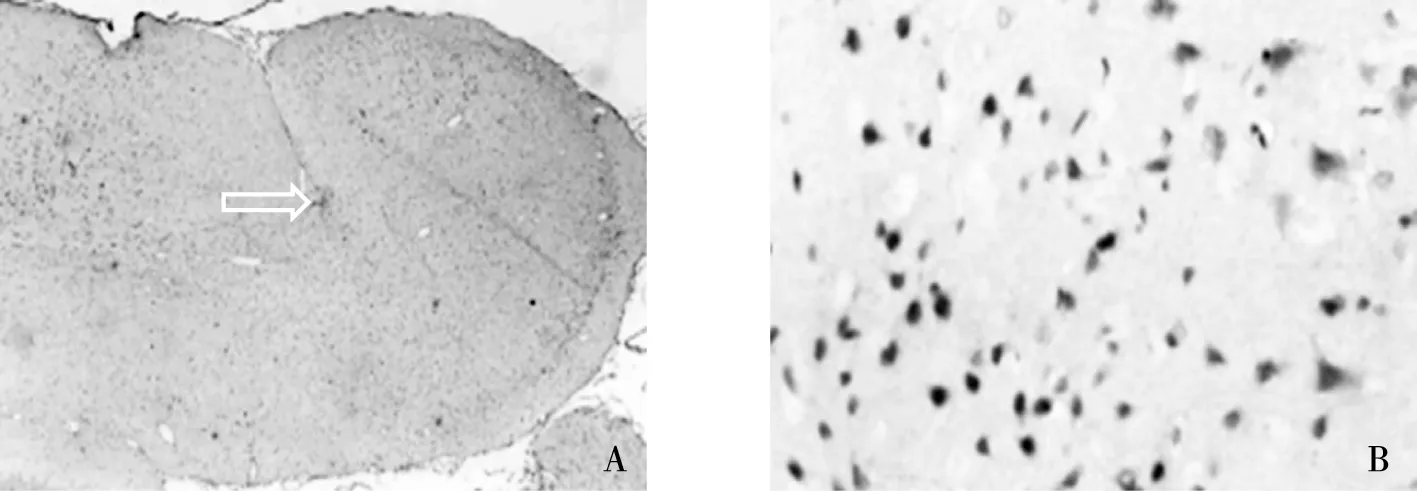
注:A为手术组大鼠大脑皮质损害部位(3.3×4倍),B为GluR2免疫阳性神经元的表达(3.3×20倍)。

表1 3组大鼠大脑皮质不同脑区中Glu和NMDAR1及GluR2的表达水平
3 讨论
局灶性皮层发育不良(focal cortical dyspla-sia,FCD)在临床上和难治性癫痫具有重要联系,尤其是儿童早期起病的药物难治性癫痫,但这并不取决于病变的位置和大小,局灶性皮层发育不良最初由Taylor等于1971年描述,其特征为白质神经元紊乱、层合障碍和球囊细胞异常。目前尚未发现癫痫发作与局灶性皮层发育不良的位置存在一致的相关性,也未发现局灶性皮质发育障碍引起癫痫的具体发病机制。本研究利用液氮探针损伤构建大鼠脑皮质发育障碍模型,通过免疫组织化学方法(SABC法),观察微脑回及其周围免疫组化Glu及NMDAR1、GluR2的表达。其神经组织化学和免疫组织化学染色的重要表现如下:(1
)在手术组、假手术组及正常对照组模型大鼠大脑皮质及海马均可见Glu及NMDAR1、GluR2免疫着色阳性神经元的普遍表达,在手术组可见典型微脑回结构形成;(2
)在手术组大鼠微脑回周围Glu及NMDAR1、GluR2阳性着色细胞表达较正常对照组及假手术组显著增加,正常对照组与假手术组比较差异无统计学意义,其它包括杏仁核及海马等脑区免疫阳性神经元没有显著改变。通过查阅文献,这些结果与相关报道一致,氨基酸及相关受体阳性率表达增加,周围神经元兴奋性也随之增加,意味着癫痫发生率增加。虽然从损伤大脑皮质的变化研究中可以找到一些线索,氨基酸及其受体的含量变化可以为癫痫的发作提供病理基础,在本次研究中观察到微脑回周围的Glu、NMDAR1、GluR2含量有明显的升高,在海马、杏仁核等区域没有显著变化,可以认为微脑回周围高兴奋状态是由Glu水平升高引起,然后在正常神经元与异常神经元之间形成异常放电并以某种方式扩散,本研究可以认为皮质发育不良为异常放电的起始部位,正常的大脑皮层也可能会参与。因此,可以认为微脑回周围兴奋性神经递质(如Glu)及其受体的增加引起兴奋突触机制增强,引起癫痫发作,这可能是微脑回导致癫痫的重要机制之一,同样基因水平、信号传导通路也可能改变。众所周知,AMPA和NMDA受体亚基过表达导致局灶性皮层发育不良神经元刺激状态增加可以诱发癫痫发作,而在大脑皮层中,约70%~80%的神经元为谷氨酸能神经元,Glu和GABA能神经元构建了基本的神经网络,因此,当微脑回皮质周围Glu及其受体发生变化,神经元网络也随之改变。
癫痫的发生是这些未成熟细胞、成熟细胞和神经网络之间相互交流的结果,抑制性和兴奋性神经递质失衡是局灶性皮层发育不良癫痫发生的已知机制。从解剖学方面研究获知,在微脑回区附近有过多的丘脑传入纤维,由兴奋性氨基酸能神经元构成,因此当这部分正常传入纤维缺失时会引起局部微脑回的投射纤维区紊乱和增加,这些为兴奋和抑制平衡的广泛破坏提供了结构基础。有研究认为,在发育不良皮质的兴奋毒性环境中,Glu对癫痫发作的作用不如GABA那么重要;且本研究仅观察免疫组织化学,缺少行为学观察及组织和细胞学观察,这些有待于进一步深入研究。
