临床、CT影像组学及融合模型预测肝细胞癌分化水平
2022-06-07周雪
周雪

摘要:目的:本课题旨在对临床、CT影像组学及融合模型预测肝细胞癌分化水平的可行性进行研究。方法 选取在2020年-2021年我院就诊的100例HCC患者,将其各归结于低分化组(n=56)和中分化组(n=26)高分化组(n=18)三個组别,并以此调查数据进行深入探讨,并作出详细阐述。结果 临床模型评估高、低分化HCC的效力较高,影像组学模型评估高分化与中、低分化HCC的效能较高,融合模型评估高、低分化HCC的效力较高,价值体现存在(P<0.05)。结论 临床、CT影像、融合模型是能够为术前评估HCC分化水平提供有效的辅助工具,在临床上有推广价值。
关键词:肝细胞;癌;细胞分化;影像组学
干细胞癌(HCC)是肝癌的主要组织亚型,占原发性肝癌的90%,是全世界癌症相关死亡率的第三大常见因素[1]。对HCC分化水平的分辨主要通过病理组织学检查评价,因穿刺活检存在并发性危害,目前影像学在肿瘤研究领域显示出新兴潜能[2]。本课堂研究临床、CT影像和融合模型预测HCC分化水平的效力。研究结果如下。
1.资料与方法
1.1一般资料
选取在2020年-2021年我院就诊的100例HCC患者,将其各总结于低分化组(n=56)和中分化组(n=26)高分化组(n=18)三个组别,纳入实验标准:①年龄≥18岁;②病理学诊断为HCC,且分化度显明;③CT检查前未经任何医治,且与穿刺或手术时间距离≤3个月;④CT图像质量符合诊断要求。
1.2方法
采用Siemens Somatom Definition CT机/Philips Brilliance 64排CT扫描仪[3]。嘱患者仰卧,行上腹部轴位CT平扫,扫描参数:管电压120 kVp, 管电流80 mAs, 旋转时间0.5 s/0.8 s, 层间距0/5 mm, 层厚5 mm。之后经肘前静脉以2.0~3.0 ml/s流率注射优维显370对比剂(1.0~1.5 ml/kg体质量),分别于开始注射后30~35 s、60~65 s、120 s采集动脉期、门静脉期、延迟期CT图像[4]。
1.3.统计学处理
调研中所有数据资料均运用SPSS20.0进行专业分析,当中计量资料采用均数±标准差(x±s)表示,两组数据差别比照运用T、x2检测。计数数据使用百分比(%)代替,若两组对照结果P<0.05,则说明实验价值显现。
2.结果
2.1 临床资料
三组成员在年龄、性别、GPT、和ALB数值上均无统计学差异(P>0.05),中、低分化组GOT存在显著差异,中、低分化组PLT存在明显差别,高分化组与中、低分化组AFP差异均具有统计学意义(P<0.05)。见表1。
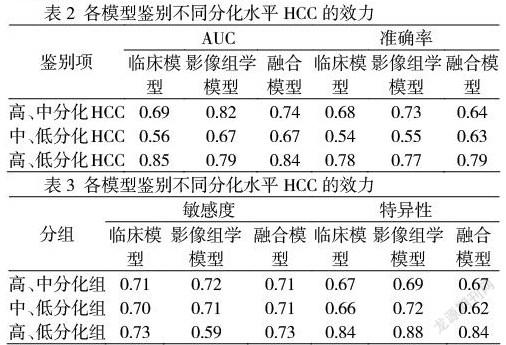
2.2 模型效力
3种模型鉴别中、低分化HCC的效力均一般,临床模型AUC为0.56,影像组学模型及融合模型的AUC均为0.67(P均>0.05),见表2。其中CT影像组学模型鉴别高、中分化HCC,融合模型鉴别高、低分化HCC的AUC最高,分别为0.82、0.84,与其他模型差异均无统计学意义(P均>0.05)。
3.讨论
肝细胞癌是原发性肝癌最常见的类型,而分化程度决定了HCC侵袭性,正是因为低分化HCC容易发生转移,对其有效预测分化程度有助于帮助早期的诊断[5]。综上所述,本课题研究三种术前预测HCC分化水平模型,在运用新型技术可帮助减少扫描时间并提高了准确率。研究得出,临床模型评估高、低分化HCC的效力较高,影像组学模型评估高分化与中、低分化HCC的效能较高,融合模型评估高、低分化HCC的效力较高。可作为术前评估HCC分化水平有效的辅助手段,在临床推广上具有重大意义。
参考文献:
[1] 曾凤霞,刘仁懿,曾辉,陈卫国,秦耿耿.临床、CT影像组学及融合模型预测肝细胞癌分化水平[J].中国医学影像技术,2021,37(07):1029-1033.
[2] 张加辉,徐丽萍,赵志新,郑新成,陈峰.基于MR影像组学及临床特征预测混合型肝癌和肿块型肝内胆管细胞癌术后生存[J].临床放射学杂志,2022,41(02):279-283.
[3] 任静,何泳蓝,李源,曹颖,夏晨,金征宇.基于T2加权成像的影像组学特征和临床特征模型在早期宫颈鳞状细胞癌深间质浸润中的诊断价值[J].协和医学杂志,2021,12(05):705-712.
[4] 韩志强.肾细胞癌多层螺旋CT影像诊断结果的临床分析[J].首都食品与医药,2019,26(19):89-90.
[5] 邓林,高知玲,孙文杰,任涛,杨冠华,高雨佳,邱海静,陈勇.基于临床及MRI影像特征的术前肝细胞癌分化水平预测[J].中华肝胆外科杂志,202,127(07):499-504.E25030CA-B760-4F99-B7D0-08DEC667473C
