共存阳离子对砷、硒和钒毒性效应的影响及预测模型研究
2022-06-06夏冰陈红枫应蓉蓉金淑龚冰季节仇浩
夏冰,陈红枫,应蓉蓉,金淑,龚冰,季节,仇浩
1. 安徽省环境科学研究院,合肥 230071 2. 生态环境部南京环境科学研究所,南京 210042 3. 国家环境保护土壤环境管理与污染控制重点实验室,南京 210042 4. 上海交通大学环境科学与工程学院,上海 200240
在自然界中,虽然大部分金属以阳离子形式存在,也有相当一部分(类)金属以含氧阴离子形式存在。其中,砷(As)是世界范围内普遍存在的含氧阴离子型金属。近年来,它所引发的环境污染问题受到人们的广泛关注。As主要通过各种金属开采与冶炼、农药喷洒以及木材防腐剂的施用等人为活动进入并污染土壤环境[1]。据报道,As在全球土壤中的平均浓度为5 mg·kg-1,在土壤溶液中可达171 μg·L-1[2]。据《全国土壤污染状况调查公报》显示,我国土壤污染总体状况堪忧,总超标率为16.1%,其中As的点位超标率达2.7%,仅次于Cd(7.0%)和Ni(4.8%)[3-4]。As一旦进入食物链就可能引起公共健康问题[5]。研究表明,在人口稠密的地区(尤其是南亚地区),由于饮用水和地下水受到天然来源的As污染,当地居民处于As暴露引发的高环境风险中[6]。与As不同,Se是从藻类到哺乳动物等许多生命体代谢所需的微量元素[7]。环境中Se的来源可分为自然源(如火山喷发、岩石风化等)和人为源(如含Se煤炭或石油的燃烧等)2类[8]。全球土壤中的Se浓度通常为0.05~1.5 mg·kg-1,具体含量取决于土壤特性[9]。以中国中部地区土壤为参考,土壤溶液中的Se浓度为0.51~27.64 μg·L-1[10]。我国幅员辽阔,土壤Se含量分布不均,出现了既有缺Se相关疾病(大骨节病与克山病等)的高发区,又有Se中毒相关疾病的高发区[11]。此外,V也是一种常见的阴离子型金属,与As和Se相比,V是三者中自然丰度最高的(类)金属。V在上层地壳中的平均含量大约为97 mg·kg-1[12],在欧洲典型土壤溶液中为0.1 mg·L-1[13]。土壤V污染主要来自于采矿冶炼、化石燃料燃烧、化肥和农药的施用等人为活动[14]。在中国西南部采矿和冶炼地区的V污染土壤中,其含量高达4 794 mg·kg-1[15]。以As、Se和V为代表的阴离子型金属在土壤中不断累积,对生态环境安全乃至人体健康造成的危害不容小觑。因此,亟待研究阴离子型金属的生态毒性效应机制及影响因素并建立相应的预测模型,这对于建立有关环境质量标准和风险评价体系具有非常重要的意义。
在土壤中,阴离子型金属的毒性受到了多种环境因素的影响,其中土壤溶液中的共存阳离子是阴离子型金属毒性的一类重要影响因素[16]。在含有Ca2+、Mg2+、Na+和K+的硬水中,Se、Sb、Cr、Mn、V、Mo和W对淡水端足虫(Hyalellaazteca)的毒性均高于不含这些阳离子的软水,而软水中As毒性却更大[17],可见共存阳离子对于阴离子型金属毒性的影响并不一致。另外在土壤体系中,Ca2+可通过与V形成难溶性钙盐的方式降低V的迁移性与生物有效性[18]。Mg2+、K+和Fe3+主要通过调节细胞解毒代谢过程和改变细胞膜强度等途径间接影响V毒性[19]。目前,对共存阳离子在As、Se和V毒性中发挥的作用仍知之甚少[20]。由于转运通道和结合点位的不同,共存阳离子与阴离子型金属之间一般不存在明显的特异性竞争关系,阳离子更多是通过非特异性或间接的方式影响其毒性,并无定论。在自然环境介质条件下,几乎所有生物的细胞质膜和细胞壁膜表面都带有负电荷,这是由于细胞膜蛋白上的氨基酸残基、膜磷脂的磷酸基团及细胞壁果胶上的羧酸等基团水解造成的。这些电荷在质膜外表面形成的电势称为质膜表面电势,用φ0(通常小于0)表示[21],这会导致外部溶液中的共存阳离子与质膜表面因为静电作用产生吸引力,从而改变φ0,进而影响细胞质膜表面的自由金属离子活度[22-23]。研究发现溶液中共存阳离子(Al3+、Ca2+和Mg2+等)的增加会通过静电作用降低小麦(TriticumaestivumL.)根部φ0从而加剧As和Se的毒性,而这种对表面电势的改变程度更多取决于非特异性的阳离子电荷量[24-25],静电作用可以很好地解释共存阳离子对阴离子型金属毒性的影响。
Kinraide[21]、Wagatsuma和Akiba[26]将质膜表面电势效应对毒性的影响纳入考虑,构建了能够有效预测金属毒性的静电作用模型(electrostatic toxicity model, ETM)。近年来,已有越来越多的研究从φ0角度考虑了离子之间的交互作用及其与生物效应之间的关系。例如在水培和土壤体系中,学者发现φ0在Ni2+对大麦的毒性中起着“双重作用”。首先,由于添加了Ca2+、Mg2+和H+等,φ0的电负性降低,从而降低了细胞质膜表面的Ni2+活度。其次,通过添加阳离子,φ0可能会增加细胞质膜表面的跨膜电位差,这是跨膜吸收Ni的驱动力。因此,Ni的毒性是膜表面电势φ0引起的双重作用的结果[27]。Kopittke等[28-29]利用ETM模型成功解释了不同暴露介质中Cu、Pb和Mn的毒性效应。Wang等[30]也验证了静电作用理论对Cu、Ni、Zn和Mn等多种金属毒性预测的适用性。尽管在阳离子型金属毒性预测方面,ETM模型已被证明是行之有效的[31-32],但此模型对阴离子型金属是否有效尚待研究。

1 材料与方法(Materials and methods)
1.1 实验设计及测试溶液配制
本研究所用试剂除特别说明外,均购自国药集团化学试剂有限公司,级别为分析纯试剂。

取一定量储备液,并用营养液(含0.2 mmol·L-1CaCl2和5 μmol·L-1H3BO3)稀释定容以得到不同浓度组合的测试溶液。所有测试溶液在小麦毒性暴露实验开始前24 h内,用稀盐酸或氢氧化钠溶液将pH调节至6.0±0.1,以0.75 mg·L-12-(N-吗啉代)乙烷磺酸(MES)溶液为缓冲溶液。之所以将测试溶液的pH控制在6.0左右,一方面是由于弱酸性环境(pH 5.0~6.0)有利于植物的生长[31],另一方面是由于许多相关研究中pH均为6.0,使用相同的pH值有利于研究结果的比较和外推[23, 27, 31]。
1.2 毒性测试
种子萌发和幼苗生长是作物响应外部环境胁迫的开始,也是作物对外界刺激最敏感的时期。作为陆生生态毒理学研究中常见的模式植物,小麦幼苗的毒理实验可为金属污染早期诊断提供有效数据[23]。因此,本研究参照ISO标准(111269-1)进行小麦根伸长毒性试验[34]。取适量小麦(TriticumaestivumL.)种子(品种为NAU 9918,购买于南京农业大学),在1%的次氯酸钠溶液中浸泡消毒15 min。用去离子水清洗数遍以去除残留的次氯酸钠后,将小麦种子在预先配制的小麦催芽浸种营养液中浸泡4 h以保证后续种子能够均匀发芽。催芽浸种营养液为调整后的Hoagland溶液,具体配方为0.3 mmol·L-1Ca(NO3)2、0.2 mmol·L-1MgSO4、1.2 mmol·L-1KNO3、15 mmol·L-1H3BO3、5 μmol·L-1KH2PO4、0.07 μmol·L-1(NH4)6Mo7O24、5 μmol·L-1MnSO4和10 μmol·L-1C18H16FeN2NaO6(EDDHA-FeNa)。随后小麦种子移入铺有湿滤纸的发芽盘中,在20 ℃无光照的条件下发芽约60 h,期间喷洒催芽浸种营养液以保持湿润。待小麦种子根部长至1.0~1.5 cm,将其移入装满提前配制的不同浓度培养溶液的250 mL玻璃烧杯中,用剪口的封口膜将种子固定在杯口液面附近,以保证小麦根部充分浸润在培养溶液中且其他部位不与溶液接触。每个250 mL烧杯放置4颗种子,且烧杯用铝箔纸包裹外壁以避免光照,从而模拟真实土壤环境。每一种暴露条件设计3个平行样本,即3个装满培养溶液烧杯,共计12颗种子。随后将种有小麦的烧杯移入人工气候箱(RXZ-1000F-4型,浙江省宁波市新江南仪器有限公司)进行为期4 d的急性毒性暴露实验[34],培养条件设置为温度20 ℃、湿度75%、昼夜循环16 h∶8 h以及光照强度52 000 lx。
暴露结束后测量每株小麦的最大根伸长。以每个影响因子浓度各自对照组的平均最大根伸长为对照,计算相应的相对根伸长(relative root elongation, RRE)作为本实验的毒性指示终点,计算方法如公式1所示。
“自采”的仅计算基本直接费,“他采”的还应计算相关费用、利润及税金。考虑到这两种情况下主承包人的成本支出差异,应同时制定这两种情况下的混凝土工程费率,“自采”的比“他采”的要高些。
(1)
式中:REA为测试组同一烧杯中4株小麦最大根伸长的平均值(cm);REC为对照组同一烧杯中4株小麦最大根伸长的平均值(cm)。
1.3 化学测试与形态分析
测试溶液中As、Se和V这3种阴离子型金属与影响因子Ca、Mg、Na和K的总浓度由电感耦合等离子体发射光谱(ICP-OES,iCAP7600,Thermo Fisher)进行测定。ICP-OES的工作参数为射频功率1 150 w、雾化器流量0.70 L·min-1和辅助器流量0.50 L·min-1,As、Se和V的检出限分别为0.03、0.06和0.003 μg·mL-1,加标回收率为96.5%~102.1%。所有溶解浓度表述为[M]diss。暴露实验前后培养溶液的pH值由pH计(pH510型,上海安莱立思仪器科技有限公司)测定。
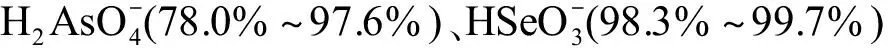
1.4 数据分析与建模
1.4.1 剂量-毒性效应模型
污染物剂量与其毒性效应之间的数量关系常用Logistic公式进行拟合,本实验用相对根伸长RRE作为毒性效应指标。本研究中采用的Logistic公式描述如下:
(2)
式中:xi为剂量表达方式,本实验中为自由离子活度和质膜表面金属活度;xi50为半数有效剂量,在引起根伸长相比对照值减小50%时的金属剂量;β为斜率参数。
1.4.2 静电作用模型(ETM)
该模型基于植物根部质膜表面带负电这一原理,认为带负电的质膜与阴、阳离子之间的排斥、吸引会改变φ0,从而使质膜表面真实的金属自由离子活度与外部溶液中的不同,所以质膜表面的自由金属离子活度更能准确反映金属毒性。基于此原理,本实验中共存阳离子易被吸引到质膜表面从而降低φ0,影响阴离子型金属在质膜表面的浓度及其毒性。

表1 单一变量控制实验测试溶液浓度设计Table 1 The concentration sets of test solutions for univariate experiments
φ0可由Kinraide[21]提出的计算公式或相关计算软件Gouy-Chapman-Stern(SGCS)[35-36]获得,本研究中φ0通过在线SGCS程序(http://www.uq.edu.au/agriculture/sgcs/)计算得到。已知φ0后,质膜表面的自由金属离子活度可由能斯特方程求出,如公式3所示。
(3)
式中:{M}0为质膜表面的阴离子型金属活度;{M}为外部溶液中的阴离子型金属活度(即形态计算求出的活度);Z为电荷数;F为法拉第常数(C·mol-1);φ0为质膜表面电势(V);R为气体常数(J·mol·K-1);T为实验温度(K)。
剂量-响应曲线由Origin 9.0软件进行拟合,其拟合度(Adj.R2)可以反映该剂量能否准确预测毒性效应;斜率参数(β)、半数有效浓度(EC50)值(xi50)可通过基于全局拟合的多元非线性回归方法得到,拟合时使均方根误差(RMSE)最小。其中xi50代表了该污染物的毒性大小,可用于本研究中3种阴离子型金属毒性大小的比较。
2 结果与讨论(Results and discussion)
2.1 共存阳离子对As、Se和V毒性的影响
决定金属毒性的一个重要方面是其生物有效性,而环境中金属的形态与其生物有效性和毒性有直接的关系,金属总浓度不能作为指示其潜在毒性效应的有效指标[37]。基于溶解态金属浓度造成的毒性影响可能小于实际的毒性效果,即金属的溶解态浓度也不足以解释实际的毒性效应[38]。自由离子态金属被证明是水体和土壤孔隙水中具有生物有效性和产生毒性作用的主要形态[39]。因此,本研究中我们均采用自由离子活度为剂量表达方式进行分析。通过单一变量控制实验得到了关于环境共存阳离子Ca2+、Mg2+、Na+和K+对As、Se和V毒性影响的实验结果,如图1所示。

在本研究中,我们计算了φ0与其表面Ca2+、Mg2+、Na+和K+活度之间的关系(图2)。在空白对照组中(无As、Se和V),当CaCl2的添加范围为0.2~15 mmol·L-1时,φ0从-41.5 mV增大到-10.1 mV;当MgCl2的添加范围为0.2~4 mmol·L-1时,φ0从-42.1 mV增大到-22.2 mV;同样,对于Na组,当NaCl的添加范围为0~16 mmol·L-1时,φ0从-41.9 mV增加到-32.5 mV。当KCl的添加范围为1.2~9.6 mmol·L-1时,φ0从-42.8 mV增加到-34.1 mV。在4种共存阳离子中,Ca2+的引入最大程度地降低了φ0的电负性,使得质膜表面对阴离子型金属的排斥力减小从而增大质膜表面的自由离子活度、增大毒性。这种对表面电势电负性减小的作用还存在“双重效应”[30],会使得离子跨过质膜的驱动力同样减小,导致阴离子型金属毒性减弱。此外,Ca2+作为植物必需营养物质还可强化细胞壁、稳定细胞膜[47],也可通过调节抗氧化酶或抗氧化物质从而提高质膜对氧化损伤的抵御[48],也即Ca2+能通过提高植物自身耐受性减弱金属的毒性。值得注意的是,这几种原因均为非特异性的作用,会导致Ca2+对阴离子型金属毒性的影响有不同的可能性,这可以解释Ca2+对于As、Se和V毒性全然不同的影响(图1(a)、(e)、(i))。和Ca2+相同,Mg2+对于阴离子型金属毒性的影响也具有非特异性作用,即通过减小φ0的电负性增加质膜表面阴离子金属活度,使毒性加剧;同时减小跨膜驱动力,导致毒性减小。不同的是,Se(Ⅳ)在低浓度下是植物生长的微量营养元素,Se(Ⅳ)与Mg吸收之间存在正相关关系[49],这可能会导致Mg浓度增加时Se吸收量和毒性也随之增加。而Na+与K+的加入对As、Se和V三者的毒性均没有显著影响,这可能与一价阳离子的引入对φ0的改变不大有关。

图1 不同共存阳离子自由活度与阴离子型金属毒性(半数效应浓度值)的关系注:(a)~(d) As;(e)~(h) Se;(i)~(l) V。Fig. 1 Relationships between the median effect concentration values of anionic metals and free ion activities of coexisting cationsNote: (a)~(d) As; (e)~(h) Se; (i)~(l) V.
2.2 静电作用模型预测共存阳离子影响下阴离子型金属毒性
根据ETM原理,溶液中的共存阳离子被吸引到原本带负电的植物根部表面后,会降低表面电势从而减小对阴离子的排斥,增大阴离子在质膜表面的浓度,因此,阴离子型金属的毒性理论上应随环境共存阳离子浓度的增大而增大。而事实上,本研究仅在V-Ca组与Se-Mg组中观察到了共存阳离子的加入显著增强了阴离子型金属的毒性。因此,我们针对符合静电作用理论的V-Ca组与Se-Mg组进行表面电势与质膜表面金属阴离子浓度的计算,构建相应的ETM分别对Se和V的毒性进行定量预测(图3)。由图3可知,实线代表基于同一处理组中所有数据拟合得到的Logistic回归曲线。结果显示,分别将Mg2+对{Se}0的影响以及Ca2+对{V}0的影响纳入考虑所构建的ETM可以实现Se(Adj.R2=0.95)和V(Adj.R2=0.88)毒性的定量预测,静电作用理论能够成功地解释Mg2+(或Ca2+)在加剧Se(或V)对小麦毒性中发挥的作用。Se-Mg与V-Ca的剂量-响应曲线导出的EC50值分别为9.33 μmol·L-1和42.49 μmol·L-1(以质膜表面活度表示)。由于质膜表面对阴离子的排斥,质膜表面的阴离子活度比溶液中的活度小,因此这2个EC50值相比于以自由离子活度表示的EC50值也更小。对于包括植物根部在内的大多数生物体而言,阴、阳离子进入细胞的通道不同且几乎不重合,相比之下,阳离子通道的选择性更高(如钙离子通道、钠离子通道等),而阴离子通道则未见对于含氧阴离子各形态选择性的报道。正是由于阴离子型金属与环境共存阳离子之间缺乏特异性的交互作用,使得环境共存阳离子与阴离子型金属毒性之间的影响关系难以定性为竞争等交互关系并进行定量计算,而只能对非特异性的作用进行描述。
图2 质膜表面电势(φ0)与Ca2+、Mg2+、Na+和K+活度之间的关系Fig. 2 The correlation between the calculated plasma membrane surface potentials (φ0) and the activities of Ca2+, Mg2+, Na+, and K+
整体而言,ETM模型基于φ0和质膜表面的金属离子活度,揭示了质膜表面电势的静电效应是共存阳离子缓解阳离子型金属毒性和加剧阴离子型金属毒性的主要作用机制,该模型在阳离子型和阴离子型金属毒性预测方面均具有一定潜力,是研究金属离子生物毒性的有效工具。值得注意的是,本研究所构建的ETM模型是基于短期暴露实验所获得的阴离子型金属毒性信息,其对长期暴露下该金属风险评估的适用性有待进一步研究。
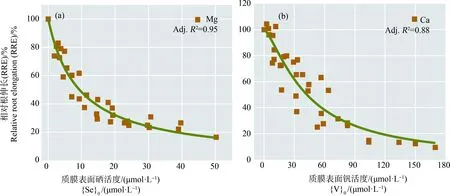
图3 质膜表面活度与相对根伸长(RRE)之间的剂量-响应曲线注:(a) Se-Mg;(b) V-Ca。Fig. 3 Dose-response curves between metal(loid)s activities at the plasma membrane and relative root elongation (RRE)Note: (a) Se-Mg; (b) V-Ca.

(1) 首先明确了阴离子型金属As、Se和V毒性的主控环境因子。在Ca2+、Mg2+、Na+和K+中,Ca2+显著降低了As毒性,显著增加了V毒性,对Se毒性无显著影响;Mg2+显著增加了Se毒性。Ca2+对As、Se和V毒性的这3种全然不同的影响可能是以下3个方面因素综合作用的结果:由于Ca2+减小了原本带负电的质膜表面的电势,使得质膜表面对阴离子型金属的排斥力减小从而增大其在质膜表面的活度、增大毒性;这种对表面电势电负性的减小作用还存在“双重作用”会使得离子跨过质膜的驱动力同样减小,导致阴离子型金属毒性减弱;Ca2+作为植物必需营养物质可强化细胞壁、稳定细胞膜,也可通过调节抗氧化酶或抗氧化物质从而提高质膜对氧化损伤的抵御。
(2) 针对符合静电作用理论的V-Ca组与Se-Mg组进行表面电势与质膜表面阴离子型金属活度的计算,成功构建了能够定量预测Mg2+共存时Se毒性以及Ca2+共存时V毒性的静电作用模型。
阳离子型金属毒性及其影响因素研究广泛,但是针对阴离子型金属毒性的相关研究仍较为匮乏,我们的研究结果为阴离子型金属毒性的量化预测提供了新思路,为建立阴离子型金属污染土壤环境质量标准与风险评估体系提供了科学依据。
通讯作者简介:应蓉蓉(1984—),女,博士,副研究员,主要研究方向为生态毒理学。
共同通讯作者简介:金淑(1992—),女,博士,助理研究员,主要研究方向生态保护与农村环境。
