纳米银诱导细胞自噬的分子机制和生物效应
2022-06-06侯巧利汪毅宁赵晓旭吕源财
侯巧利,汪毅宁,赵晓旭,吕源财
1. 福州大学环境与资源学院,福州 350108 2. 莆田学院环境与生物工程学院,莆田 351100 3. 福建省新型污染物毒理效应与控制重点实验室,莆田 351100 4. 生态环境及其信息图谱福建省高等学校重点实验室,莆田 351100
随着纳米技术的迅速发展,具有高效抗菌性能的纳米银(silver nanoparticles, AgNPs)在食品包装、纺织品、化妆品和生物医学等领域有着较为广泛的应用[1-3]。然而大量研究表明,AgNPs能诱导细胞产生活性氧(reactive oxygen species, ROS),导致细胞引发线粒体损伤、DNA损伤乃至细胞凋亡[4-6]。随着对AgNPs生物毒性的深入研究,越来越多的报道表明细胞的自噬过程可能在AgNPs诱导细胞毒性中扮演着重要角色[7-8]。
细胞自噬是指消化发生错误折叠的蛋白质、损伤的细胞器以及病原体等物质的一种细胞生理现象,能够实现细胞自身的新陈代谢和抵抗外界因素的刺激[9]。细胞自噬在AgNPs诱导的毒性作用中,扮演着“双刃剑”作用,细胞自噬可通过抑制细胞凋亡来促进AgNPs染毒细胞存活[8],也可以促进AgNPs诱导的细胞凋亡[10]。深入了解AgNPs诱导的细胞自噬效应有助于其在医药领域的进一步应用,也能为全面评估AgNPs的纳米毒性提供科学依据。本文通过综述AgNPs诱导细胞自噬的潜在机制及其涉及的主要信号通路,分析AgNPs诱导细胞自噬的生物学效应,以期为全面认识AgNPs的生物安全性提供科学依据。
1 细胞自噬(Autophagy)
自噬现象广泛存在于真核细胞中,是一种通过溶酶体在细胞内部降解功能失调的细胞组分的过程。自噬可以降解和消化受损、变性的细胞器、蛋白质与核酸等生物大分子,为细胞的再生和修复提供原料,实现细胞内物质的循环利用。自噬细胞通过自身自噬作用保护其避免凋亡或坏死称为细胞保护性自噬(protective autophagy);而对细胞生理产生不利影响的自噬过程称为细胞破坏性自噬(destructive autophagy)[11-13]。常见的自噬类型有巨自噬(macroautophagy)、微自噬(microautophagy)以及分子伴侣介导的自噬(chaperone-mediated autophagy)3种。大分子物质主要通过巨自噬降解,此过程需要形成自噬体;而小分子物质直接被溶酶体吞噬降解,不需要自噬体参与;分子伴侣介导的自噬则需要依赖分子伴侣蛋白,使其被溶酶体膜上溶酶体膜蛋白1及2 (lysosomal membrane protein 1 and 2, LAMP1/2)识别,最后在溶酶体区室被降解[9]。
大量研究表明,AgNPs可以诱导细胞巨自噬[7-8,10]。细胞巨自噬形成的过程涉及自噬小体(autophagosome)的成核(nucleation)、延伸(elongation)、成熟(maturation)和降解(degradation)。在巨自噬早期阶段,unc-51样激酶(unc-51 like kinase 1, ULK1)复合物和Ⅲ型磷脂酰肌醇-3-激酶(class Ⅲ phosphoinositide 3-kinase, PI3KC3)复合物负责自噬前体双膜的形成。ULK1复合物与PI3KC3复合物结合能局部激活磷脂酰肌醇3-磷酸(phosphoinositide 3-phosphate, PI3P),诱导自噬前体膜上自噬相关蛋白9 (autophagy protein 9, ATG9)募集2个和自噬体膜延伸与自噬体形成的关键泛素样系统,即ATG12系统以及微管相关蛋白Ⅰ轻链3 (microtuble-associated protein Ⅰ light chain 3, LC3)系统。ATG12系统由ATG5/ATG12/ATG16L1组成,具有类E3泛素酶活性,能诱导转录因子EB (transcription factor EB, TFEB)与自噬体耦合,促进LC3驱动自噬体的生长,并调控自噬体与溶酶体结合,最终使微管相关蛋白Ⅰ轻链3Ⅰ (microtuble-associated protein Ⅰ light chain 3Ⅰ, LC3-Ⅰ)转化为微管相关蛋白Ⅰ轻链3Ⅱ (microtuble-associated protein Ⅰ light chain 3Ⅱ, LC3-Ⅱ)[14-15](图1)。
2 纳米银诱导细胞巨自噬的潜在机制(Potential mechanism of AgNPs-induced macroautophagy)
2.1 氧化应激反应
大量研究表明,AgNPs可通过诱导细胞氧化应激反应激活细胞巨自噬过程[16-18]。众所周知,自噬发生过程中,LC3合成后立即在其羧基端被ATG4所剪切,生成胞质LC3-Ⅰ。同时,在自噬过程中,LC3-Ⅰ会被包括ATG7和ATG3在内的泛素蛋白酶体系所修饰,产生分子量为14 kD的LC3-Ⅱ,并定位到自噬小体中。LC3-Ⅱ的含量和发生自噬的程度成正比,LC3-Ⅱ/Ⅰ比值的大小可估计自噬水平的高低。Lee等[16]的研究表明,在小鼠胚胎成纤维细胞NIH3T3中,AgNPs显著诱导ROS的产生,从而导致细胞溶酶体数量增加、囊泡出现、LC3-Ⅱ及选择性自噬接头蛋白P62表达水平上调等一系列反应。在小鼠原B淋巴细胞Ba/F3中观察到了同样的现象[17]。另外,一些报道指出,氧化应激反应导致的线粒体裂变也是AgNPs诱导细胞巨自噬可能的要因之一[18]。

图1 细胞自噬过程注:ULK1表示unc-51样激酶,FIP200表示黏着斑激酶家族相互作用蛋白200,ATG3/4/5/7/9/10/12/13/14/16/101分别表示自噬蛋白3/4/5/7/9/10/12/13/14/16/101,BECN1表示Beclin1蛋白,VPS15/34分别表示液泡蛋白分选15和34,PI3P表示磷脂酰肌醇3-磷酸,LC3表示微管相关蛋白Ⅰ轻链3,LC3-Ⅰ表示微管相关蛋白Ⅰ轻链3Ⅰ,LC3-Ⅱ表示微管相关蛋白Ⅰ轻链3Ⅱ。Fig. 1 The process of autophagyNote: ULK1 stands for unc51-like kinase 1; FIP200 stands for focal adhesion kinase family interacting protein of 200; ATG3/4/5/7/9/10/12/13/14/16/101 stands for autophagy protein 3/4/5/7/9/10/12/13/14/16/101; BECN1 stands for Beclin1 protein; VPS15/34 stands for vacuolar protein sorting 15 and 34; PI3P stands for phosphoinositide 3-phosphate; LC3 stands for microtuble-associated protein Ⅰ light chain 3; LC3-Ⅰ stands for microtuble-associated protein Ⅰ light chain 3Ⅰ; LC3-Ⅱ stands for microtuble-associated protein Ⅰ light chain 3Ⅱ.
2.2 内质网应激反应
内质网应激反应能激活细胞保护性自噬。内质网是细胞中合成蛋白质、脂质以及储存钙离子(Ca2+)的主要场所[19]。当内质网出现缺氧、Ca2+耗竭以及蛋白质错误折叠等情况时,即可能引发细胞发生内质网应激反应。研究表明AgNPs处理人神经母细胞瘤细胞SH-SY5Y后,细胞内Ca2+的稳态被破坏引起内质网应激反应激活了自噬过程[20]。
2.3 溶酶体功能损伤
溶酶体功能损伤可能是细胞自噬的另一原因。溶酶体在细胞自噬过程中负责与自噬小体融合并在溶酶体区室组织蛋白酶的作用下促进自噬溶酶体降解。AgNPs染毒人胚胎肾细胞HEK293T、人肾癌细胞A498和人前列腺癌细胞PC3后,细胞内ROS水平没有显著变化,但依然检测到LC3-Ⅱ/Ⅰ的比值升高以及ATG3、ATG5、ATG6等自噬蛋白的表达上调,说明在不引起氧化应激反应时,AgNPs依然可以诱导细胞自噬过程。其主要原因是AgNPs暴露引起了细胞内缺氧状态,导致溶酶体区室的组织蛋白酶D活性以及维持溶酶体功能的相关基因(csta、cstd、clcn7和mcoln)受到抑制[8,21]。
3 纳米银诱导细胞自噬涉及的主要信号通路(The main signaling pathways involved in AgNPs-induced macroautophagy)
与细胞巨自噬相关的一个核心蛋白是哺乳动物雷帕霉素靶蛋白(mammalian rapamycin target protein, mTOR)。mTOR被认为是细胞的营养感受器,是一种分子大小为289 kD的丝氨酸/苏氨酸蛋白激酶[22]。mTOR的磷酸化对细胞自噬过程起着负反馈调节作用。通常,mTOR位于溶酶体膜上,当细胞处于正常状态时,细胞质中的核转录因子TFEB被mTOR磷酸化,诱导mTOR激活[23]。反之,当细胞处于异常状态时,TFEB可从胞质转移到细胞核,引起腺苷磷酸依赖性蛋白激酶(adenosine 5’-monophosphate (AMP)-activated protein kinase, AMPK)、肿瘤抑制蛋白(tumor suppressor P53, P53)、丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)等相关自噬蛋白过表达[24],而mTOR则从溶酶体膜上被释放出来,mTOR活性被抑制后能促进细胞自噬。
3.1 AMPK/mTOR信号通路
AMPK对维持细胞的能量稳态有重要作用,常被称为“细胞能量感受器”[25]。当细胞出现能量匮乏,即腺苷磷酸(adenosine monophosphate, AMP)或二磷酸腺苷(adenosine diphosphate, ADP)相对升高时,AMPK将被激活[26]。AgNPs能破坏电子呼吸链导致ROS显著增加,引起线粒体损伤,使三磷酸腺苷(adenosine triphosphate, ATP)合成中断[27]。长时间暴露在AgNPs的细胞还可能出现缺氧情况。Chen等[21]的研究表明,亚致死剂量AgNPs染毒PC3细胞24 h后导致细胞处于缺氧以及能量匮乏状态、LC3-Ⅱ/Ⅰ比值增加、mTOR及其下游靶点蛋白核糖体S6激酶(ribosomal protein S6 kinase, S6K)活性被抑制,AMPK下游靶点乙酰辅酶A羧化酶1 (acetyl CoA carboxylase 1, ACC1)的磷酸化呈剂量依赖性降低,说明AgNPs通过AMPK/mTOR途径激活了细胞自噬。同样,在低剂量AgNPs诱导肾细胞系自噬的过程中,AMPK/mTOR被证明是自噬启动过程的关键信号通路[8]。在该过程中,细胞溶酶体结构与功能受到损伤,LAMP1表达减少、组织蛋白酶D活性下降。另外,AMPK的激活还受到细胞内Ca2+调节,当胞质Ca2+超负荷时,Ca2+/钙调蛋白激酶可通过激活死亡相关蛋白激酶(death-associated protein kinase, DAPK)活化AMPK,从而引起细胞自噬[28]。最近,Li等[20]的研究表明,AgNPs导致SH-SY5Y细胞内质网中的Ca2+外流,引发内质网应激,从而激活了AMPK/mTOR自噬信号通路。
3.2 PI3K/AKT/mTOR信号通路
磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)/蛋白激酶B(protein kinase B, AKT)信号通路能够调节细胞生长、细胞周期等相关蛋白基因的表达来调控细胞功能[29]。PI3K可以被表皮生长因子(epidermal growth factor, EGF)、胰岛素样生长因子(insulin-like growth factors-1, IGF-1)等多种细胞因子激活。研究表明,AgNPs也可以通过激活PI3K/AKT/mTOR信号通路诱导Ba/F3细胞、肝癌细胞HepG2和小鼠乳腺上皮细胞HC11等的自噬过程[17,30-31]。但是,PI3K选择性抑制剂3-甲基腺嘌呤(3-methyladenine, 3-MA)预处理或沉默ATG5后,AgNPs染毒的Ba/F3细胞活力明显上升[17],而HC11细胞活力明显下降[31]。显示PI3K/AKT/mTOR信号通路的激活对细胞存活的影响具有明显的两面性。
3.3 P53途径
p53基因是肿瘤抑制基因,在DNA损伤时能够激活p21阻滞细胞周期,具有修复受损DNA或诱导细胞凋亡的功能。一直以来,P53蛋白被认为与细胞凋亡等的联系更为密切。然而最近的研究表明,P53也与细胞自噬高度相关[32]。细胞在正常状态下,P53通过泛素降解途径在细胞质中保持低水平从而抑制细胞自噬[33],当受损DNA数量超过DNA修复能力时,P53能够通过损伤调节自噬调控基因dram1等激活细胞自噬[34]。一项体内研究也证实,大鼠灌胃90 d AgNPs后,大鼠肝脏组织LC3-Ⅱ/Ⅰ比值明显升高,其主要涉及P53途径[35]。
3.4 其他相关途径
除上述信号通路外,MAPK家族中的c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)、胞外调节蛋白激酶(extracellular regulated protein kinase, ERK)和磷酸酶及张力蛋白同源物(PTEN)诱导的激酶1 (PTEN-induced kinase 1, PINK1)/Parkin等都被报道涉及细胞自噬过程[33,36-39]。通过生物合成的AgNPs可能经由JNK途径促进人骨肉瘤细胞激活细胞保护性自噬[37]。另外,AgNPs处理宫颈癌HeLa细胞后所引起的自噬信号通路可能以独立于mTOR的方式激活完整自噬过程[40]。迄今为止,溶酶体Ca2+信号传导等经典自噬机制及其他更多转录因子或信号分子是否参与AgNPs诱导的细胞自噬调控仍然存在争议,这些途径有待进一步深入研究。
4 纳米银诱导细胞自噬的生物效应(Biological effects of AgNPs induced-autophagy)
线粒体、内质网和溶酶体是调节细胞生长代谢的关键细胞器,它们在细胞中相互调节、相互作用,对维持细胞正常的生理状态具有重要意义。然而,AgNPs可以直接或间接地损伤线粒体、内质网和溶酶体,并通过一系列反应激活自噬。
自噬对细胞具有两面性,一方面细胞自噬可以抵抗AgNPs诱导氧化应激反应带来的负面影响。线粒体自噬能减轻AgNPs引起的ROS积累和线粒体DNA的释放,减少细胞凋亡、减轻炎症反应[41-42]。AMPK/mTOR信号通路对减轻细胞炎症反应、抵抗细胞溶酶体损伤和能量缺乏起关键作用[31,43-44]。另外,细胞自噬也可以抵抗内质网应激反应促进细胞存活。AgNPs能诱导Ca2+在细胞质中过载,这对细胞的生长代谢往往具有不利影响,如引起细胞凋亡或坏死。细胞自噬在某种程度上能够抵消因内质网应激引起的内质网扩张,这可能是细胞抵抗内质网应激促进细胞存活的关键[19-20,45-46]。在缺氧条件下,自噬可以降低细胞内的耗氧率。AMPK激活后通过磷酸化脂肪分解的限速酶促进脂肪分解;通过磷酸化线粒体裂变因子(mitochondrial fission factor, MFF)促进线粒体自噬来恢复细胞内部的能量稳态[44]。另一方面细胞自噬可能加重AgNPs对细胞损伤的程度。过度自噬可能促进细胞吸收并蓄积AgNPs,最终导致细胞凋亡或坏死[38]。当细胞处于长时间应激状态,细胞可能发生非凋亡性死亡,从而促进了AgNPs对细胞的毒性作用。同时,细胞在持续处于氧化还原状态失衡的情况下,内质网应激诱导的自噬可能是细胞凋亡的上游事件。蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase, PERK)、激活转录因子(activating transcription factor 6, ATF6)和肌醇依赖酶(inositol-requiring enzyme-1, IRE1)是3种已知的响应内质网应激的蛋白。当细胞出现内质网应激时,葡萄糖调节蛋白(glucose regulated protein 78, GRP78)将从PERK上解离使其活化。PERK活化后将导致C/EBP同源蛋白(C/EBP-homologous protein, CHOP)被激活。CHOP在内质网应激中起着介导细胞凋亡的作用。AgNPs可以诱导HepG2细胞内CHOP过表达,最终通过Caspase3途径诱导细胞凋亡[47]。
AgNPs的染毒浓度、粒径、形状、分散性和表面涂层等均对诱导细胞自噬水平产生影响。1 mg·mL-1的AgNPs染毒HepG2细胞后,观察到细胞自噬被激活、促进了细胞的生存能力,而染毒浓度达到50 mg·mL-1时,却诱导了细胞凋亡[47]。AgNPs染毒HeLa细胞后,可以观察到TFEB核易位、LC3-Ⅱ、p62和LAMP1等显著升高[24]。但柠檬酸盐涂层的AgNPs染毒腺癌人类肺泡基底上皮细胞A549后并未观察到TFEB核易位,只是在转录水平上抑制了其表达[10]。AgNPs还可能通过破坏溶酶体结构与功能的稳定性,减少自噬溶酶体的降解,阻滞自噬通量完整性。经由胺修饰的AgNPs可引起NIH-3T3细胞自噬和凋亡,且20 nm比80 nm的胺修饰AgNPs能引起更多的溶酶体肿胀[45]。此外,AgNPs可以破坏A498、HEK293和A549细胞内溶酶体结构与功能的稳定性,减少自噬溶酶体的降解,阻滞自噬通量完整性[8,10]。Fageria等[38]的研究表明,9 nm和19 nm的AgNPs可由不同的内在化途径被人乳腺癌细胞MCF-7及MDA-MB-468摄取,在短时间内观察到LC3-Ⅱ、Beclin-1和ATG3蛋白水平增加,但在24 h后,细胞内溶酶体出现功能性障碍,细胞自噬通量被阻滞[38]。今后,探究AgNPs的自噬效应时,其理化性质、分散状态及其作用环境等都是需要考虑的影响因素。
5 总结与展望(Summary and outlook)
伴随着AgNPs的广泛应用,其带来的健康风险不容忽视。揭示AgNPs诱导细胞自噬作用对AgNPs材料在生物医学领域的应用及评估其潜在风险有着重要的意义。迄今为止的研究表明,AgNPs主要通过氧化应激反应、内质网应激反应以及溶酶体功能损伤激活细胞自噬过程。另一方面,细胞自噬也能够某种程度上减轻AgNPs对细胞的毒性作用(图2),而AgNPs的持续作用可能导致过度自噬,并引起细胞凋亡甚至坏死。此外,AgNPs也可能引起溶酶体功能障碍,阻滞细胞自噬通量的完整性,影响受损细胞器或错误翻译蛋白质的降解等过程。AgNPs诱导细胞自噬信号通路的不同似乎与细胞生存命运有关。不同理化性质的AgNPs以及细胞类型对AgNPs激活细胞的自噬信号通路具有选择性。因此,进一步阐明不同AgNPs诱导自噬过程的分子机制,控制和调节AgNPs引起的自噬活化,并且在分子水平上调控自噬发生过程,降低AgNPs自身的毒性,是AgNPs在生物医学领域发挥作用的关键。
未来,随着纳米科学技术的不断发展,AgNPs在其他领域的应用也必将逐渐增多。随着AgNPs的广泛应用,其极有可能因为处置不当而被环境生物所富集,并可能对生物造成长期影响。已经有学者对AgNPs是否具有跨代传递特性进行研究,而AgNPs诱导的细胞自噬信号通路通常涉及细胞激酶的激活与失活,对其是否会引起表观遗传效应和二者之间的联系还未可知。未来需要在研究AgNPs诱导细胞自噬的信号通路的基础上,进一步了解其诱导的细胞自噬信号通路与表观遗传的关系,为评估AgNPs的生物毒性提供新见解。
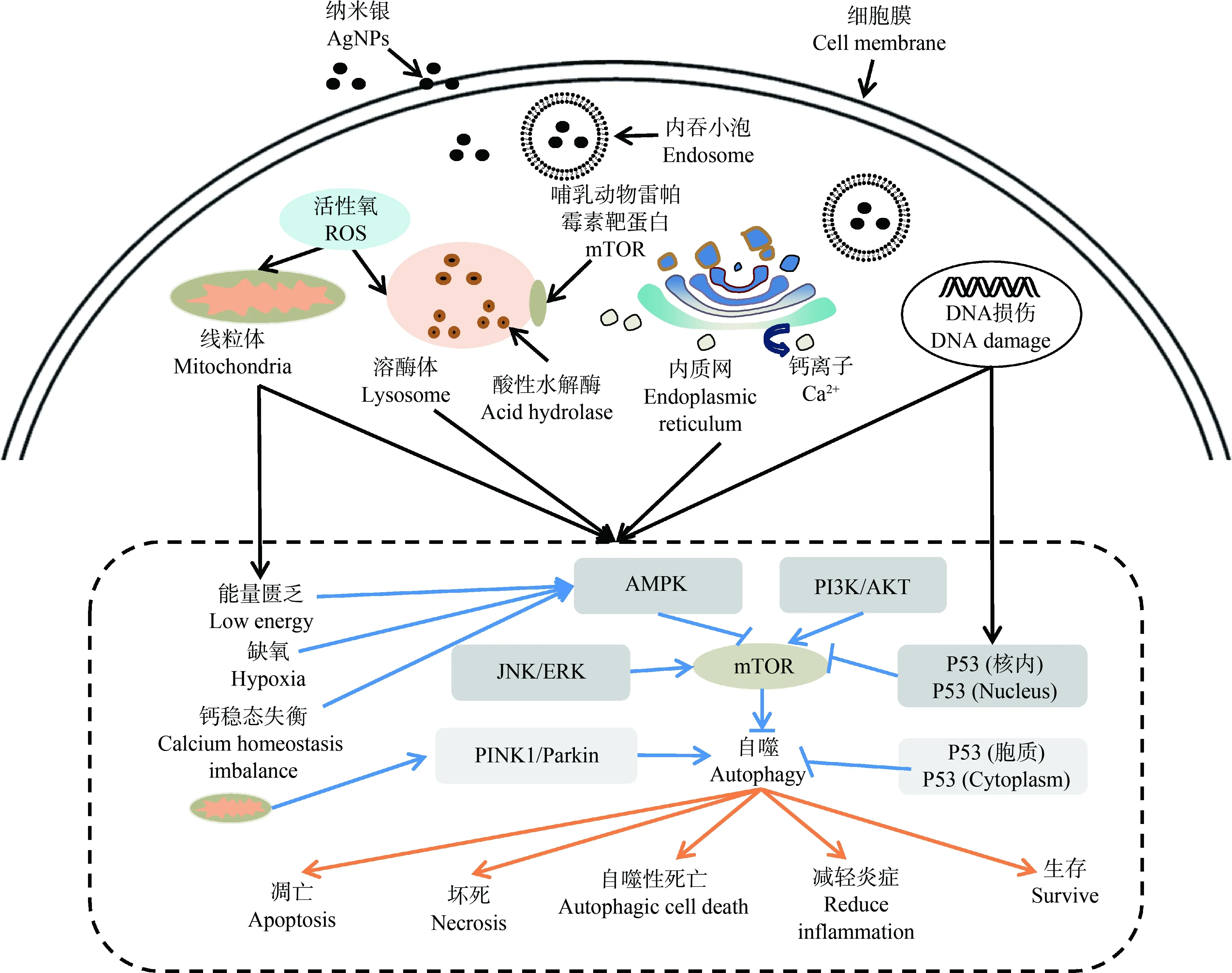
图2 纳米银诱导细胞自噬的分子机制及生物效应注:ROS表示活性氧;ATP表示三磷酸腺苷;AMPK表示腺苷磷酸依赖性蛋白激酶;PI3K表示磷脂酰肌醇3-激酶;AKT表示蛋白激酶B;P53表示肿瘤抑制蛋白;mTOR表示哺乳动物雷帕霉素靶蛋白;PINK1/Parkin表示磷酸酶及张力蛋白同源物(PTEN)诱导的激酶1/Parkin;JNK表示c-Jun氨基末端激酶;ERK表示胞外调节激酶。Fig. 2 Molecular mechanism and biological effects of autophagy induced by AgNPsNote: ROS stands for reactive oxygen species; ATP stands for adenosine triphosphate; AMPK stands for adenosine 5’-monophosphate (AMP)-activated protein kinase; PI3K stands for phosphoinositide 3-kinase; AKT stands for protein kinase B; P53 stands for tumor suppressor protein; mTOR stands for mammalian rapamycin target protein; PINK1/Parkin stands for PTEN-induced kinase 1/Parkin; JNK stands for c-Jun N-terminal kinase; ERK stands for extracellular regulated protein kinase.
通讯作者简介:赵晓旭(1984—),男,博士,讲师,主要研究方向为环境毒理学。
共同通讯作者简介:吕源财(1986—),男,博士,讲师,主要研究方向为纳米材料的环境风险。
