高海拔地区藏族冠心病患者肠道菌群多态性研究
2022-06-06高中山马玉兰朱露露
高中山,任 明,马玉兰,朱露露
1青海大学研究生院,西宁 810001 2青海大学附属医院心血管内科,西宁 810001
冠心病(coronary artery heart disease,CHD)是最常见的心血管疾病之一,严重威胁人类的生命健康,其发生发展受遗传、环境等多种因素的影响。我国西藏和青海大部分地区属于高海拔区域(平均海拔高于3600 m),该地区呈现出缺氧、寒冷、干燥、紫外线强等异于平原地区的环境特点。报道显示,虽然高血压等多种慢性心血管疾病在高海拔地区的发病率明显升高[1],但该地区的CHD发病风险却呈降低趋势[2- 3]。解剖学发现,高海拔藏族人群的冠状动脉较低海拔汉族人群明显粗壮[4],但其机制尚不明确。
大量研究表明,肠道菌群及其代谢产物可直接或间接参与CHD的发生发展[5]。由于肠道菌群分布和组成亦明显受遗传和环境因素的影响,其在高海拔地区藏族CHD发病中的作用尚未达成共识[6]。本研究分别收集了来自青藏高原的藏族CHD患者和健康人群,以及来自西宁和武汉的汉族CHD患者粪便组织,对标本中肠道菌群16S rRNA进行测序并进行生物信息学分析,以探究肠道菌群与青藏高原藏族人群CHD病理生理之间的关系。
1 对象与方法
1.1 研究对象
本研究为前瞻性横断面研究。2018年9月至2020年9月,招募世居青藏高原(海拔3600~4500 m)的藏族CHD患者[高海拔藏族CHD患者(high altitude Tibetan CHD, HTC)]和藏族健康人群[高海拔藏族健康人群(high altitude Tibetan normal, HTN),长期(超过三代世居)居住于西宁(海拔2260 m)的汉族CHD患者[中海拔汉族CHD患者(middle altitude Han CHD, MHC)和武汉(海拔13 m)汉族CHD患者[低海拔汉族CHD患者(low altitude Han CHD, LHC)]。其中HTC与MHC均来自青海大学附属医院心内科住院患者,HTN均来自青海大学附属医院体检中心,LHC均来自华中科技大学附属协和医院心内科住院患者。
CHD患者纳入标准:(1)诊断为不稳定型心绞痛,具有典型的心绞痛症状,心电图动态ST-T改变且经冠状动脉CT血管造影证实至少一支血管狭窄程度大于50%;(2)近3个月未使用任何抗生素或益生菌;(3)排便习惯为每天1~2次。排除标准:(1)合并肿瘤、胃肠道疾病、糖尿病、甲状腺功能异常、肥胖症、高血压、心力衰竭、肾衰竭、卒中、外周动脉疾病或任何其他急性或慢性炎症性疾病者;(2)孕期或哺乳期女性。
HTN纳入标准:(1)无明显临床不适且体检结果证实无明确的临床疾病;(2)藏族且世居青藏高原;(3)排便习惯为每天1~2次。排除标准:孕期或哺乳期女性。
本研究已通过青海大学伦理委员会审批(审批号:P-SL- 2017022和 P-SL- 2017063),所有参与者均签署知情同意书。
1.2 方法
1.2.1 标本收集与DNA提取
收集所有参与者一般资料(年龄、性别、体质量指数、吸烟情况以及血压、血脂等)及晨起新鲜大便标本(约5 g),立即保存于-80 ℃冰箱。采用E.Z.N.A. Soil DNA 试剂盒(美国Omega公司产品)提取标本中的肠道菌群总基因组DNA,并应用Qubit 3.0 fluorometer荧光定量仪(美国Life Technologies公司产品)检测DNA浓度。
1.2.2 16S rRNA基因扩增与测序
采用Taq Master Mix (2×)试剂盒(南京诺唯赞生物科技有限公司产品)对肠道菌群的16S rRNA基因V3~V4区进行扩增,正相引物序列:5′-CCTAC-GGGNGGCWGCAG- 3′,反相引物序列:5′-GACTACHVGGGTATCTAATCC- 3′。PCR反应体系:2×Taq master Mix 15 μL,正反向引物(10 μmol/L)各1 μL,基因组DNA 10~20 ng,补加水至30 μL。PCR反应条件:94 ℃初始变性3 min;94 ℃ 30 s,45 ℃ 20 s,65 ℃ 30 s,5个循环;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,20个循环;72 ℃孵育5 min。使用Agencourt AMPure XP试剂盒(美国Beckman Coulter公司产品)对PCR产物进行纯化,并通过Illumina MiseqTM平台(美国Illumina公司产品)进行测序。
1.3 生物信息学分析
采用QIIME v.1.8.0软件对16S rRNA基因序列进行分析和处理[7]。其通过独特的条形码可区分样品序列,并对每个样品序列进行质量控制。随后去除序列的条形码和引物,将成对的末端序列合并[8]。采用USEARCH(v.5.2.236)软件删除非扩增区序列,并对序列进行纠错[9];应用UCHIME(v.4.2.40)软件识别嵌合体,并基于Blastn数据库中的代表性序列去除嵌合体。所有剩余序列以97%的序列相似性聚类至操作分类单元(operational taxonomic unit,OTU)中,通过USEARCH选择每个OTU最丰富的序列作为代表序列[10]。将OTU与SILVA数据库进行比较[11],并使用USEARCH生成OTU表,以进行后续分析。
采用QIIME软件中的Mothur程序(v.1.30.1)计算稀疏曲线(Shannon指数)、α多样性(Shannon指数)以及β多样性[基于加权UniFrac距离矩阵的主坐标分析(principal coordinate analysis, PCoA)],采用R软件的Vegan Package(v.2.0- 10)程序包绘制加权UniFrac距离矩阵样本树树状图。采用线性判别分析(linear discriminant analysis, LDA)软件LEfSe(v.1.1.0)筛选组间相对丰度有统计学差异的物种,并基于R软件中的Gplots Package (v.2.17.0)程序包绘制物种丰度热图。
1.4 统计学处理
采用SPSS 22.0软件进行统计学分析。年龄、血压、血脂等正态分布计量资料以均数±标准差表示,组间比较采用单因素方差分析和LSD-t检验;性别、吸烟等计数资料以频数(百分数)表示,组间比较采用卡方检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共入选符合纳入和排除标准的CHD患者36例(HTC 8例、MHC 14例、LHC 14例),HTN 34例。
单因素方差分析显示,4组总胆固醇、低密度脂蛋白胆固醇差异具有统计学意义(P均<0.05),年龄、性别、体质量指数等差异均无统计学意义(P均>0.05),见表1。
2.2 HTC与HTN肠道菌群丰度和分布比较
稀疏曲线(Shannon指数)分析结果表明所有样品均达饱和(图1A、2A),提示测序数据量合理,样品中OTU物种的数量足够,不同物种丰度的平均值达到标准。α多样性分析显示,HTC组肠道菌群的Shannon指数与HTN组无统计学差异(P=0.091,图1B)。进一步计算了基于加权UniFrac距离矩阵的PCoA,以评估两组肠道菌群β多样性。结果显示两组肠道菌群在PCoA1轴和PCoA3轴之间形成两个不同的群落,提示二者的菌群分布存在差异(图1C)。

表 1 患者一般临床资料比较

图 1 高海拔藏族冠心病患者和高海拔藏族健康人群肠道菌群多样性比较
2.3 不同海拔、民族CHD患者肠道菌群丰度和分布比较
α多样性分析显示,不同海拔、不同民族CHD患者之间的Shannon指数具有显著差异(P=0.025),其中HTC组Shannon指数最高,MHC组次之,LHC组最低,提示HTC组肠道菌群丰度最高(图2B)。基于加权UniFrac距离矩阵的PCoA显示,HTC组肠道菌群在分布上形成与LHC组、MHC组明显不同的簇(图2C),表明HTC组的肠道菌群分布与MHC组和LHC组有较大差异,且MHC组与LHC组肠道菌群的分布亦存在一定差异(图2C)。基于加权UniFrac距离矩阵样本树树状图显示,HTC组、MHC组和LHC组的样本可划分为7个聚类组(图2D),其中第1、5组主要包含LHC,第2组包含大部分HTC,第3、4和7组主要为MHC,进一步提示HTC组、MHC组和LHC组肠道菌群的分布存在明显差异。
2.4 不同海拔、民族CHD患者肠道菌群组成差异的多级别分析
在门水平上,HTC组、MHC组、LHC组优势菌门的比例存在一定差异(图3A):与LHC组、HTC组比较,MHC组厚壁菌门(Firmicutes)的相对丰度显著降低(P<0.05);与MHC组、HTC组比较,LHC组Firmicutes和拟杆菌门(Bacteroidetes)相对丰度比值(F/B)明显降低(P<0.05,图3B);与LHC组、MHC组比较,HTC组变形菌门(Proteobacteria)的相对丰度明显降低(P<0.05,图3C~E)。
进一步对LHC组、MHC组和HTC组肠道菌群在属水平上的分布情况进行分析。LDA结果显示,包括克雷伯氏菌(Prevotella)、帕拉普氏菌(Paraprevotella)、副拟杆菌(Parabacteroides)和巴氏菌(Barnesiella)在内的多数Bacteroidetes在HTC组中呈优势分布,部分Firmicutes在HTC组中亦呈现出优势分布,包括小类杆菌(Dialister)、霍尔德曼氏菌(Holdemanella)、链型杆菌(Catenibacterium)、瘤胃球菌2(Ruminococcus2)和多雷亚菌(Dorea)等(图4A)。

图 2 不同海拔、民族冠心病患者肠道菌群丰度和分布

图 3 不同海拔、民族冠心病患者肠道菌群在门水平上的组成差异
物种丰度热图所示的肠道菌群在属水平上分布结果与LDA结果一致,且可见致病菌如链球菌(Streptococcus)、埃希氏菌_志贺氏菌(Escherichia_Shigella)和克雷伯氏菌(Klebsiella)的相对丰度在HTC组下降,有益菌如粪杆菌(Faecalibacterium)、Prevotella、链型杆菌(Catenibacterium)和乳酸杆菌(Lactobacillus)的相对丰度在HTC组中升高(图4B)。
3 讨论
本研究对肠道菌群与不同海拔、民族人群CHD的关系进行了初步分析,结果显示,与MHC、LHC相比,HTC的肠道菌群α、β多样性存在明显差异,提示高海拔藏族CHD患者的肠道菌群分布呈现出异于中、低海拔汉族CHD患者的特征。在对肠道菌群组成成分的分析中,HTC在门水平、属水平亦显示出不同于MHC、LHC的特征,其致病菌Streptococcus、Escherichia_Shigella和Klebsiella表达下降,有益菌Faecalibacterium、Prevotella、Catenibacterium和Lactobacillus表达升高,可能与高海拔藏族人群较低的CHD发病风险相关。
肠道菌群被称为“被遗忘的器官”。随着高通量测序技术的应用,临床对肠道菌群的认识有了长足的进步。肠道菌群结构和代谢紊乱与CHD危险因素以及CHD发生发展的关系已得到多方面的报道。研究证实,肠道菌群组成的变化可促进脂肪异常堆积和炎症反应级联放大,增加了心血管疾病发生风险[12]。胡海兵等[13]基于高通量测序技术对50例CHD患者和35名健康人群的粪便组织标本进行测序,发现健康组和CHD组的肠道菌群结构存在显著差异。Arsenenultt-Bréard等[14]和Lam等[15]亦证实,肠道菌群多样性与CHD的发生发展有关。Ott等[16]和Koren等[17]在动脉粥样硬化斑块中发现了大量的肠道细菌DNA,表明肠道菌群可能直接参与了CHD的发病机制。肠道菌群代谢产物(如三甲胺N-氧化物)已被证实可参与调控CHD的发展[18]。朱华等[19]将CHD患者的粪便组织移植至健康小鼠小肠道后,小鼠肠道菌群的结构丰度、血脂、细胞因子含量等指标呈现出与CHD患者相似的变化。因此,海量的研究已从不同方面展现了肠道菌群与CHD的关系。
青藏高原平均海拔在4000 m以上,素有“世界屋脊”之称,其特殊的高寒、缺氧环境造就了长期生活在该地区的居民呈现出不同于生活在中、低海拔居民的疾病特征。肠道菌群多样性受环境和遗传因素的调节,其在不同海拔、民族人群中的分布具有显著差异[20]。Jia等[6]研究表明,世居低海拔的汉族人群进入高海拔地区生活后,其肠道菌群分布和组成的变化趋向于当地居民。目前,肠道菌群在高海拔藏族CHD患者肠道中的分布特点以及其在CHD发生发展中的作用尚缺乏系统报道。
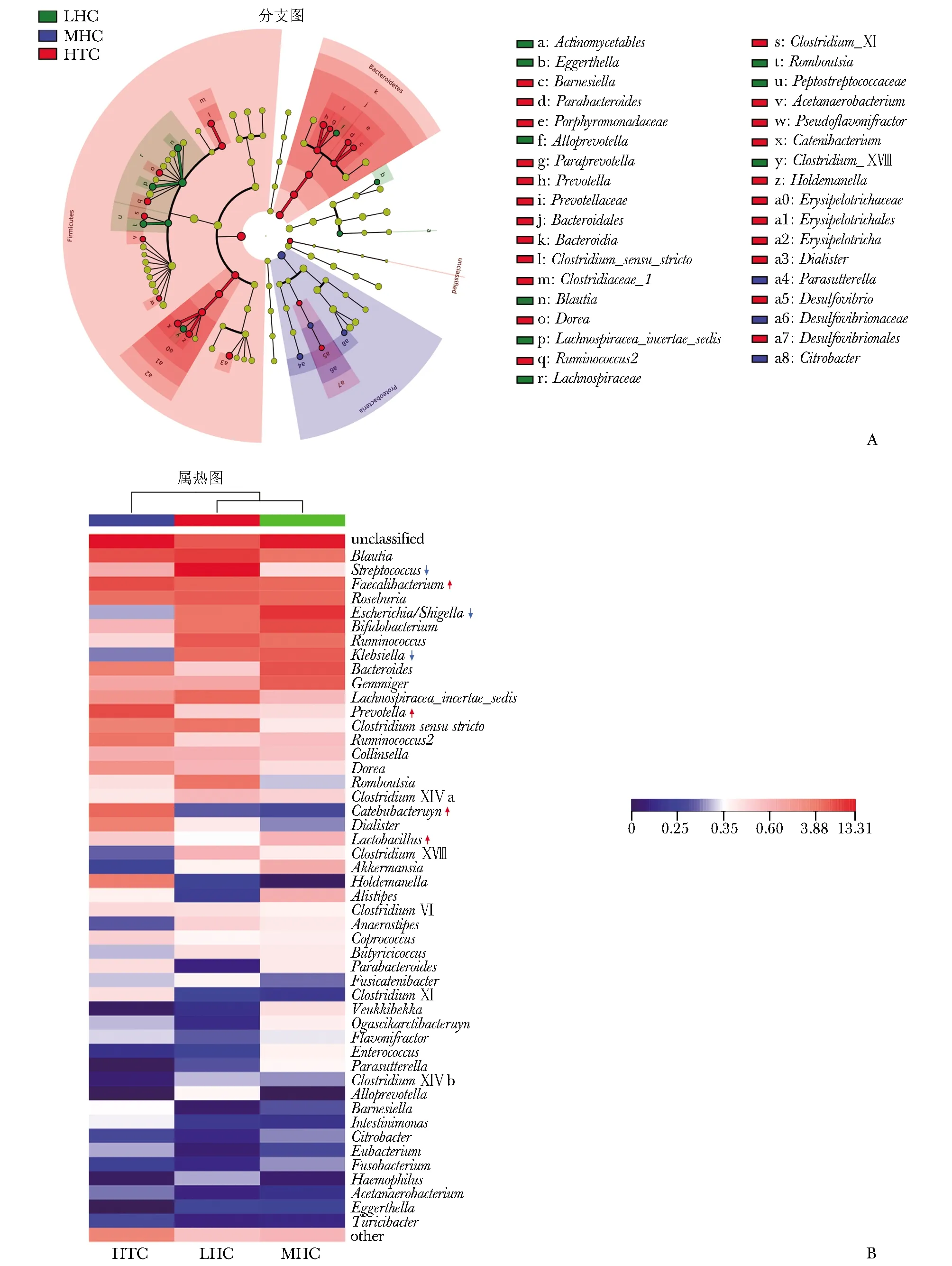
图 4 不同海拔、民族冠心病患者肠道菌群属水平分布和组成差异
本研究首先对高海拔藏族CHD患者和高海拔藏族健康人群的肠道菌群分布特点进行了探究,发现二者的α多样性不具有统计学差异,β多样性明显不同,与既往低海拔汉族CHD患者肠道菌群分布与健康人群存在差异的研究结果相符[21],初步提示肠道菌群多样性可能参与了高海拔藏族CHD的发病。为进一步明确HTC肠道菌群的独特特征,本研究比较了不同海拔、民族CHD患者的肠道菌群分布和结构。结果显示与MHC组和LHC组比较,HTC组肠道菌群α多样性明显增高,β多样性亦形成了明显不同的簇,提示高海拔藏族CHD患者的肠道菌群丰富度较中、低海拔汉族CHD患者明显增高且呈现出明显不同的分布,此结果与最新研究结果一致[22]。
在肠道菌群组成方面,包括Streptococcus、Escheri-chia_Shigella和Klebsiella在内的致病菌相对比例在HTC组明显降低。Streptococcus主要来源于口腔,可降低血浆高密度脂蛋白水平[23]。Escherichia_Shigella的毒性代谢物(如三甲胺N-氧化物)可促进CHD的发展[24]。Klebsiella参与炎症疾病和高血压进程,可能对CHD具有促进作用[25]。同时,HTC组有益菌表达水平明显上调,其Faecalibacterium、Prevotella、Catenibacterium和Lactobacillus的相对丰度明显高于MHC组和LHC组。Faecalibacterium可产生丁酸盐,具有抗炎作用[26]。Prevotella通过代谢产物琥珀酸在促进机体正常代谢方面(糖代谢)呈现出特殊优势[27]。Catenibacterium具有减重作用,可降低心血管事件发生风险[28]。Lactobacillus则在降低CHD危险因素、延缓CHD发展、改善CHD预后方面发挥重要作用[29- 31]。由此可见,与中、低海拔汉族CHD患者比较,高海拔藏族CHD患者肠道菌群呈现出致病菌比例下降、有益菌比例升高的独特表现,直接或间接降低了CHD发生风险,这不仅受益于青藏高原藏族居民的生活环境且与其饮食习惯关系密切。该地区低压、低温、缺氧、强紫外线的自然条件,不利于Escherichia_Shigella和Klebsiella等致病菌的生存,减少了CHD的发病危险因素。另一方面,高海拔藏族居民在生活中摄入较多的碳水化合物、纤维和发酵乳制品,Faecalibacterium、Prevotella、Catenibacterium和Lactobacillus等有益菌得到有效补充,对CHD具有预防作用。
本研究局限性:(1)排除了高血压、糖尿病、肥胖等CHD的危险因素后,纳入的单纯高海拔藏族CHD病例数受限,降低了结果稳定性。高海拔地区人口稀少,CHD发病率低,增加了病例收集的难度,再加上标本收集要求严格,最终导致本研究样本量较小。(2)CHD包括不同的亚型,为避免不同类型CHD引起的混杂,本研究纳入的CHD均为不稳定型心绞痛患者。对于急性心肌梗死患者,由于治疗的影响,其往往被动改变日常生活、饮食和排便习惯,影响了肠道菌群的多样性。既往研究证实,稳定型心绞痛的肠道菌群多样性与健康人群无显著差异[32],但仍需进一步证实。(3)CHD患者与HTN的血脂水平存在一定差异,本研究未对血脂水平进行校正。
综上,无论是与同海拔藏族健康人群,还是与中、低海拔汉族CHD患者相比,高海拔藏族CHD患者肠道菌群均呈现为丰度更高、差异更大的特征。其有益菌高表达,致病菌低表达可能对CHD的发生、发展起到抑制作用。后续可考虑通过动物实验和体外实验,进一步验证肠道菌群对高海拔人群CHD发生保护作用的具体机制。
作者贡献:高中山、任明、马玉兰进行研究构思与设计、可行性分析以及论文撰写与修订;高中山、朱露露进行标本、文献资料收集;马玉兰负责论文的质量控制及审校。
利益声明:所有作者均声明不存在利益冲突
