中国艾滋病诊疗指南(2021年版)
2022-06-06中华医学会感染病学分会艾滋病丙型肝炎学组中国疾病预防控制中心
中华医学会感染病学分会艾滋病丙型肝炎学组,中国疾病预防控制中心
艾滋病,即获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS),其病原体为人类免疫缺陷病毒(human immunodeficiency virus,HIV),亦称艾滋病病毒。AIDS是影响公众健康的重要公共卫生问题之一。中华医学会感染病学分会艾滋病丙型肝炎学组牵头,于2005年制订了我国《艾滋病诊疗指南》(下文简称“指南”)第一版,2011年、2015年和2018年分别进行了更新[1]。2021年版指南是在2018年版指南的基础上,参照国内外最新研究进展修订而成。
1 流行病学
1.1 流行现况
联合国艾滋病规划署(The Joint United Nations Programme on HIV/AIDS,UNAIDS)估计,截至2020年底,全球现存HIV/AIDS患者3770万,当年新发HIV感染者150万,2750万人正在接受抗反转录病毒治疗(anti-retroviral therapy,ART;俗称“鸡尾酒疗法”)[2]。2021年6月8日,联合国“到2030年终结艾滋病流行的政治宣言”承诺:将预防作为优先事项,确保至2025年,有效的AIDS综合预防方案涵盖95%存在HIV感染风险者;承诺2030年前实现“三个95%”目标,即95%的HIV感染者能得到确诊,95%的确诊者能获得ART,以及95%的接受治疗者体内病毒得到抑制;承诺2025年之前消除HIV母婴传播;承诺至2025年,将每年新增HIV感染病例控制在37万以下,将每年AIDS死亡病例控制在25万以下,并消除与HIV相关的一切形式的污名化与歧视,实现至2030年终结艾滋病流行的目标[3]。
1.2 传染源
传染源为HIV感染者和AIDS患者。HIV主要存在于传染源的血液、精液、阴道分泌物、胸腹水、脑脊液、羊水和乳汁等体液中。
1.3 感染和传播途径
经性接触(包括不安全的同性、异性和双性性接触),经血液及血制品(包括共用针具静脉注射毒品,不安全、不规范的介入性医疗操作,纹身等),经母婴传播(包括宫内感染、分娩时和哺乳传播)。
高风险人群主要有男男性行为者(men who have sex with men,MSM)、静脉注射毒品者、与HIV/AIDS患者有性接触者、多性伴者、性传播感染(sexually transmitted infection,STI)者。
1.4 疫情报告
推行AIDS自愿咨询和检测(voluntary counselling and testing,VCT),对发现的HIV/AIDS患者应遵照《中华人民共和国传染病防治法》及时向所在地疾病预防控制中心报告疫情,按照乙类传染病管理,并采取相应措施。
1.5 患者管理
遵循隐私保密原则,加强对HIV/AIDS患者的随访,及时给予规范的综合治疗,包括ART和对症支持治疗,提供必要的心理和医学咨询(包括预防HIV/AIDS患者继续传播HIV的知识与措施)等全程管理措施。
1.6 预防措施
正确使用安全套,采取安全的性行为;不吸毒,不共用针具;推行无偿献血,对献血人群进行HIV筛查;加强医院感控管理,严格执行消毒制度,控制医院交叉感染,预防职业暴露与感染;控制母婴传播;对HIV/AIDS患者的配偶和性伴、与HIV/AIDS患者共用注射器的静脉药物依赖者,以及HIV/AIDS患者所生的子女,进行HIV相关检测,并提供相应的咨询服务。对于感染HIV的高风险人群,在知情同意及高依从性前提下提供抗病毒药物以进行相应的暴露前预防(pre-exposure prophylaxis,PrEP)和暴露后预防(post-exposure prophylaxis,PEP)。
2 病原学特征
HIV在病毒分类学上属于反转录病毒科慢病毒属中的人类慢病毒组,为直径100~120 nm的球形颗粒,由核心和包膜两部分组成。核心由衣壳蛋白(capsid protein,CA;p24)组成,衣壳内包括两条完全相同的病毒单股正链RNA、核衣壳蛋白(nucleocapsid protein,NC)和病毒复制所必需的酶类,包括反转录酶(reverse transcriptase,RT;p51/p66)、整合酶(integrase,IN;p32)和蛋白酶(proteinase,PR;p10)等。病毒的最外层为包膜,其中嵌有外膜糖蛋白gp120和跨膜糖蛋白gp41;包膜结构之下为基质蛋白(matrix protein,MA;p17),形成病毒内壳。
HIV分为HIV- 1和HIV- 2。HIV基因组全长约9.7 kb,基因组两端长末端重复序列(long terminal repeat,LTR)发挥着调节HIV基因整合、表达和病毒复制的作用。HIV基因组含有gag、pol和env 3个结构基因、2个调节基因(tat反式激活因子和rev毒粒蛋白表达调节因子)和4个辅助基因(nef负调控因子、vpr病毒蛋白r、vpu病毒蛋白u和vif病毒感染因子),其中vpu为HIV- 1型所特有,而vpx为HIV- 2型所特有。
HIV是一种变异性很强的病毒,各基因的变异程度不同,env基因的变异率最高。HIV发生变异的主要原因包括反转录酶无校正功能导致的随机变异,病毒在体内高频率复制,宿主的免疫选择压力,病毒DNA与宿主DNA之间的基因重组,以及药物选择压力,其中不规范的ART及患者依从性差是导致耐药变异的重要原因。
我国以HIV- 1型为主要流行株,已发现有A、B(欧美B)、B’(泰国B)、C、D、F、G、H、J和K 10个亚型,还存在不同流行重组型(circulating recombinant form,CRF)和独特重组型(unique recombinant form,URF)[4]。2015年第4次全国HIV分子流行病学调查显示,我国HIV- 1型主要流行的亚型为CRF07_BC、CRF01_AE、CRF08_BC和B亚型[5]。HIV- 2型主要集中在非洲西部区域,目前还未形成全球性扩散,但自1999年起我国部分地区已发现少量HIV- 2型感染者,随后多地报道HIV- 2型输入性病例,值得密切关注[6]。
HIV- 1型入侵宿主的主要受体是表达于T淋巴细胞、单核巨噬细胞,以及树突状细胞(dendritic cell,DC)表面的CD4分子。HIV需借助易感细胞表面的受体进入细胞,包括第一受体(CD4,主要受体)和第二受体[趋化因子受体(CC chemokine receptor,CCR)5或趋化因子CXC亚家族受体(CXC subfamily receptor,CXCR)4等辅助受体]。根据HIV对辅助受体利用的特性将HIV分为X4和R5毒株。R5型病毒通常只利用CCR5受体,而X4型病毒常同时利用CXCR4、CCR5和CCR3受体。CXCR4和CCR5在不同T细胞亚群上的表达存在差异,初始T淋巴细胞(CD45RA)高表达CXCR4,而记忆性T淋巴细胞(CD45RO)高表达CCR5。巨噬细胞和DC也高表达CCR5。值得注意的是,在疾病的早期阶段,HIV常利用CCR5作为辅助受体,而在疾病进展至晚期时病毒常利用CXCR4作为辅助受体。
HIV在人体细胞内的感染过程如下。(1)吸附、膜融合及穿入:HIV- 1感染人体后,选择性地吸附于靶细胞的CD4受体上,在辅助受体的帮助下进入宿主细胞。(2)反转录、入核及整合:细胞质中的病毒RNA在反转录酶作用下,形成互补DNA(complementary DNA,cDNA),在DNA聚合酶作用下形成双链线性DNA。进入细胞核内,在整合酶的作用下整合至宿主细胞的染色体DNA中。这种整合至宿主细胞DNA中的病毒DNA即被称为“前病毒”。(3)转录及翻译:前病毒被活化而进行自身转录时,在细胞RNA聚合酶的催化下,病毒DNA转录形成RNA,一些RNA经加帽加尾成为病毒的子代基因组RNA;另一些RNA经拼接而成为病毒mRNA,在细胞核蛋白体上转译成病毒的结构蛋白(Gag、Gag-Pol和Env前体蛋白)和各种非结构蛋白,合成的病毒蛋白在内质网核糖体进行糖化和加工,在蛋白酶作用下裂解,产生子代病毒的蛋白质和酶类。(4)装配、出芽及成熟:病毒的组装是一个复杂且高度有序的过程。Gag和Gag-Pol前体蛋白与病毒子代基因组RNA在细胞膜的内面进行包装,gp120和gp41转运至细胞膜表面,与正在出芽的Gag和基质蛋白MA相结合,通过芽生从细胞膜上获得病毒体的包膜,形成独立的病毒颗粒。在出芽的中期或晚期,病毒颗粒中的Gag和Gag-Pol前体蛋白在病毒自身的蛋白酶作用下裂解成更小的病毒蛋白,包括Gag中的p17、p24、p7、p6,以及Pol中的反转录酶、整合酶和蛋白酶。这些病毒蛋白与子代基因组RNA再进一步组合,最后形成具有传染性的成熟病毒颗粒。
HIV在外界环境中的生存能力较弱,对物理因素和化学因素的抵抗力较低。一般消毒剂,如碘酊、过氧乙酸、戊二醛、次氯酸钠等对乙肝病毒(hepatitis B virus,HBV)有效的消毒剂,对HIV也都有良好的灭活作用。除此之外,70%的酒精也可灭活HIV,但紫外线或γ射线不能灭活HIV。HIV对热敏感,对低温的耐受性强于高温。56 ℃处理30 min可使HIV在体外对人的T淋巴细胞失去感染性,但不能完全灭活血清中的HIV;100 ℃处理20 min可将HIV完全灭活。
3 实验室检查[7]
HIV/AIDS患者的实验室检查主要包括HIV抗体检测、HIV核酸定性和定量检测、CD4+T淋巴细胞计数、HIV耐药检测等。HIV- 1/2抗体检测是HIV感染诊断的金标准,HIV核酸检测(定性和定量)也用于HIV感染诊断。HIV抗体检测包括筛查试验和补充试验,HIV补充试验包括抗体补充试验(抗体确证试验)和核酸补充试验(核酸定性和定量检测)。HIV核酸定量和CD4+T淋巴细胞计数是判断疾病进展、临床用药、疗效和预后的两项重要指标;HIV耐药检测可为ART方案的选择和更换提供指导。
3.1 HIV- 1/2抗体检测
包括筛查试验和补充试验。HIV- 1/2抗体筛查方法包括酶联免疫吸附试验(enzyme-linked immunosor-bent assay,ELISA)、化学发光或免疫荧光试验、快速试验(斑点ELISA和斑点免疫胶体金或胶体硒、免疫层析等)、简单试验(明胶颗粒凝集试验)等。抗体补充试验方法为抗体确证试验(免疫印迹法、条带/线性免疫试验和快速试验)。
3.1.1 筛查试验
阴性反应报告HIV- 1/2抗体阴性,见于未被HIV感染的个体,但窗口期感染者筛查试验也可呈阴性反应。若呈阳性反应,用原有试剂双份(快速)/双孔(化学发光试验或ELISA)或两种试剂进行重复检测,如均呈阴性反应,则报告为HIV抗体阴性;如一阴一阳或均呈阳性反应,需进行补充试验。
3.1.2 抗体补充试验
抗体确证试验无HIV特异性条带产生,报告HIV- 1/2抗体阴性;出现条带但不满足诊断条件的报告不确定,可进行核酸检测或2~4周后随访,根据核酸检测或随访结果进行判断。HIV- 1/2抗体确证试验结果阳性,出具HIV- 1/2抗体阳性确证报告。
3.2 CD4+T淋巴细胞检测
CD4+T淋巴细胞是HIV感染最主要的靶细胞,HIV感染人体后,出现CD4+T淋巴细胞进行性减少,CD4+/CD8+T淋巴细胞比值倒置,细胞免疫功能受损。
目前CD4+T淋巴细胞亚群常用的检测方法为流式细胞术,可直接获得CD4+T淋巴细胞数绝对值,或通过白细胞分类计数后换算为CD4+T淋巴细胞绝对数。CD4+T淋巴细胞计数的临床意义:了解机体免疫状态和病程进展、确定疾病分期、判断治疗效果和HIV感染者的并发症。
CD4+T淋巴细胞检测频率:需根据患者的具体情况由临床医师决定。在治疗前进行1次检测,启动治疗3个月后进行1次检测,治疗后2年以内每3~6个月检测1次(如果基线CD4+T淋巴细胞计数<200~300个/μL,建议每3个月检测1次;如果基线CD4+T淋巴细胞计数>300个/μL,建议每6个月检测1次)。治疗2年后,对于ART后体内病毒被充分抑制,CD4+T淋巴细胞计数在300~500个/μL的患者,建议每12个月检测1次;>500个/μL的患者,可选择性进行CD4+T淋巴细胞检测。当出现ART启动延迟、ART失败更换药物方案、治疗过程中重复检测病毒载量>200拷贝/mL的情况时,建议每3~6个月检测1次。对于发生病毒学突破、出现AIDS相关临床症状、接受可能降低CD4+T淋巴细胞治疗的患者,按照临床情况定期检测。
CD4+/CD8+T淋巴细胞比值倒置可在长期ART后出现不同程度的改善,与患者起始治疗的时机和基础CD4+T淋巴细胞计数密切相关,其变化提示患者的治疗效果和免疫炎症状态[8]。
3.3 HIV核酸检测
感染HIV后,病毒在体内快速复制,血浆中可定量检测出病毒RNA的量(病毒载量),一般用每毫升血浆中HIV RNA的拷贝数(拷贝/mL)或国际单位(IU/mL)表示。病毒载量检测结果低于检测下限,表示本次试验未检测出病毒载量,见于未感染HIV的个体、ART成功的患者或自身可有效抑制病毒复制的部分HIV感染者。病毒载量检测结果高于检测下限,表示本次试验检测出病毒载量,可结合流行病学史、临床症状及HIV抗体初筛结果作出判断。
检测病毒载量的常用方法有反转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)、核酸序列依赖性扩增(nucleic acid sequence-based amplification,NASBA)技术和实时荧光定量PCR扩增技术(real-time polymerase chain reaction,Real-time PCR)。病毒载量测定的临床意义:预测疾病进程、评估ART疗效、指导ART方案调整;也可作为HIV感染诊断的补充试验,用于急性期/窗口期及晚期患者的诊断、HIV感染者的诊断和小于18月龄婴幼儿HIV感染的诊断。
核酸检测方法(定性和定量):属于HIV检测中的核酸补充实验,核酸定性检测结果阳性报告HIV- 1核酸阳性,结果阴性报告HIV- 1核酸阴性。RNA载量检测结果低于检测下限,报告低于检测下限;>5000拷贝/mL,报告检测值;检测限以上但≤5000拷贝/mL,建议重新采样检测。临床医师可结合流行病学史、临床表现、CD4+T与CD8+T淋巴细胞计数或HIV抗体随访检测结果等进行确诊或排除诊断。DNA载量检测结果的判定参照试剂盒说明书。
病毒载量检测频率:在ART前应进行1次检测,如未启动ART,建议定期检测。初始治疗后,建议第1次检测应在治疗后4周左右,然后每3个月检测1次直至病毒载量完全被抑制。治疗后2年以内,建议每3~4个月检测1次。治疗2年以后,如果病毒载量被稳定抑制,则每6个月检测1次。如因ART失败调整治疗方案,建议第1次检测应在调整方案后的4周进行,然后每3个月检测1次直至病毒载量得到抑制。如因药物毒性或简化药物方案对病毒抑制的患者更换ART方案,应在调整方案后4周进行检测以确认病毒载量得到抑制。如治疗过程中病毒载量>200拷贝/mL,建议每3个月检测1次。对于新出现艾滋病相关临床症状或使用激素或抗肿瘤化疗药物的患者,需每3个月进行1次核酸检测。
3.4 HIV基因型耐药检测
HIV耐药检测结果可为ART方案的制订和调整提供参考。出现HIV耐药,表示该感染者体内病毒可能耐药,同时需密切结合临床情况,充分考虑患者的依从性,对药物的耐受性及药物的代谢吸收等因素进行综合评判。改变ART方案需在有经验的医师指导下进行。HIV耐药检测结果呈阴性,表示该份样品未检出耐药性,但不能确定该感染者体内HIV不存在耐药情况。
耐药检测方法包括基因型和表型检测,国内外多以基因型检测为主。与表型检测相比,基因型检测的成本更低,报告时间更快,对检测野生型和耐药病毒混合物的灵敏度更高。应在以下情况进行HIV基因型耐药检测:在启动ART前;治疗后病毒载量下降不理想或病毒学失败需改变治疗方案时。对于ART失败者,耐药检测应在未停用抗病毒药物时进行,如已停药,则需在停药后4周内进行耐药检测。
4 发病机制
HIV主要侵犯人体的免疫系统,包括CD4+T淋巴细胞、单核巨噬细胞和DC等,主要表现为CD4+T淋巴细胞数量不断减少,最终导致人体细胞免疫功能缺陷,引起各种机会性感染和肿瘤的发生。此外,HIV感染也会导致心血管疾病(cardiovascular disease,CVD)、骨病、肾病和肝功能不全等疾病的发病风险增加。
HIV进入人体后,在24~48 h到达局部淋巴结,5~10 d左右在外周血中可以检测到病毒成分,继而产生病毒血症,导致急性感染,以CD4+T淋巴细胞数量短期内一过性迅速减少为特点。大多数感染者未经特殊治疗,CD4+T淋巴细胞数可自行恢复至正常水平或接近正常水平。由于病毒储存库的存在,宿主免疫系统不能完全清除病毒,形成慢性感染,包括无症状感染期和有症状感染期。国际上报道无症状感染期持续时间平均约8年,需注意的是,我国男男性行为感染HIV者的病情进展较快,在感染后平均4.8年进展至艾滋病期[9],无症状期主要表现为CD4+T淋巴细胞数量持续缓慢减少;进入有症状期后CD4+T淋巴细胞数量再次快速减少,多数感染者CD4+T淋巴细胞计数在350个/μL以下,部分晚期患者甚至降至200个/μL以下。HIV感染导致CD4+T淋巴细胞计数下降的主要原因包括:(1)HIV引起CD4+T淋巴细胞凋亡或焦亡;(2)HIV复制所造成的直接杀伤作用,包括病毒出芽时引起细胞膜完整性的改变等;(3)HIV复制所造成的间接杀伤作用,包括炎症因子的释放或免疫系统的杀伤作用;(4)HIV感染导致胸腺组织的萎缩和胸腺细胞的死亡等。HIV引起的免疫异常除了CD4+T淋巴细胞数量减少,还包括CD4+T淋巴细胞、B淋巴细胞、单核巨噬细胞、自然杀伤细胞和DC的功能障碍与异常免疫激活。
感染HIV后,临床上可表现为典型进展、快速进展和长期缓慢进展三种转归。影响HIV感染临床转归的主要因素有病毒、宿主免疫和遗传背景等。
人体通过固有免疫和适应性免疫应答对抗HIV感染。黏膜是HIV侵入机体的主要门户,又是HIV增殖的场所,是HIV通过性途径传播的重要通道。HIV也可通过破损的黏膜组织进入人体,随即局部固有免疫细胞,如单核巨噬细胞、DC、自然杀伤细胞和γδT细胞等进行识别、内吞并杀伤处理后将病毒抗原提呈给适应性免疫系统,之后2~12周,人体即产生针对HIV蛋白的各种特异性抗体,其中中和抗体在控制病毒复制方面具有重要作用[10]。特异性细胞免疫主要包括HIV特异性CD4+T淋巴细胞免疫反应和特异性细胞毒性T淋巴细胞反应。
绝大多数HIV/AIDS患者经过ART后,HIV所引起的免疫异常改变可恢复至正常或接近正常水平,即免疫功能重建,包括CD4+T淋巴细胞数量和免疫功能的恢复。然而,10%~40%的HIV/AIDS患者即使能够长期维持病毒抑制,仍不能完全实现免疫重建,这些患者被称为免疫重建不良者或免疫无应答者。与达到完全免疫重建的患者相比,免疫重建不良患者艾滋病相关和非艾滋病相关疾病的发病率和病死率均升高[11]。
5 临床表现与分期
从初始感染HIV至终末期是一个较为漫长、复杂的过程,在病程的不同阶段,与HIV相关的临床表现也是多种多样。根据感染后的临床表现,HIV感染的全过程可分三个期,即急性期、无症状期和艾滋病期。
5.1 急性期
通常发生在感染HIV后的6个月内。部分感染者在急性期出现HIV病毒血症和免疫系统急性损伤相关临床表现。临床表现以发热最为常见,可伴有咽痛、盗汗、恶心、呕吐、腹泻、皮疹、关节疼痛、淋巴结肿大及神经系统症状。大多数患者临床症状轻微,持续1~3周后自行缓解。
此期在血液中可检测到HIV RNA和p24抗原,CD4+T淋巴细胞计数一过性减少,CD4+/CD8+T淋巴细胞比值倒置。部分患者可有轻度白细胞和血小板计数减少或肝脏生化指标异常。
5.2 无症状期
可从急性期进入此期,或无明显的急性期症状而直接进入此期。持续时间一般为4~8年。其时间长短与感染病毒的数量和型别、感染途径、机体免疫状况的个体差异、营养条件及生活习惯等因素有关。在无症状期,由于HIV在感染者体内不断复制,免疫系统受损,CD4+T淋巴细胞计数逐渐下降,可出现淋巴结肿大等症状或体征。
5.3 艾滋病期
为感染HIV后的终末阶段。患者CD4+T淋巴细胞计数多<200个/μL。此期主要临床表现为HIV相关症状、体征及各种机会性感染和肿瘤。
6 诊断标准[12]
诊断原则:HIV/AIDS的诊断需结合流行病学史(包括不安全性生活史、静脉注射毒品史、输入未经抗HIV抗体检测的血液或血液制品、HIV抗体阳性者所生子女或职业暴露史等)、临床表现和实验室检查等进行综合分析,慎重做出诊断。HIV抗体和病原学检测是确诊HIV感染的依据;流行病学史是诊断急性期和婴幼儿HIV感染的重要参考;CD4+T淋巴细胞检测和临床表现是HIV感染分期诊断的主要依据;AIDS的指征性疾病是AIDS诊断的重要依据。HIV感染者是指感染HIV后尚未发展至艾滋病期的个体;AIDS患者是指感染HIV后发展至艾滋病期的患者。
成人、青少年及18月龄以上儿童,符合下列1项者即可诊断HIV感染:(1)HIV抗体筛查试验阳性和HIV补充试验阳性(抗体补充试验阳性或核酸定性检测阳性或核酸定量>5000拷贝/mL);(2)有流行病学史或艾滋病相关临床表现,2次HIV核酸检测均为阳性;(3)HIV分离试验阳性。
18月龄及以下儿童,符合下列1项者即可诊断HIV感染:(1)为HIV感染母亲所生和2次HIV核酸检测均为阳性(第2次检测需在出生4周后采样进行);(2)有医源性暴露史,HIV分离试验结果阳性或2次HIV核酸检测均为阳性;(3)为HIV感染母亲所生和HIV分离试验阳性。
6.1 HIV感染早期的诊断标准
早期即Ⅰ期,成人及15岁(含15岁)以上青少年HIV感染者,符合下列1项即可诊断:(1)3~6个月内有流行病学史和(或)有急性HIV感染综合征和(或)有持续性全身性淋巴腺病(persistent gener-alized lymphadenopathy,PGL);(2)抗体筛查试验无反应,2次核酸检测均为阳性;(3)1年内出现HIV血清抗体阳转。15岁以下儿童HIV感染者Ⅰ期的诊断需根据CD4+T淋巴细胞计数和相关临床表现进行[12]。
6.2 HIV感染中期的诊断标准
中期即Ⅱ期,成人及15岁(含15岁)以上青少年HIV感染者,符合下列1项即可诊断:(1)CD4+T淋巴细胞计数为200~500个/μL;(2)无症状或符合无症状期相关临床表现。15岁以下儿童HIV感染者Ⅱ期的诊断需根据CD4+T淋巴细胞计数和相关临床表现进行[12]。
6.3 艾滋病期的诊断标准
Ⅲ期,也称为艾滋病期,成人及15岁(含15岁)以上青少年,HIV感染并合并下述各项中的任何1项,即可确诊为艾滋病期;或确诊HIV感染,且CD4+T淋巴细胞计数<200个/μL,可诊断为艾滋病期。
(1)不明原因的持续不规则发热38 ℃以上,>1个月;(2)腹泻(大便次数多于3次/d),>1个月;(3)6个月之内体质量下降10%以上;(4)反复发作的口腔真菌感染;(5)反复发作的单纯疱疹病毒感染或带状疱疹病毒感染;(6)肺孢子菌肺炎(pneumo-cystis pneumonia,PCP);(7)反复发生的细菌性肺炎;(8)活动性结核病(mycobacterium tuberculosis,MTB)或非结核分枝杆菌(nontuberculosis mycobac-teria,NTM)病;(9)深部真菌感染;(10)中枢神经系统占位性病变;(11)中青年人出现痴呆;(12)活动性巨细胞病毒(cytomegalovirus,CMV)感染;(13)弓形虫脑病;(14)马尔尼菲篮状菌病;(15)反复发生的败血症;(16)卡波西肉瘤、淋巴瘤。
15岁以下儿童符合下列1项者即可诊断为艾滋病期:HIV感染和CD4+T淋巴细胞百分比<25%(<12月龄),或<20%(12~36月龄),或<15%(37~60月龄),或CD4+T淋巴细胞计数<200个/μL(5~l4岁);HIV感染和伴有至少1种儿童AIDS指征性疾病。
7 常见机会性感染[13- 14]
7.1 PCP
7.1.1 诊断
(1)亚急性起病,呼吸困难逐渐加重,伴有发热、干咳、胸闷,症状逐渐加重,严重者发生呼吸窘迫;(2)肺部阳性体征少,或可闻及少量散在的干、湿啰音,体征与疾病症状的严重程度往往不成比例;(3)胸部X线检查可见双肺从肺门开始的弥漫性网状结节样间质浸润,肺部CT检查示双肺毛玻璃状改变,13%~18%的患者同时合并细菌或分枝杆菌感染,肺部影像学可有相应表现;(4)血气分析示低氧血症,严重病例动脉血氧分压(arterial partial pressure of oxygen,PaO2)明显降低,常在60 mm Hg(1 mm Hg=0.133 kPa)以下;(5)血乳酸脱氢酶常>500 mg/dL;血浆(1,3)-β-D葡聚糖(1,3-β-D-glucan,BDG)水平明显高于正常值[15];(6)确诊依靠病原学检查如痰液或支气管肺泡灌洗/肺活检等发现肺孢子菌的包囊或滋养体。PCR也是一种可供选择的诊断方法[16]。
7.1.2 治疗
(1)对症治疗:卧床休息,给予吸氧,注意水和电解质平衡。(2)病原治疗:首选复方磺胺甲噁唑(SMZ-TMP),轻-中度患者口服甲氧苄啶(TMP)15~20 mg/(kg·d),磺胺甲噁唑(SMZ)75~100 mg/(kg·d),分3~4次用,疗程为21 d,必要时可延长疗程。重症患者给予静脉用药,剂量同口服。SMZ-TMP过敏者可试行脱敏疗法。替代治疗:克林霉素600~900 mg,静脉滴注,每8 h一次,或450 mg口服,每6 h一次;联合应用伯氨喹15~30 mg,口服,1次/d,疗程为21 d。氨苯砜100 mg,口服,1次/d;联合应用TMP 200~400 mg,口服,2~3次/d,疗程为21 d。或喷他脒,3~4 mg/kg,1次/d,缓慢静脉滴注(60 min以上),疗程为21 d。(3)激素治疗:中重度患者(PaO2<70 mm Hg或肺泡-动脉血氧分压差>35 mm Hg),早期(72 h内)可应用激素治疗,泼尼松40 mg,2次/d,口服5 d,改为20 mg,2次/d,口服5 d,改为20 mg,1次/d,至疗程结束;静脉用甲基泼尼松龙剂量为上述泼尼松的75%。(4)辅助通气:如患者进行性呼吸困难明显,可给予辅助通气。(5)ART:尽早进行ART,通常在启动抗PCP治疗后2周内进行。
7.1.3 预防
(1)预防指征:CD4+T淋巴细胞计数<200个/μL的成人和青少年,包括孕妇及接受ART者。(2)药物选择:首选SMZ-TMP,一级预防为1片/d,二级预防为2片/d。若患者对该药不能耐受或过敏,替代药品为氨苯砜。PCP患者经ART后CD4+T淋巴细胞计数增加至>200个/μL并持续≥6个月时,可停止预防用药;接受ART,CD4+T淋巴细胞计数在100~200个/μL,病毒载量持续低于检测下限3~6个月,也可考虑停止预防用药。如CD4+T淋巴细胞计数再次降低至<200个/μL时,应重启预防用药。
7.2 结核病
7.2.1 诊断[17]
结核病可出现在任何CD4+T淋巴细胞计数水平的HIV/AIDS患者中。HIV/AIDS合并结核病的诊断需结合临床表现、辅助检查、病理学检查和影像学检查结果进行综合判断,尤其需注意发生于HIV/AIDS患者的结核病在临床表现及诊断方面有其自身特点,不能将非HIV/AIDS患者人群结核病的诊断方法简单地套用于HIV/AIDS患者合并结核病的诊断中,在进行诊断时应注意患者的免疫功能状态,CD4+T淋巴细胞计数较高患者的临床表现与普通结核病患者类似,而CD4+T淋巴细胞计数低的患者常表现为肺外结核病或播散性结核病。对于结核病的诊断,世界卫生组织(World Health Organization,WHO)指南[18]推荐快速分子诊断方法如Xpert MTB/RIF和Xpert MTB/RIF Ultra作为初始诊断检测技术;研究显示,在HIV/AIDS患者中采用Xpert MTB/RIF技术诊断肺结核的灵敏度和特异度均较高,且可快速区分MTB和NTM,具有较好的应用价值[19]。抗酸染色涂片、培养和快速分子检测技术如Xpert MTB/RIF以及组织病理检查是目前确诊结核病的主要方法。
7.2.2 治疗
HIV/AIDS患者结核病的治疗原则与普通患者相同,但抗结核药物使用时应注意与抗病毒药物之间的相互作用和配伍禁忌。
抗结核治疗药物主要有异烟肼、利福平、利福布汀、乙胺丁醇和吡嗪酰胺。如果MTB对一线抗结核药物敏感,则使用异烟肼+利福平(或利福布汀)+乙胺丁醇+吡嗪酰胺进行2个月的强化期治疗,然后使用异烟肼+利福平(或利福布汀)进行4个月的巩固期治疗。对抗结核治疗反应延迟(即在抗结核治疗2个月后仍有结核病相关临床表现或MTB培养仍为阳性)、骨和关节结核病患者,抗结核治疗疗程应延长至9个月。中枢神经系统结核病患者,疗程应延长至9~12个月。
所有合并结核病的HIV/AIDS患者,无论CD4+T淋巴细胞计数水平的高低,均应接受ART。鉴于免疫重建炎症综合征(immune reconstitution inflammatory syndrome,IRIS)即便出现,也很少导致死亡,目前主张合并结核病的患者尽早启动ART[13,20- 22],推荐在抗结核治疗后2周内尽早启动ART。对于合并活动性结核病的儿童,无论CD4+T淋巴细胞水平的高低,均建议在抗结核后2周内尽早启动ART。HIV感染孕妇合并活动性结核病,为了母亲健康和阻断HIV母婴传播,ART也应尽早进行。如合并耐药结核病[包括耐多药结核病(multidrug resistant tuberculosis,MDR-TB)或广泛耐药结核病(extensive drug resistant tuberculosis,XDR-TB)],在使用二线抗结核药物后8周内开始ART。对于中枢神经系统结核病患者,早期启动ART发生IRIS的风险较高,此类患者启动ART的最佳时机尚未明确,通常建议在抗结核后的4~8周启动ART。
对于合并结核病的患者,需密切监测药物不良反应,并注意药物间相互作用,必要时调整抗病毒或抗结核药物剂量,或进行血药浓度监测(therapeutic drug monitoring,TDM)以指导治疗。
7.2.3 预防[13,17,23]
HIV/AIDS患者(包括已接受ART的患者、孕妇和曾经接受过抗结核病治疗者)如排除了活动性结核病,无论免疫抑制的程度,即使未进行潜伏结核相关检测(如干扰素-γ释放试验),也均应接受结核预防性治疗(tuberculosis preventive treatment,TPT),但在启动TPT之前应注意排除活动性结核病。TPT的优选方案为:异烟肼5 mg/(kg·d),口服,1次/d,共9个月。联合使用维生素B6可减少周围神经炎的发生(25 mg/d,口服,用至预防用药疗程结束)。替代方案:利福平10 mg/(kg·d),口服,1次/d,共4个月。
7.3 非结核分枝杆菌感染
HIV/AIDS患者可并发NTM感染,其中主要为鸟分枝杆菌复合群(mycobacterium avium complex,MAC)感染。
7.3.1 诊断
MAC感染的临床症状同活动性结核病相似,但全身播散性病变更为常见,可累及多脏器,表现为贫血、肝脾大及全身淋巴结肿大。确诊有赖于从血液、淋巴结、骨髓及其他无菌组织或体液中培养出NTM,并通过DNA探针、高效液相色谱、质谱技术或生物化学反应进行菌种鉴定。胶体金法可用于NTM的初步鉴定,采用PCR加基因测序的方法可对临床分离的常见分枝杆菌进行鉴定。粪便或活检组织的抗酸染色涂片与培养及影像学检查等可协助诊断。
7.3.2 治疗
MAC感染治疗的首选方案[24]:克拉霉素500 mg/次,2次/d(或阿奇毒素500 mg/d) +乙胺丁醇15 mg/(kg·d),同时联合应用利福布汀(300~600 mg/d)。严重感染及严重免疫抑制(CD4+T淋巴细胞计数<50个/μL)的患者可加用阿米卡星[10 mg/(kg·d),肌内注射,1次/d]或喹诺酮类抗菌药物如左氧氟沙星或莫西沙星。疗程通常至少12个月。其他NTM感染的治疗需根据具体鉴定的菌种及药物敏感试验结果采取相应的治疗措施[21]。在抗MAC治疗开始2周后尽快启动ART。
7.3.3 预防
(1)一级预防:立即启动ART的患者,不推荐一级预防;如未接受ART或已接受ART,但HIV RNA未被完全抑制,且目前还无有效的ART,CD4+T淋巴细胞计数<50个/μL,排除播散性MAC的患者,应予以一级预防[13]。一级预防的方案为克拉霉素500 mg/次,2次/d;或阿奇霉素,1200 mg/周。如患者不能耐受克拉霉素和阿奇霉素,排除活动性结核病后可选择利福布汀进行预防治疗,常规剂量为300 mg/次,1次/d。未启动ART的患者一旦启动了有效的ART,即可停止预防用药。(2)二级预防:MAC感染者在完成规范的治疗后,需长期维持治疗(二级预防)直至患者CD4+T淋巴细胞计数>100个/μL,并持续>6个月时为止。二级预防的方案与初始治疗方案一致。
7.4 巨细胞病毒感染
CMV感染是HIV/AIDS患者最常见的疱疹病毒感染,可分为CMV血症和器官受累的CMV病。CMV可侵犯患者多个器官系统,包括眼、肺、消化系统、中枢神经系统等,其中CMV视网膜脉络膜炎最常见。
7.4.1 CMV视网膜炎的诊断和治疗
诊断:典型的症状包括飞蚊症、漂浮物、盲点或外周视野缺损,患者常表现为快速视力下降,眼底检查表现为“番茄炒鸡蛋样”改变,沿血管分布的浓厚的黄白色视网膜损伤,伴或不伴视网膜内出血;80%的CMV视网膜炎患者玻璃体液中可检测到CMV DNA;确诊有赖于检眼镜检查。
治疗:(1)推荐的全身治疗方案:① 更昔洛韦5 mg/kg静脉滴注,1次/12 h,连续14~21 d,然后5 mg/kg静脉滴注,1次/d;② 更昔洛韦5 mg/kg静脉滴注,1次/12 h,连续14~21 d,然后缬更昔洛韦900 mg,口服,1次/d,或更昔洛韦1.0 g,口服,3次/d;③ 缬更昔洛韦900 mg,口服,1次/12 h,治疗14~21 d,然后900 mg,1次/d,或更昔洛韦1.0 g,口服,3次/d。替代治疗方案可选择:膦磷钾酸钠60 mg/kg静脉滴注,1次/8 h或90 mg/kg静脉滴注,1次/12 h,14~21 d,而后改为90~120 mg/kg静脉滴注,1次/d,或更昔洛韦1.0 g,口服,3次/d。(2)局部治疗:需眼科医师参与,玻璃体内注射更昔洛韦(2 mg/针)或膦甲酸(2.4 mg/针),每周重复1次,疗程至视网膜病变被控制、病变不活动为止。
7.4.2 其他部位CMV感染的诊断和治疗
(1)CMV肺炎:临床表现为发热、咳嗽、呼吸困难,胸部X线表现为间质性改变。CMV肺炎的诊断较为困难,主要依靠临床症状、影像学改变和病理结果(肺组织或细胞中见CMV包涵体),同时需排除其他常见病原体感染。治疗:建议静脉使用更昔洛韦、膦甲酸钠或联合治疗,疗程尚不明确。(2)CMV食管炎或肠炎:临床表现为发热、吞咽困难或吞咽疼痛、腹泻、水样便或血水样便,伴有腹痛。胃镜或肠镜可见黏膜溃疡,组织病理学可见CMV包涵体。治疗:同CMV视网膜炎治疗药物相同,疗程3~4周或症状体征消失后维持用药。(3)CMV脑炎:临床表现为神经精神改变,昏睡、精神错乱、意识模糊、迟钝、失语、视力障碍、无力、癫痫发作、面瘫等。诊断依赖于脑脊液或脑组织PCR进行CMV DNA的检测,灵敏度为80%,特异度为90%。治疗:采用更昔洛韦联合膦甲酸钠治疗3~6周,剂量同CMV视网膜炎治疗剂量,后维持治疗至脑脊液CMV定量转阴,具体应个体化治疗。
7.4.3 ART
在抗CMV治疗开始2周内尽快启动ART。
7.4.4 预防
CMV感染不主张进行一级预防。对于CD4+T淋巴细胞计数<200个/μL的患者,可定期检查眼底。一旦出现CMV病,应积极治疗,在CMV视网膜炎疾病控制、病变不活动之后需继续预防用药,通常采用更昔洛韦(1.0 g,3次/d,口服)以预防复发。经ART后CD4+T淋巴细胞计数>100个/μL且持续3~6个月时,可考虑停止预防用药,而CMV肠炎、CMV肺炎和CMV神经病变不主张二级预防。
7.5 单纯疱疹和水痘-带状疱疹病毒感染[25]
7.5.1 诊断
根据典型的临床表现,单纯疱疹和带状疱疹的诊断并不困难。可通过收集疱液,采用PCR检测、病毒培养进行确诊。
7.5.2 治疗
主要治疗药物包括阿昔洛韦、泛昔洛韦、伐昔洛韦和膦甲酸钠。HIV合并水痘-带状疱疹病毒感染,推荐使用阿昔洛韦或膦甲酸钠治疗。(1)口唇单纯疱疹疗程5~10 d,生殖器单纯疱疹疗程5~14 d;方案:阿昔洛韦口服,每次400 mg,3次/d。(2)重型黏膜单纯疱疹:阿昔洛韦静脉滴注,每次5 mg/kg,1次/8 h,待黏膜损伤开始愈合后更换阿昔洛韦口服,每次400 mg,3次/d,损伤完全愈合后停药。(3)阿昔洛韦治疗抵抗(耐药)的单纯疱疹患者:推荐膦甲酸钠静脉滴注,每次40 mg/kg,1次/8 h或1次/12 h,直至治愈。(4)局部皮肤带状疱疹:阿昔洛韦静脉滴注,每次5~10 mg/kg,1次/8 h,疗程7 d。(5)严重的皮肤黏膜带状疱疹:膦甲酸钠静脉滴注,每次40 mg/kg,1次/8 h或1次/12 h或阿昔洛韦静脉滴注,每次10 mg/kg,1次/8 h,病情稳定后更换伐昔洛韦口服,每次1.0 g,3次/d,直至病变消失。(6)急性视网膜坏死:阿昔洛韦10 mg/kg,1次/8 h,静脉滴注,病情稳定后更换伐昔洛韦口服,每次1.0 g,3次/d。
7.6 弓形虫脑病
7.6.1 诊断
临床表现为发热伴局灶或弥漫性中枢神经系统损伤。头颅CT呈单个或多个低密度病灶,增强扫描呈环状或结节样增强,周围一般有水肿带。MRI表现为颅内多发长T1和长T2信号。正电子发射断层显像(positron emission tomography,PET)检查有助于临床诊断。免疫学方法主要检测血清或组织液等标本中的弓形虫抗体,可作为弓形虫病的辅助诊断。确诊依赖脑活检。
7.6.2 治疗
(1)病原治疗:首选乙胺嘧啶(负荷量100 mg,2次/d,口服,此后50~75 mg/d维持)+磺胺嘧啶(1~1.5 g,4次/d,口服)。(2)替代治疗:SMZ-TMP(3片,3次/d,口服)联合克林霉素(600 mg/次,静脉给药,1次/6 h)或阿奇霉素(0.5 g/d)。疗程至少为6周。(3)对症治疗:降颅压、抗惊厥、抗癫痫等。
7.6.3 预防
对于无弓形虫脑病病史但CD4+T淋巴细胞计数<200个/μL且弓形虫IgG抗体阳性者应给予预防用药,一般采用SMZ-TMP,2片/次,1次/d。接受ART后,CD4+T淋巴细胞计数在100~200个/μL,病毒载量持续低于检测下限3~6个月,可考虑停止预防用药。对既往患过弓形虫脑病者需长期使用乙胺嘧啶(25~50 mg/d)联合磺胺嘧啶(2~4 g/d)预防,直至CD4+T淋巴细胞计数增加至>200个/μL并持续≥6个月。一旦CD4+T淋巴细胞数下降至<200个/μL,需重启预防用药。
7.7 真菌感染
7.7.1 诊断
临床上常见的是念珠菌感染和新生隐球菌感染,除此之外,在南方或潮湿多雨地区马尔尼菲篮状菌也较常见,诊断依靠临床表现或感染部位培养或病理发现病原体。新生隐球菌感染主要发生于CD4+T淋巴细胞计数<100个/μL的患者中,血或脑脊液隐球菌乳胶凝胶试验可辅助诊断新生隐球菌感染。隐球菌脑膜炎或脑膜脑炎临床上的主要表现包括发热、渐进性头痛、精神和神经症状;颅内压增高比较常见,患者头痛及恶心、呕吐较剧烈;脑脊液涂片墨汁染色镜检可查见隐球菌。马尔尼菲篮状菌病主要发生于CD4+T淋巴细胞计数<50个/μL,表现为发热、贫血、咳嗽、皮疹、全身淋巴结肿大及肝脾大,脐凹样皮疹,检测马尔尼菲篮状菌特异性甘露糖蛋白Mp1p和半乳甘露聚糖(galactomannan,GM)可辅助快速诊断[26];确诊依靠血液、骨髓及其他无菌体液中培养出马尔尼菲篮状菌。
7.7.2 治疗
7.7.2.1 念珠菌感染[27]
(1)口腔念珠菌感染:首选口服氟康唑100~200 mg/d,共7~14 d;替代疗法为伊曲康唑口服液200 mg,1次/d,共7~14 d;或制霉菌素局部涂抹加碳酸氢钠漱口水漱口。
(2)食道念珠菌感染:口服或静脉注射氟康唑100~400 mg/d,或伊曲康唑口服液200 mg,1次/d,或伏立康唑200 mg,2次/d,口服;疗程14~21 d。对于合并口咽或食管真菌感染的患者应尽快进行ART,可在抗真菌感染的同时进行ART。
7.7.2.2 新生隐球菌感染
(1)隐球菌脑膜炎或脑膜脑炎[13,28]
病原治疗原则:分诱导期、巩固期、维持期3个阶段进行治疗(参考《隐球菌性脑膜炎诊治专家共识》[28])(表1)。诱导期治疗的经典方案为两性霉素B+5-氟胞嘧啶。两性霉素B从0.02~0.1 mg/(kg·d)开始,逐渐增加剂量至0.5~0.7 mg/(kg·d),两性霉素B不良反应较多,需严密观察。诱导治疗期至少4周,在临床症状改善与脑脊液培养转阴后改为氟康唑(600~800 mg/d)进行巩固期治疗,巩固治疗期至少6周,而后改为氟康唑(200 mg/d)进行维持治疗,维持期至少1年,持续至患者行ART后CD4+T淋巴细胞计数>100个/μL并持续至少6个月时可停药。
降颅压治疗:颅内压增高者需积极降压治疗,常用降颅内压方法有药物降压、腰椎穿刺引流、腰大池置管引流、侧脑室外引流、脑室-腹腔分流术、留置Ommaya囊(贮液囊)等。置管持续外引流降颅压需严格无菌操作,加强护理,防止继发感染。
(2)肺隐球菌感染:弥漫性肺隐球菌感染的推荐治疗方案与中枢神经系统感染治疗方案一致。局灶性肺隐球菌感染:氟康唑400~800 mg/d,口服10周,而后改为200 mg/d口服维持,抗真菌治疗的总疗程为6个月。
(3)隐球菌抗原血症[13,22]:血隐球菌抗原定性检测阳性,建议给予氟康唑400~800 mg/d,口服10周,而后改为200 mg/d口服维持,总疗程6~12个月。
(4)ART:艾滋病合并隐球菌肺炎的患者应在抗隐球菌治疗2周后进行ART。对于合并隐球菌脑膜炎的患者过早进行ART可能会增加病死率,故ART应考虑适当延迟,一般以正规抗隐球菌治疗4~6周后启动[22,29];一些个体需提前启动ART,但保证脑脊液培养转阴后启动为宜[30]。
7.7.2.3 马尔尼菲篮状菌病
抗真菌治疗。诱导期:无论疾病严重程度,首选两性霉素B 0.5~0.7 mg/(kg·d)或两性霉素B脂质体3~5 mg/(kg·d),静脉滴注2周,需严密观察不良反应[31- 33];当患者不能耐受两性霉素B时,可采用替代方案,第1天伏立康唑静脉滴注或口服6 mg/kg(负荷剂量),1次/12 h,然后改为4 mg/kg,1次/12 h,不少于2周[31]。巩固期:口服伊曲康唑或伏立康唑200 mg,1次/12 h,共10周[32]。随后进行二级预防:口服伊曲康唑200 mg,1次/d,至患者通过ART后CD4+T淋巴细胞计数>100个/μL,并持续至少6个月可停药[34]。一旦CD4+T淋巴细胞计数<100个/μL,需重启预防治疗[32]。ART:在有效抗真菌治疗后1~2周内,可启动ART,注意避免抗真菌药物和抗病毒药物之间的相互作用及监测和防治IRIS。
8 抗病毒治疗
8.1 治疗目标
最大限度地抑制病毒复制,使病毒载量降低至检测下限并减少病毒变异;重建免疫功能;降低异常的免疫激活;减少病毒传播、预防母婴传播;降低HIV感染的发病率和病死率,减少非艾滋病相关疾病的发病率和病死率,使患者获得正常的预期寿命,提高生活质量。
8.2 国内现有抗反转录病毒药物介绍
目前国际上共有六大类30多种药物,分别为核苷类反转录酶抑制剂(nucleotide reverse transcriptase inhibitors,NRTIs)、非核苷类反转录酶抑制剂(non-nucleoside reverse transcriptase inhibitors,NNRTIs)、蛋白酶抑制剂(protease inhibitors,PIs)、整合酶抑制剂(integrase strand transfer inhibitors ,INSTIs)、融合抑制剂(fusion inhibitors,FIs)及CCR5抑制剂。国内抗反转录病毒的治疗药物有NRTIs、NNRTIs、PIs、INSTIs及FIs五大类(包括复合制剂),见表2。

表 1 隐球菌脑膜炎或脑膜脑炎抗真菌药物治疗方案
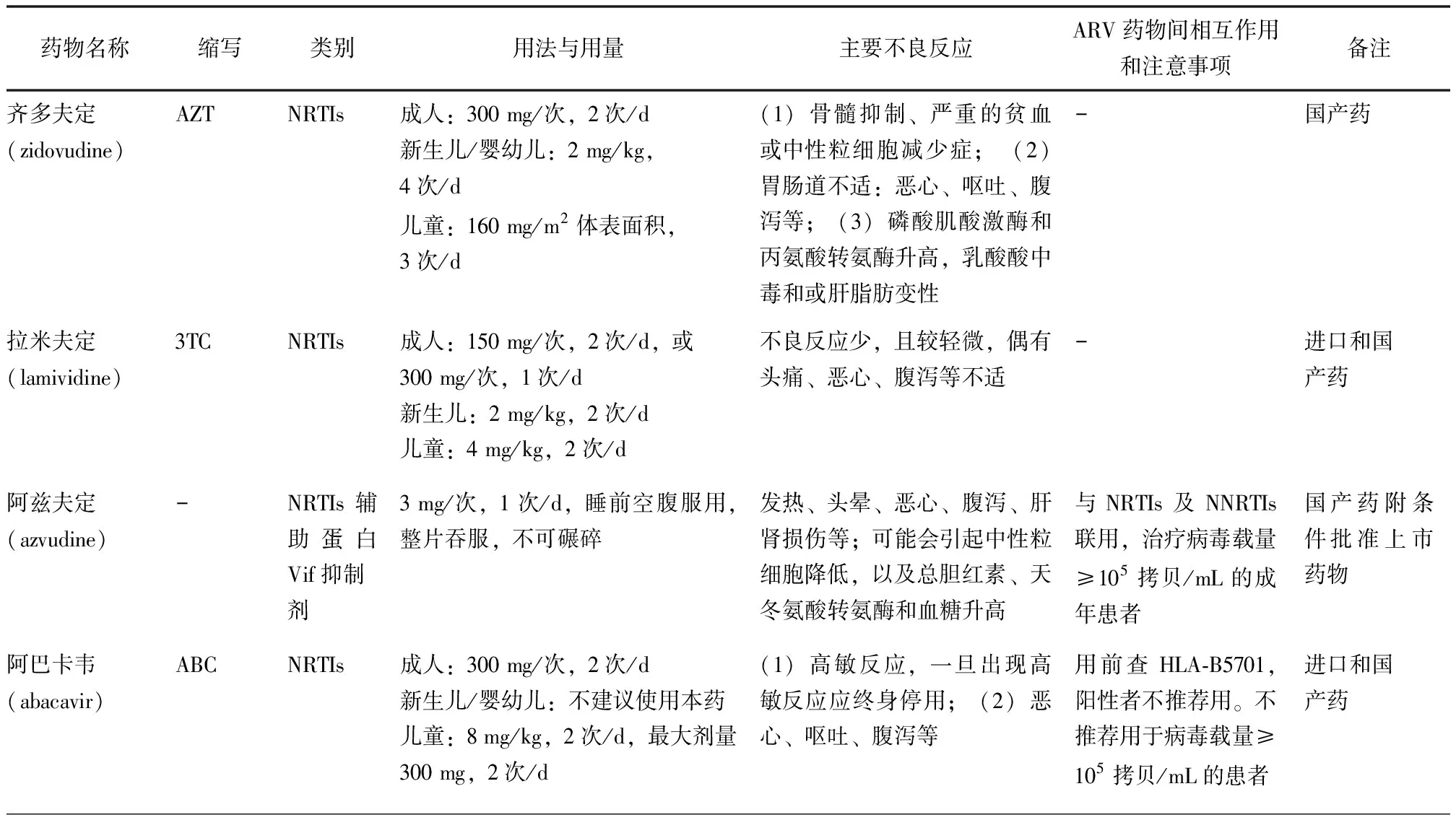
表 2 国内现有主要抗反转录病毒药物介绍
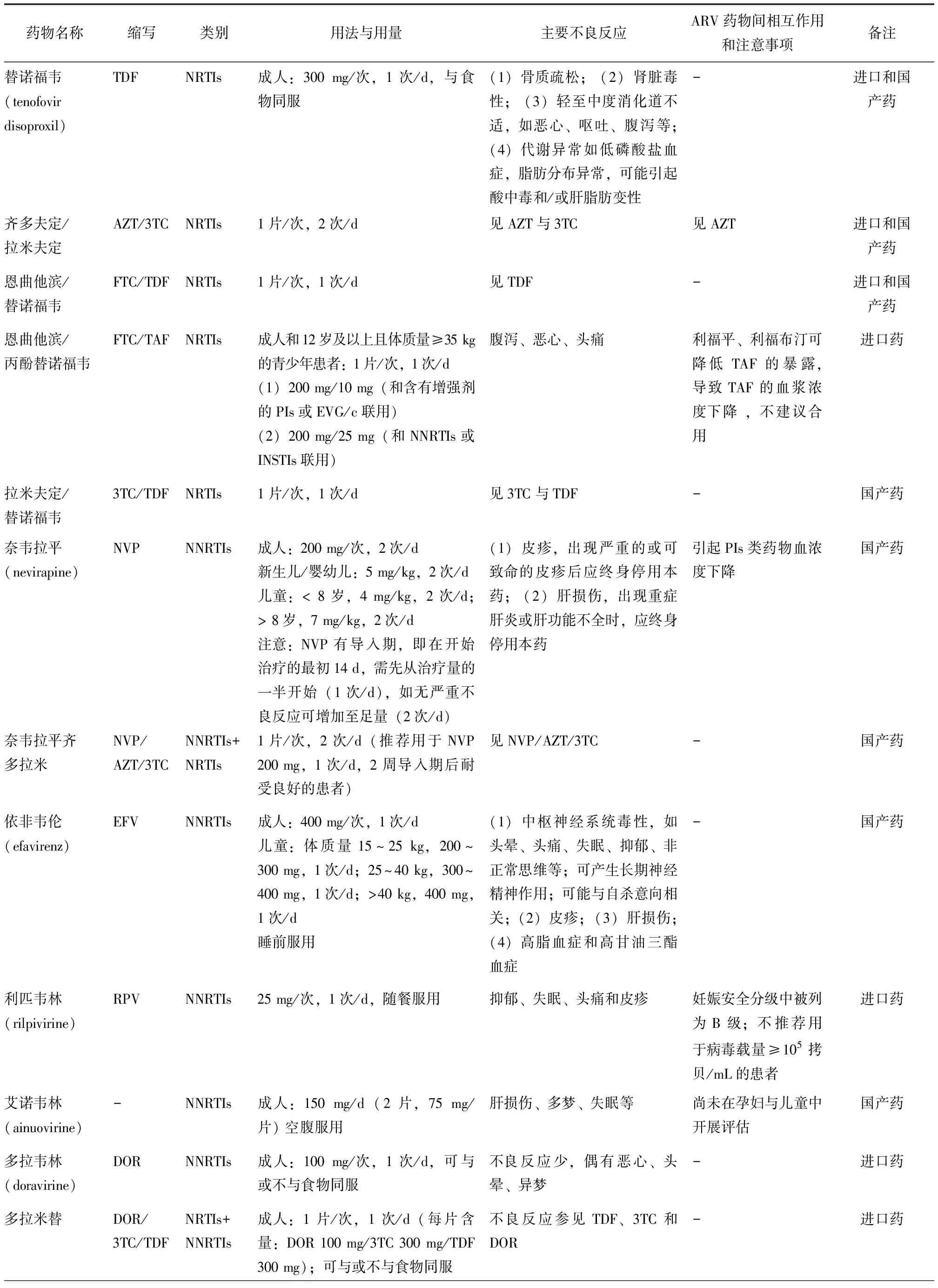
表 2 国内现有主要抗反转录病毒药物介绍

表 2 国内现有主要抗反转录病毒药物介绍
8.3 成人及青少年抗病毒治疗时机与方案[20- 22,35]
8.3.1 成人及青少年启动ART的时机
一旦确诊HIV感染,无论CD4+T淋巴细胞计数高低,均建议立即开始治疗。出现下列情况者需加快启动治疗:妊娠、诊断为AIDS、急性机会性感染、CD4+T淋巴细胞计数<200个/μL、HIV相关肾脏疾病、急性期感染、合并活动性HBV或丙型肝炎病毒(hepatitis C virus,HCV)感染。在开始ART前,一定要取得患者的配合和同意,教育患者提高服药的依从性;有条件的患者可考虑快速启动ART或确诊当天启动ART。如患者存在严重的机会性感染和处于慢性疾病急性发作期,应参考前述机会性感染控制病情,待稳定后开始治疗。启动ART后,需终身治疗。
8.3.2 成人及青少年初始ART方案
初治患者推荐方案为2种NRTIs类骨干药物联合第三类药物治疗。第三类药物可以为NNRTIs或增强型PIs(含利托那韦或考比司他)或INSTIs;也可选用复方单片制剂(single-tablet regimens,STR)。基于我国可获得的抗病毒药物,成人及青少年初治患者ART的推荐及替代方案见表3。

表 3 成人及青少年初治患者抗病毒治疗方案
8.4 特殊人群抗病毒治疗
8.4.1 儿童[22,36]
HIV感染儿童应尽早开始ART,如未及时进行ART,艾滋病相关病死率在出生后第1年可达20%~30%,第二年可超过50%。
8.4.1.1 HIV感染儿童抗病毒治疗的时机与方案
儿童一旦确诊HIV感染,无论CD4+T淋巴细胞计数水平高低,均建议立即开始ART。如某种原因不能启动ART,则需密切观察患者的病毒学、免疫学和临床状况,建议每3~4个月监测1次。
儿童患者初治推荐方案为2种NRTIs类骨干药物联合第三类药物治疗。第三类药物可以为INSTIs或NNRTIs或增强型PIs(含利托那韦或考比司他),基于我国目前的临床实践,推荐的具体治疗方案见表4。
8.4.1.2 HIV感染儿童的抗病毒治疗效果监测
(1)病毒载量是衡量ART效果的首要检测指标,治疗6个月后,每年或怀疑治疗失败时检测;(2)CD4+T淋巴细胞可作为监测ART效果的另一项有益的指标,每3~6个月检测1次,但其本身不能确定治疗成功或失败;(3)临床监测是儿童监测的必要部分,每次随访均应进行身高、体质量、生长发育标志及依从性监测。
8.4.1.3 儿童初治失败的处理
治疗失败后,最好根据耐药结果进行治疗方案的调整。(1)初治NNRTIs方案失败,换用DTG或增强型PIs+2 NRTIs,PIs首选LPV/r;(2)初治LPV/r方案失败,一般不是LPV/r耐药,可改善服药依从性,3个月后复查病毒载量。如病毒仍未控制,则换用DTG+2 NRTIs,如DTG不可及,则换用RAL+2 NRTIs;如DTG和RAL均不可及, 3岁以下儿童则维持原方案并进行依从性指导,3岁以上儿童可改为NNTRIs+2 NRTIs,NNTRIs首选EFV;(3)治疗失败后NRTIs的替换,ABC或TDF更换为AZT,AZT更换为TDF或ABC。
8.4.2 孕妇
参见“HIV母婴垂直传播阻断及单阳家庭生育”部分。
8.4.3 哺乳期妇女
母乳喂养具有传播HIV的风险,感染HIV的母亲应尽可能避免母乳喂养,尤其是病毒载量仍可以检测到的母亲,不推荐母乳喂养。如果坚持母乳喂养,则整个哺乳期应继续ART,方案与怀孕期间的ART方案一致,且在新生儿6月龄之后立即停止母乳喂养。

表 4 HIV感染儿童抗病毒治疗方案
8.4.4 合并结核分枝杆菌感染者
有关ART的时机参见“常见机会性感染的诊治与预防”中“结核病”相关内容。HIV/AIDS合并结核病患者推荐的一线ART方案为:AZT(TDF)+3TC(FTC)+EFV,也可选择含INSTIs的ART方案[20- 22]。研究显示,含DTG的ART方案可用于HIV感染合并结核病的患者,但DTG与利福平合用时,则需要增加其剂量(50 mg,2次/d)[37];由于在HIV感染合并结核病患者中的临床研究未能显示含RAL的ART方案的抗病毒疗效非劣效于含EFV的方案,故RAL通常仅用于部分艾滋病合并结核病的患者中[38- 39]。RAL与利福平合用时,推荐增加其剂量(800 mg,2次/d)。利福布汀对肝酶的诱导作用较弱,接受DTG或RAL治疗的HIV合并结核病患者可考虑使用利福布汀替代利福平,无需调整剂量。以上ART方案无法应用时,可使用含FIs的ART方案。不推荐EVG/c和新一代整合酶抑制剂BIC与利福霉素类药物合用。如患者使用利福布汀抗结核治疗,也可选择含PIs的ART方案。
8.4.5 静脉药物依赖者美沙酮维持
静脉药物依赖者开始ART的时机与普通患者相同,但应注意毒品成瘾性会影响患者的服药依从性,故在启动ART前应充分向患者说明依从性对治疗成败的重要性,并尽量采用简单的治疗方案、固定剂量联合方案,有条件者可考虑首选含RAL或DTG或BIC的ART方案。持续监督药物分发可有效提高依从性。另外,应注意抗病毒药物与美沙酮之间的相互作用。
8.4.6 合并HBV感染者
无论CD4+T淋巴细胞计数水平如何,只要无抗HIV暂缓治疗的指征,均建议尽早启动ART。(1)HIV/HBV合并感染者应同时治疗两种病毒感染,包括两种抗HBV活性的药物,ART方案核苷类药物选择推荐TDF(或TAF)+3TC(或FTC)(其中TDF+FTC、TDF+3TC、TAF+FTC均有合剂剂型),但TAF所致肾毒性和骨质疏松的发生率低于TDF[40]。(2)治疗过程中需对HBV相关指标,如HBV DNA定量、肝脏生物化学、肝脏影像学、HBV耐药等进行监测,警惕肝硬化、肝细胞癌的发生。(3)对于HIV/HBV合并感染者,不建议选择仅含有1种对HBV有活性的核苷类药物(TDF、3TC、恩替卡韦、替比夫定、阿德福韦)的方案治疗乙型肝炎,以避免诱导HIV对核苷类药物耐药性的产生。
需要注意[41]:(1)肾功能不全患者:如肾小球滤过率估算值(estimated glomerular filtration rate,eGFR)<60 mL/(min·1.73 m2),不能选择TDF或应调整TDF剂量;如30 mL/(min·1.73 m2) 8.4.7 合并HCV感染者 HIV/HCV合并感染患者ART的治疗方案可参考单纯HIV感染者。但需注意以下几点:(1)ART药物宜选择肝脏毒性较小的药物,有条件者可考虑首选含有INSTIs或FIs的ART方案。(2)合并HCV感染均建议抗HCV治疗,治疗方案参考丙型肝炎治疗相关指南,药物选择方面需考虑药物不良反应的累加及药物代谢的相互影响;应根据丙型肝炎治疗药物更换无药物相互作用的ART方案,可考虑短期更换INSTIs或FIs;为避免部分长半衰期药物的相互作用,建议在更改ART方案后推迟2周启动抗HCV治疗,结束抗HCV治疗后,如需重新换回原ART方案,也应推迟2周更换;因HCV治疗原因更改原ART方案时,建议2~8周内监测HIV RNA,以评估新的治疗是否能够有效抑制HIV。(3)CD4+T淋巴细胞计数<200个/μL,推荐先启动ART,待免疫功能得到一定程度恢复后再适时开始抗HCV治疗。 抗HCV治疗方案和疗程与单纯HCV感染者治疗方案相同,总体治疗效果相当。推荐使用直接抗病毒药物(direct-acting antiviral agents,DAAs)方案,应根据选择DAAs的不同,注意与ART药物间的相互作用。EFV和LPV/r因与一些DAAs药物存在相互作用,应用DAAs前需详细评估药物相互作用对DAAs的影响。如DAAs需与ART药物同时使用,建议查询相关药物相互作用说明,以合理选择用药。 需要注意,HIV/HBV/HCV三重感染的患者,在DAAs治疗过程中有诱发HBV活动进而导致肝功能衰竭的报道。因此,三重感染患者必须在包含抗HBV活性药物的ART方案治疗稳定后再开始抗HCV的DAAs治疗;HCV/HIV合并感染者应用DAAs治疗前应常规进行HBV标志物筛查[43]。 在ART过程中应定期进行临床评估和实验室检测,以评价ART的效果,及时发现抗病毒药物的不良反应,以及是否产生病毒耐药性等,及时更换药物以保证ART成功。 8.5.1 疗效评估 ART的有效性主要通过病毒学指标、免疫学指标和临床症状三方面进行评估,其中病毒学的改变是最重要的指标。(1)病毒学指标:大多数患者ART后血浆病毒载量4周内应下降1个log以上,在治疗后的3~6个月病毒载量应低于检测下限。(2)免疫学指标:启动ART后1年内,CD4+T淋巴细胞计数与治疗前相比增加30%或增长100个/μL,提示治疗有效。(3)临床症状:ART后患者机会性感染的发病率和艾滋病的病死率可以大大降低。对于儿童,可观察其身高、营养及发育改善情况。 8.5.2 病毒耐药性检测 病毒耐药是导致ART失败的主要原因之一,对ART疗效不佳或失败者可行基因型耐药检测。 8.5.3 药物不良反应观察 抗病毒药物的不良反应包括短期不良反应和长期不良反应,尤其是一些抗病毒药物导致的代谢紊乱、体质量增加、骨质疏松、肝肾损伤等不良反应需密切观察,及时识别并给予相应处理,必要时更换ART方案。抗病毒药物的不良反应及耐受性影响患者的服药依从性,进而影响ART疗效,所以密切监测并及时处理对于提高治疗效果至关重要。 8.5.4 药物浓度检测 在条件允许的情况下,可进行特殊人群的TDM,如儿童、妊娠妇女和肾功能不全患者等。 8.6.1 病毒学抑制患者的ART 病毒学抑制是指经规律抗病毒治疗24周以上,HIV载量小于检测下限(<20或<50拷贝/mL)。对于持续病毒学抑制的患者,可考虑根据需求进行方案的调整或优化,具体参考“HIV感染的全程管理”部分。 8.6.2 治疗失败患者的ART 病毒学失败是指在持续进行ART的患者中,开始治疗(启动或调整)24周后血浆病毒载量持续≥200拷贝/mL;或病毒学反弹,即在达到病毒学完全抑制后又出现病毒载量≥200拷贝/mL的情况。 出现病毒学失败时,应首先评估患者的治疗依从性、药物-药物或药物-食物相互作用,尤其服药依从性为治疗成败的决定因素。ART失败的患者应根据HIV耐药检测结果调整ART方案,用药方案选择的原则是更换至少2种ART药物,最好选择3种具有抗病毒活性的药物(可以是之前使用的药物种类中具有抗病毒活性的药物如3TC);新的ART方案通常应包括一个具有完全抗病毒活性的增强PIs或INSTIs或未曾使用过的新的作用机制药物如FIs,或上述药物联合应用。 常见ART药物因为其药物代谢途径、不良反应等特点,与很多其他种类药物产生药物相互作用。临床中要密切关注患者合并用药情况,并参考其他相关指南或药物说明书及时调整药物方案或调整药物剂量。 IRIS是指艾滋病患者在ART后免疫功能恢复过程中出现的一组临床综合征,主要表现为发热、潜伏感染的出现或原有感染的加重或恶化。多种潜伏或活动的机会性感染在ART后均可发生IRIS,如结核病和NTM感染、PCP、CMV感染、水痘-带状疱疹病毒感染、弓形虫病、隐球菌感染等。在合并HBV和HCV感染时,IRIS可表现为病毒性肝炎的活动或加重。IRIS多出现在ART后3个月内,需与原发或新发的机会性感染相鉴别。除机会性感染外,其他疾病如结节病和卡波西肉瘤也可出现IRIS。IRIS诊断的参考标准[13,17]:(1)患者接受ART后,结核病或隐球菌脑膜炎等机会性感染的临床症状出现恶化。在患者对ART产生应答的同时,伴随着过度炎症反应,结核病病情加重及病灶扩大或新出现病灶,隐球菌脑膜炎患者出现头痛加重、颅内压升高等。(2)临床症状加重与新的机会性感染、HIV相关肿瘤、药物不良反应、耐药或与治疗失败无关。(3)ART后病毒载量下降和/或CD4+T淋巴细胞计数增加。 IRIS出现后应继续进行ART。表现为原有感染恶化的IRIS通常为自限性,不用特殊处理而自愈;而表现为潜伏感染出现的IRIS,需进行针对性的抗病原治疗;严重者可短期应用激素或非甾体类抗炎药控制。激素应避免用于卡波西肉瘤患者及不确定的TB-IRIS患者(即不能排除治疗无效的情况)。CMV感染患者应慎用激素,如需使用,应采取短程口服治疗。 IRIS发生的危险因素包括首次进行ART、基线病毒载量高及基线CD4+T淋巴细胞数较低者[13]。有效控制急性期机会感染后再进行ART或ART前积极发现和治疗潜在机会性感染,可降低IRIS的发生率。 艾滋病相关肿瘤主要有非霍奇金淋巴瘤和卡波西肉瘤,也需关注非HIV定义性肿瘤如肝癌、肺癌、肛周肿瘤等的筛查、诊治和处理。肿瘤的确诊依赖病理活检。治疗需根据病情给予个体化综合治疗,包括手术、化疗、靶向治疗、免疫治疗、介入和放射治疗(具体请参考相关指南)。所有艾滋病合并肿瘤的患者均建议尽早启动ART,需注意抗病毒药物和抗肿瘤药物之间的相互作用,尽量选用骨髓抑制作用和药物间相互作用小的ART方案,如含INSTs或FIs的方案。肿瘤的诊治不应因感染HIV而降低要求,提倡多学科协作诊疗(multi-disciplinary treatment,MDT)模式的应用,应与肿瘤科、介入科、病理科、外科等专家共同制订诊治方案。治疗过程中注意预防各种并发症,尤其是感染的发生。 预防艾滋病母婴传播应综合考虑3个原则:(1)降低HIV母婴传播率;(2)提高婴儿健康水平和婴儿存活率;(3)关注母亲及所生儿童的健康。预防艾滋病母婴传播的有效措施为:尽早使用抗反转录病毒药物干预+安全助产+产后喂养指导。 所有感染HIV的孕妇无论其CD4+T淋巴细胞计数多少或疾病临床分期如何,均应尽早终身接受ART。首选方案:TDF/FTC(或TDF+3TC或ABC/3TC或ABC+3TC)+RAL或DTG。推荐含RAL或DTG的方案作为孕妇和育龄期有怀孕意愿女性的首选治疗方案。孕期应用BIC的数据不足,目前不推荐其应用于怀孕人群。由于在妊娠中期和晚期药物浓度不足,EVG/c应避免在孕妇中应用[20]。 替代方案:TDF/FTC(或TDF+3TC,或ABC/3TC,或ABC+3TC,或AZT/3TC,或AZT+3TC,或TAF/FTC)+EFV(或RPV,或LPV/r)。 EFV可用于妊娠各个阶段。LPV/r临床用药经验多,但消化道反应比较明显,且有增加早产和低体质量儿的风险[45]。TAF/FTC作为备选方案,可用于怀孕14周以后。 HIV感染母亲所生婴儿应在出生后尽早(6 h内)预防性服用抗病毒药物,具体服药方案根据暴露风险确定[46]。(1)普通暴露风险儿童:对于母亲已接受ART,依从性较好,且达到长期病毒学抑制者,可给予4周AZT或NVP进行预防,如选择母乳喂养,应首选NVP。(2)高暴露风险儿童:对于孕期ART未达到长期病毒学抑制、治疗不满12周或产时发现HIV感染的孕产妇所生婴儿应使用三联药物AZT+3TC+NVP(或LPV/r)至出生后6周:出生后2周内使用AZT+3TC+NVP,出生2周后至6周使用AZT+3TC+LPV/r。有条件的情况下,出生至6周可以使用AZT+3TC+RAL[45]。 为预防PCP,所有HIV感染母亲所生婴儿在完成4~6周HIV预防治疗后应进行PCP预防,除非已排除HIV感染。 对于已确定HIV感染的孕妇,主动提供预防艾滋病母婴传播咨询与评估,由孕产妇及其家人在知情同意的基础上做出终止妊娠或继续妊娠的决定。 对于选择终止妊娠的HIV感染孕妇,应给予安全的人工终止妊娠服务,应尽早手术,以减少并发症的发生。对于选择继续妊娠的孕妇,应给予优质的孕期保健、产后母乳喂养等问题的咨询,并采取相应的干预措施。 应为HIV感染孕妇及其家人提供充分的咨询,告知住院分娩对保护母婴安全和实施预防HIV母婴传播措施的重要作用,帮助其及早确定分娩医院,尽早到医院待产。HIV感染不作为实施剖宫产的指征。对于孕早、中期已经开始ART、规律服用药物、无艾滋病临床症状,或孕晚期病毒载量<1000拷贝/mL,或已经临产的孕产妇,不建议施行剖宫产,避免紧急剖宫产[46]。当病毒载量>1000拷贝/mL或分娩时病毒载量未知时,建议在妊娠38周计划剖宫产,以尽量减少围产期HIV传播[21]。医疗保健机构应为HIV感染孕产妇提供安全的助产服务,尽量避免可能增加HIV母婴传播危险的会阴侧切、人工破膜、使用胎头吸引器或产钳助产、宫内胎儿头皮监测等损伤性操作,减少分娩过程中HIV传播的概率。 对于HIV感染孕产妇所生儿童,提倡人工喂养,避免母乳喂养,杜绝混合喂养。医务人员应与HIV感染孕产妇及其家人就人工喂养的接受性、知识和技能、负担的费用,是否能持续获得足量、营养和安全的代乳品,及时接受医务人员的综合指导和支持等条件进行评估。对于具备人工喂养条件者尽量提供人工喂养,并给予指导和支持;对于因不具备人工喂养条件而选择母乳喂养的感染产妇及其家人,要做好充分的咨询,指导其坚持正确的纯母乳喂养,且在整个哺乳期间必须坚持ART,喂养时间最好不超过6个月。同时,应为HIV感染孕产妇所生儿童提供常规保健、生长发育监测、感染状况监测、预防营养不良指导、免疫接种、艾滋病检测(包括抗体检测和早期核酸检测)等服务。 在出生后48 h内、6周及3个月提供HIV核酸检测以进行HIV感染早期诊断。HIV抗体检测在出生后12个月和18个月进行[46]。核酸检测阴性而18个月时抗体阳性的HIV暴露儿童需在出生后24个月再进行1次HIV抗体检测。为监测服用预防感染药物的安全性,出生后需进行血常规及肝功能检查作为基线评估的依据,之后监测的时间间隔取决于基线时肝功能和血常规的数值、孕龄、新生儿的临床状况、AZT或NVP的剂量,以及其他药物的使用情况。 对于男阴女阳家庭,在女方接受ART且病毒持续控制的情况下可选择排卵期自然受孕或体外授精。在男阳女阴家庭,也可在男方进行ART且病毒持续控制后,在排卵期进行自然受孕。目前认为这种情况下不会发生配偶间的HIV传播[45]。特定情况下,如HIV阳性的男方未达到病毒抑制而试图自然受孕时,HIV阴性的女方应在排卵期无套性交之前20 d至之后1个月连续服用TDF/FTC(或TDF+3TC)进行暴露预防。自然受孕情况下,HIV阴性一方无保护性交后必须进行HIV抗体检测,以排除HIV在配偶间传播。 HIV阳性一方接受ART且病毒达到持续抑制是HIV单阳家庭备孕的关键。另外,为提高受孕成功率,准确计算排卵期非常重要,可以寻求妇产科医师的帮助。 如果病毒载量检测受限或不可及的情况下,建议进行ART半年以上再进行受孕。这种情况下,建议寻求HIV领域专家指导,阴性一方需服用暴露预防药物。 PEP指尚未感染HIV的人群,在暴露于高感染风险后,如与HIV感染者或感染状态不明者发生明确的体液交换行为,尽早(不超过72 h)服用特定的抗HIV药物,是降低HIV感染风险的生物学方法。 HIV暴露分为职业暴露和非职业暴露。 HIV职业暴露是指卫生保健人员或人民警察或其他人员在职业工作中与HIV感染者的血液、组织或其他体液等接触而具有感染HIV的危险[50- 51]。 12.1.1 暴露途径及其危险度 发生职业暴露的途径包括暴露源损伤皮肤(刺伤或割伤等)和暴露源沾染不完整皮肤或黏膜。如暴露源为HIV感染者的血液,那么经皮肤损伤暴露感染HIV的危险性为0.3%,经黏膜暴露为0.09%,经不完整皮肤暴露的危险度尚不明确,一般认为<0.1%。 暴露源危险度分级:(1)低传染性:病毒载量水平低、暴露源接受ART并有持续病毒学成功;(2)高传染性:病毒载量高、AIDS晚期、未接受ART或不规律服药者;(3)暴露源情况不明,暴露源所处的病程阶段不明、暴露源是否为HIV感染,以及污染的器械或物品所带的病毒载量不明。 12.1.2 HIV职业暴露后的处理原则 (1)用肥皂液和流动的清水清洗被污染局部;(2)污染眼部等黏膜时,应用大量等渗氯化钠溶液反复对黏膜进行冲洗;(3)存在伤口时,应轻柔地由近心端向远心端挤压伤处,尽可能挤出损伤处的血液,再用肥皂液和流动的清水冲洗伤口;(4)用75%酒精或0.5%碘伏对伤口局部进行消毒。 12.1.3 HIV职业暴露后的预防性用药原则 (1)阻断方案。首选推荐方案为TDF/FTC+RAL(或DTG);也可考虑选择BIC/FTC/TAF。如INSTIs不可及,根据当地资源,可使用PIs(如LPV/r和DRV/c);对合并肾功能下降并排除有HBV感染的患者可使用AZT/3TC。国内研究显示,含ABT的PEP方案(ABT+DTG,或ABT+TDF+3TC)具有较高的治疗完成率和依从性,以及很好的安全性[52],但这方面尚需积累更多的研究证据。(2)开始治疗用药的时间及疗程。发生HIV暴露后,应尽可能在最短的时间内(尽可能在2 h内)进行预防性用药,最好在24 h内,但不超过72 h,连续服用28 d。 12.1.4 HIV职业暴露后的监测 发生HIV职业暴露后,应立即、4周、8周、12周和24周后检测HIV抗体。对合并HBV感染的暴露者,注意停药后对HBV相关指标进行监测。 12.1.5 预防职业暴露的措施 主要是规范操作,做好标准预防。 非职业暴露是指除职业暴露外其他个人行为发生的HIV暴露。暴露评估及处理原则,尤其是阻断用药与职业暴露相同。尤其注意评估后阻断用药是自愿的原则及规范随访,以尽早发现感染者。 (1)任何阻断均是在当事人自愿的前提下开展和实施,并签署知情同意书,强调规范随访。(2)关注阻断前的HBV感染状态、肝肾功能和血常规的基线检测。 PrEP是指当人面临HIV感染高风险时,通过服用药物以降低被感染概率的生物学预防方法[49]。 12.4.1 适合人群 MSM、与男女发生性关系的男性和不使用安全套的男性、变性人、性工作者、多性伴者、STI患者、共用针具或注射器或其他器具者。 12.4.2 用药原则 (1)每日服药[49]:每日服用TDF/FTC是对所有高风险人群推荐的口服PrEP方案,推荐每24 h口服1片TDF/FTC。如有计划停止或中断PrEP,需在最后1次风险暴露后持续使用TDF/FTC 7 d。(2)按需服药(2- 1- 1方案):仅推荐用于MSM,2- 1- 1方案在预期性行为发生前2~24 h口服2片TDF/FTC,在性行为后,距上次服药24 h服药1片,48 h再服药1片。 12.4.3 随访和监测 PrEP后1个月,应随访并进行HIV抗原和抗体检测,其后每3个月随访1次,并关注肾功能变化,建议每次随访进行HBV感染指标和梅毒血清学检测。每年检测1次HCV抗体。 12.4.4 注意事项 必须进行基线检查、规范随访和行为评估。 ART的出现和应用使艾滋病相关机会性感染和肿瘤大大减少,将艾滋病变为一种可以治疗但目前尚难以彻底治愈的慢性疾病,随着HIV/AIDS患者生存期的延长,各种非艾滋病定义性疾病(non-AIDS-defining diseases,NAD)如代谢综合征、心脑血管疾病、慢性肝肾骨骼疾病及非艾滋病定义性肿瘤的发病率呈上升趋势,这些疾病已经成为后ART时代影响HIV/AIDS患者生存质量和预后的主要原因[21- 22,53]。ART带来疾病谱的变化,也相应改变着HIV/AIDS患者的诊治与关怀模式。HIV感染的全程管理是指患者在确诊HIV感染后MDT团队为其提供的一种全程综合诊治和服务关怀管理模式。全程管理的关注环节主要包括:(1)HIV感染的预防和早期诊断;(2)机会性感染的诊治和预防;(3)个体化抗病毒治疗的启动和随访,服药依从性的教育和监督;(4)NAD的筛查与处理;(5)社会心理综合关怀。HIV感染的全程管理诊治模式是一种以感染科医师为主导的MDT诊治模式。 为高危人群提供预防HIV感染的咨询服务,包括安全性行为指导、PrEP和PEP的应用、HIV母婴传播阻断、为HIV/AIDS患者早期启动ART等。推荐早期检测,提供包括核酸检测在内的检测咨询服务。 见“常见机会性感染”部分。 无论HIV/AIDS患者CD4+T淋巴细胞计数水平的高低,均推荐尽早启动ART。临床实践中应根据患者的病情、有无合并感染和肿瘤、基础疾病状况、药物间相互作用、患者依从性、病毒载量、HIV耐药特点(尤其是当地人群中HIV耐药状况)、药物可及性、药物耐药屏障及不良反应(尤其是长期不良反应)等情况,综合考虑后制订ART方案。服药依从性是决定ART成功的最关键因素,任何情况下,均应先做好依从性教育再启动ART。在治疗的随访过程中,注意观察药物的长期不良反应,并根据情况调整ART方案或采取相应的处理措施。推荐按照个案管理模式对患者进行规范随访和管理。 近年来,人们提出了个体化抗病毒治疗概念。研究发现,有些药物并不适合某些患者人群,如EFV不适合病毒载量>5×105拷贝/mL的患者[54];研究表明,EFV每日600 mg剂量的情况下,22%的患者血药浓度仍不在治疗窗之内,这些患者出现ART失败或不良反应的风险升高[55];研究认为,中国艾滋病患者服用含EFV 400 mg的ART方案即可达到治疗效果,且可减少不良反应[56- 57]。WHO抗病毒指南已经把300 mg TDF+300 mg 3TC+400 mg EFV作为ART的选择方案之一[22]。近年来,越来越多降低抗病毒药物常用剂量的研究显示,降低剂量的ART方案在保留抗病毒疗效的同时降低了不良反应的发生率[58- 59]。个体化抗病毒治疗的常用实施方法是进行TDM,根据血药浓度调整药物剂量,尽管目前并不推荐临床实践常规进行TDM,但对于存在以下情况的患者,建议进行TDM[20]:存在明显药物之间相互作用的治疗方案;存在明显肝肾功能损害的患者;存在剂量相关性不良反应;药物剂量进行了调整的患者;依从性良好而ART疗效差的患者;ART风险高的孕妇。 对于ART后病毒得到有效抑制的患者,不建议随意进行治疗方案的调整,以下情况可考虑对ART方案进行优化[20]:(1)通过减少药片数量和给药频率,简化治疗方案;(2)改善耐受性,减少短期或长期的毒性;(3)预防或减轻药物相互作用;(4)在妊娠期或在可能发生妊娠的患者中,对ART进行优化;(5)降低治疗费用;(6)转换为长效注射制剂以减少服药负担等。优化治疗应以维持病毒抑制为基础,且不对未来的药物选择构成威胁。在进行ART方案优化时,应特别注意患者之前是否存在HIV耐药,以及有无合并HBV或HCV感染的情况;治疗方案调整后应注意监测病毒抑制情况。 通常同类抗病毒药物之间的转换是安全和有效的;多个研究支持将以NNRTIs或PIs为基础的治疗方案转换至以INSTIs(如DTG、RAL、BIC或EVG/c)为基础的方案时,可继续维持抗病毒疗效[20- 21]。对于部分患者,可根据病情采用简化的两药治疗方案。DTG+3TC的两药治疗方案在初治和经治患者中的疗效和安全性已得到证实,目前国际指南已将DTG+3TC这一两联ART方案列为艾滋病的优选抗病毒方案之一,但此方案不适合合并HBV感染的患者[20- 21]。目前,有一定研究数据或临床经验支持的含INSTIs和PIs的简化方案有[20]:(1)DTG+RPF;(2)DTG+3TC;(3)DRV/r+DTG;(4)PIs(ATV/r、LPV/r、DRV/r)+3TC;(5)ABT+LPV/r。ART方案优化时不可采用单药治疗。 ART的应用把艾滋病变成一种慢性病,应按照慢性管理模式进行随访和管理,随访中应注意评估和筛查NAD,并根据评估结果给予相应的预防或治疗措施。我国的一项研究显示未启动ART的艾滋病患者发生CVD的相关风险因素较多,10年内发生CVD的风险高,但对高脂血症的干预率低。年龄≥50岁、CD4+T淋巴细胞计数<200个/μL的患者发生CVD的风险相对更高。CVD风险因素的筛查与评估应作为未启动ART的HIV/AIDS患者的临床管理常规[60]。随访中也应特别注意评估患者的CVD风险并给予相应的预防措施。HIV患者中各种慢性疾病如高血压、糖尿病、血脂紊乱、冠状动脉粥样硬化性心脏病、脑血管疾病、非HIV相关肿瘤(尤其是肝癌、肺癌、乳腺癌、前列腺癌、结直肠癌等)、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、非酒精性脂肪肝、骨骼疾病等均需按照HIV阴性者一样建立慢性病管理档案,并按照相关指南进行筛查和预防处理[21- 22]。随着HIV感染者生存期的延长,需特别关注年龄对HIV/AIDS患者关怀的影响,应把对老年综合征的评估纳入HIV综合关怀之中[61]。应根据这些慢性疾病的特点和分级诊疗要求进行诊治,鼓励患者在综合医院相应专科门诊接受诊治。 为患者提供综合的关怀和服务:心理健康筛查;健康生活方式指导(如戒烟);STI的筛查与处理;生育指导;HIV相关的神经认知功能障碍(HIV-associated neurocognitive disorders,HAND)的筛查;旅行健康指导;舒缓医疗服务。以上均应按照相关指南或规范进行[21]。 应注意对HIV/AIDS患者进行疫苗接种指导。在HBV表面抗原(HBsAg)、表面抗体(抗-HBs)阴性的HIV感染人群,无论HBV核心抗体(抗-HBc)情况,需尽早接种乙肝疫苗。CD4+T淋巴细胞计数<200个/μL的人群疫苗接种成功率低于HIV阴性人群及CD4+T淋巴细胞更高的HIV感染者,但仍建议接种乙肝疫苗。HIV/AIDS患者感染SARS-CoV- 2后易出现重症而导致病死率升高[62],HIV/AIDS患者建议接种灭活新冠病毒疫苗,也可考虑接种重组亚单位疫苗[63]。 新冠肺炎疫情对HIV/AIDS患者的医疗服务产生不同程度的影响,应充分考虑疫情对HIV/AIDS患者相关服务的影响,努力创造条件,将其影响降至最低,确保医疗服务的可持续性。 作者贡献:指南更新框架由中华医学会感染病学分会艾滋病丙型肝炎学组和中国疾病预防控制中心发起;李太生教授牵头组织专家进行讨论,并审阅定稿;沈银忠、吕玮、何云、陈谐捷共同起草了更新版指南初稿;学组成员及参与编写的所有成员参与了讨论及指南修订工作。 利益冲突:所有作者均声明不存在利益冲突 指南撰写组成员(以姓氏笔画为序): 马萍(天津市第二人民医院感染二科),王敏(长沙市第一医院感染病中心),王辉(深圳市第三人民医院感染一科),王福祥(深圳市第三人民医院感染三科),石荔(西藏自治区人民医院感染病科),卢洪洲(深圳市第三人民医院),叶寒辉(福建医科大学孟超肝胆医院),白浪(四川大学华西医院感染科),吕玮(中国医学科学院北京协和医院感染内科),朱彪(浙江大学医学院附属第一医院感染科),刘水青(贵阳市公共卫生临床中心感染一科),刘燕芬(南宁市第四人民医院感染科),江建宁(广西医科大学第一附属医院感染病科),孙永涛(空军军医大学唐都医院感染科),孙丽君(首都医科大学附属北京佑安医院感染中心门诊),李太生(中国医学科学院北京协和医院感染内科),李凌华(广州医科大学附属市八医院感染病中心),李惠琴(云南省传染病医院感染科),吴昊(首都医科大学附属北京佑安医院感染性疾病临床研究中心),何云(深圳市第三人民医院感染一科),何艳(中南大学湘雅二医院感染科),何盛华(成都市公共卫生临床医疗中心感染一科),汪宁(中国疾病预防控制中心性病艾滋病预防中心),沈银忠[上海市(复旦大学附属)公共卫生临床中心感染与免疫科],宋玉霞(新疆医科大学第八附属医院感染科),张彤(首都医科大学附属北京佑安医院感染性疾病临床研究中心),张福杰(首都医科大学附属北京地坛医院感染中心),陈谐捷(广州医科大学附属市八医院感染病中心),陈雅红(福建医科大学孟超肝胆医院感染科),陈耀凯(重庆市公共卫生医疗救治中心感染科),林锋(海南省人民医院感染科),金聪(中国疾病预防控制中心性病艾滋病预防控制中心参比实验室),赵红心(首都医科大学附属北京地坛医院感染中心),赵清霞(河南省传染病医院感染科),徐小元(北京大学第一医院感染科),徐哲(解放军总医院第五医学中心生物损伤救治科),唐小平(广州医科大学),郭威(华中科技大学同济医学院附属同济医院感染科),粟斌(首都医科大学附属北京佑安医院感染性疾病临床研究中心),蒋卫民(复旦大学附属华山医院感染科),蒋岩(中国疾病预防控制中心性病艾滋病预防中心参比实验室),喻剑华(浙江大学医学院附属杭州市西溪医院),谢敬东(上海交通大学医学院附属瑞金医院感染科),蔡卫平(广州医科大学附属市八医院感染病中心),魏洪霞[南京中医药大学附属南京医院(南京市第二医院)感染科] 秘书:沈银忠,吕玮,何云,陈谐捷 顾问:高福,王福生8.5 抗病毒治疗监测
8.6 换药标准和治疗失败患者的抗病毒治疗[20- 22,35]
8.7 药物间相互作用
9 免疫重建炎症综合征
9.1 诊断
9.2 治疗[13]
9.3 发生的危险因素
10 艾滋病相关肿瘤[21,44]
11 HIV母婴垂直传播阻断及单阳家庭生育
11.1 抗反转录病毒药物干预
11.2 安全助产
11.3 产后喂养指导
11.4 HIV阳性孕妇所生儿童的随访
11.5 单阳家庭的生育选择
12 HIV暴露处理与预防阻断[22,47- 49]
12.1 职业暴露
12.2 非HIV职业暴露
12.3 注意事项
12.4 暴露前预防
13 HIV感染的全程管理
13.1 HIV感染的预防和早期诊断
13.2 机会性感染的诊治和预防
13.3 个体化抗病毒治疗的启动和随访
13.4 非艾滋病定义性疾病的筛查与处理
13.5 社会心理综合关怀
