多准则决策分析应用于罕见病药品临床综合评价的专家共识(2022)
2022-06-06北京协和医院罕见病多学科协作组中国罕见病联盟
北京协和医院罕见病多学科协作组,中国罕见病联盟
2019年,中国罕见病联盟组织编写了《罕见病药物卫生技术评估专家共识(2019版)》,明确应从安全性、有效性、经济性以及伦理和社会价值方面对罕见病药品进行临床综合评价,旨在为罕见病药品决策提供科学依据,保障临床药品合理使用,促进卫生资源合理配置[1]。2021年7月,国家卫生健康委员会发布《药品临床综合评价管理指南(2021年版 试行)》,重点明确了药品临床综合评价目的、规范流程、内容方法和质量控制等内容,明确技术评价与政策评价两条主线,提出药品临床综合评价应从安全性、有效性、经济性、创新性、适宜性、可及性等6个维度开展。传统卫生技术评估(health technology assessment, HTA)可为药品的临床综合评价提供方法学借鉴,但鉴于罕见病药品的特殊性,传统HTA在该类药品的临床综合评价中明显受限。近年来,越来越多的学者探索将多准则决策分析(multi-criteria decision analysis, MCDA)应用于罕见病药品的临床综合评价,以辅助国家卫生健康领域决策。目前该领域在国内尚处于起步阶段,为进一步引导并规范MCDA在罕见病药品临床综合评价中的应用,北京协和医院罕见病多学科协作组联合中国罕见病联盟,组织相关领域专家制订了本共识,旨在完善多主体参与、多维度分析需求的药品临床综合评价机制,促进药品决策的科学性、严谨性、透明性。
1 共识制订方法
本共识由北京协和医院罕见病多学科协作组和中国罕见病联盟共同发起。2021年5月召开共识制订启动会,组建指导委员会、共识组以及秘书组。指导委员会负责成立其他工作组、管理利益冲突、提出共识拟解决的关键问题、监督共识制订过程,并最终对共识全文进行审核。共识组负责对共识拟解决的关键问题进行讨论与审定、对推荐意见进行投票和共识、对共识全文进行定稿。秘书组负责协调其他工作组的工作,开展拟解决的关键问题的文献调研、检索、评价以及证据合成,组织推荐意见共识会议,并撰写共识初稿。
2021年11月,基于现有证据完成共识初稿;12月中上旬,通过线上德尔菲法进行专家意见咨询,根据投票结果和返回意见,对共识初稿修改后进行第2轮投票;12月23日,于北京举行了专家会议,对推荐意见进行逐条讨论、修改并最终完善;12月24日,共识组对推荐意见进行“背对背”无记名投票,达成共识,最终确定8个关键问题和8条推荐意见(表1)。经共识组和指导委员会审阅后完成共识终稿。投票等级分为:a非常同意;b同意;c不确定;d不同意;e非常不同意。除“不确定”以外的任一项票数超过50%,则视为达成共识;若同意/非常同意、不同意/非常不同意总票数超过70%,亦视为达成共识;其余情况均视为未达成共识,推荐意见进入下一轮投票。专家对推荐意见的一致程度用共识度表示,共识度为a+b或d+e所得票数占所有收回有效票数的百分比。
2 背景与现状
HTA主要以增量成本效果比(incremental cost-effectiveness ratio,ICER)作为决定性标准来评估药品的有效性、安全性和经济性[2]。罕见病药品的特殊性使得传统HTA评估面临困境,主要包括以下原因:(1)安全性和有效性方面:罕见病药品缺乏充足的临床数据和明确的标准疗法;(2)经济性方面:罕见病药品研发成本高,常缺乏可替代药品,其经济学评价难以用普通药品的经济基准来衡量;(3)伦理和社会因素需作为影响决策的因素纳入考虑[3]。

表 1 共识拟解决的关键问题以及推荐意见
罕见病药品医疗决策不应仅基于某个特定的量化标准,而需基于一组标准[4- 5]。MCDA以明确和透明的标准,从多角度探讨药品的价值,包括利益相关者的价值体系对每个价值成分的重要性(权重)和干预措施的实际效果(分数)进行判断,以支持卫生部门和临床决策,并利用简单或复杂的数学模型,将权重和分数相结合获得药品的价值估计,从而使决策过程变得更加清晰[6- 7]。在罕见病领域,MCDA可综合考虑多维度因素,引导不同利益相关者达成平衡和一致意见,为提高罕见病药品决策的公平性和严密性提供了潜在解决方案[8- 9]。2014年,国际药物经济学与结果研究学会(International Society for Pharmacoeconomics and Outcomes Research,ISPOR)成立工作组,为在医疗决策中使用适宜的MCDA提供了方法学建议[10- 11]。
近年来,包括保加利亚、波兰、英国、西班牙、法国、俄罗斯、荷兰、德国、意大利、美国在内的不同国家和机构对MCDA在罕见病药品临床综合评价中的应用进行了探索。由于评价机构和利益相关者不同以及受伦理社会学等因素的影响,不同国家对罕见病药品的决策机制存在相当大的差异,如德国对罕见病药品的临床证据要求较低,法国无需提供全面的成本效益分析,而其他一些国家可接受罕见病药品具有较高的成本效益阈值;这些差异导致不同国家对罕见病药品进行了不同的决策,罕见病患者获得治疗的机会并不平等[12]。为了适应罕见病和罕见病药品的具体特征,欧盟药品管理局(European Medicines Agency,EMA)和欧洲卫生技术评估网络(European Network for Health Technology Assessment,EUnetHTA)不断优化报销流程,形成了包括MCDA在内的多种罕见病药品评价方法:以西班牙为例,加泰罗尼亚卫生保健系统(Servei Català de la Salut, CatSalut)是地区卫生保健机构,负责确保公众获得有效的卫生服务。2015年,CatSalut将证据与价值对决策的影响(The Evidence and Value: Impact on Decision Making,EVIDEM)作为现行评价方法的补充,并列入了加泰罗尼亚卫生机构2016—2020年计划[7,13]。意大利伦巴第地区将MCDA评价结果纳入是否报销的依据,以EUnetHTA核心模型和EVIDEM框架为基础,开发了HTA-MCDA应用程序以指导决策过程。斯洛伐克和罗马尼亚增加了评价准则的权重,形成“类似MCDA”的方法,获得的MCDA评分用于改变ICER阈值[12,14- 15]。在英国,国家专业服务咨询小组(Advisory Group for National Specialised Services,AGNSS)是第一个使用MCDA对罕见病药品进行评价的HTA机构,评价准则涉及有效性、社会价值、成本和对治疗服务的影响等因素。目前,AGNSS与英国国家卫生与临床优化研究所(National Institute for Health and Care Excellence,NICE)合并,仍在基于MCDA进行罕见病药品评价[16]。此外,英格兰和威尔士卫生经济学办公室于2013年发布了《应用MCDA评估罕见病药品》参考文件[17],此后该作者基于此文件开展的罕见病药品评价是MCDA最早的实证研究之一[18]。已有研究探索了MCDA对波兰罕见病药品定价和报销过程的潜在影响,并对HTA和MCDA结果进行比较,肯定了MCDA在波兰罕见病药品定价报销中的作用[19]。一项来自葡萄牙的最新研究通过更新的MCDA框架评估了布罗舒单抗在儿童家族性低磷血症佝偻病中的社会、经济和治疗价值,并建议将MCDA作为葡萄牙传统卫生经济评估的替代或有力补充[12]。2014年俄罗斯将MCDA纳入《药品供应保障项目罕见病药品审批程序》[20]。
与欧洲各国相比,MCDA在亚洲的临床应用仍较为局限。2010年韩国将MCDA纳入《药品的显著性/危险性定量评估方法》目录,并相继于2013年、2014年和2017年的《食品药品安全处研究报告(摘要)》中将MCDA应用于心血管用药、骨关节系统用药和疫苗的定量评价[21],但目前尚未将MCDA应用于罕见病药品综合评价的相关政策与研究尝试。在我国,近年来越来越多的学者探索MCDA的评价方法,并应用于医疗保险报销、药品获益风险评价、药物治疗方案选择、罕见病药品遴选评价标准中,以期为药品相关决策的确立提供参考[22- 27]。
推荐意见1:罕见病药品常缺乏充足的临床数据和明确的标准治疗,临床价值及经济学评价难以用普通药品的标准衡量,其特殊性使得传统HTA面临困境。此外,伦理和社会因素应作为罕见病药品临床综合评价的决策因素。MCDA以明确的标准、透明的决策过程,从多角度探讨药品的综合价值,引导不同利益相关者之间达成平衡和一致意见,为解决罕见病药品临床综合评价难题、提高决策的严谨性和透明性提供了潜在解决方案。理论和实践均表明,MCDA适用于罕见病药品临床综合评价。(共识度:100%)
3 MCDA实施流程
2016年,ISPOR发布了MCDA实施的8个关键步骤[10- 11]:定义决策问题、选择和构建评价准则、测量绩效、评分、对评价准则赋予权重、计算总得分、处理不确定性、撰写报告和审查结果(表2)。在实际应用中,8个步骤可按照不同的先后顺序执行,也可重复执行。国内也有文献报道MCDA的操作步骤[25, 28- 30],均来源于ISPOR的方法学报告。
每一项操作步骤的验证方法:(1)将拟定的决策问题向决策者展示并予以确认。(2)将最终的评价准则清单和定义向决策者、利益相关者和专家展示并予以确认,逐条判断评价准则整体及每一项是否具备所要求的属性。(3)将绩效矩阵向决策者和专家展示并予以确认。(4)测试评分和权重的一致性:①确认利益相关者偏好原因:使研究者可以验证利益相关者是否理解所承担的任务、理解其反馈结果如何应用。②一致性检查:研究者可以将其对于利益相关者偏好的解释反馈给相应的利益相关者或反复确认利益相关者的偏好。(5)将MCDA评价结果向利益相关者展示并予以确认,重点关注在MCDA过程中为达到这些结果所进行的利弊权衡。验证的目的在于确保不同专业背景和社会背景的利益相关者在进行评分和赋予权重前,可充分理解每一个步骤的内容与意义,并真正做到实质性参与,以避免偏倚。
推荐意见2:推荐MCDA用于罕见病药品临床综合评价的实施流程按照定义决策问题、选择和构建评价准则、测量绩效、评分、对评价准则赋予权重、计算总得分、处理不确定性、撰写报告和审查结果8个关键步骤进行,并对每项操作步骤进行验证和报告。(共识度:100%)

表 2 MCDA实施的关键步骤
4 利益相关者成员组成
MCDA 作为在决策过程中整合不同观点的工具,利益相关者在确定MCDA框架、明确准则、赋予准则权重和评分以及作出决策等过程中均有不同程度的参与。利益相关者的选择需在确定决策目的和决策类型后进行。罕见病领域最常见的决策类型分为授权决策(如报销或审批决策)或者优先级决策(如在多种治疗方案中选择最优的治疗方案)。MCDA的研究结果很大程度取决于利益相关者的类型,这也是研究的主要局限性之一。
以“MCDA”“罕见病”“孤儿药”及其同义词检索PubMed、中国知网、万方数据库,检索时间为建库至2021年8月15日,共获得30篇英文文献和64篇中文文献。其中4篇文献为系统评价,手动检索系统评价纳入的原始文献,并去除重复文献或不相关文献,最终纳入29篇符合本共识主题的文献用于形成推荐依据,包括4篇系统评价文献(表3),25篇非系统评价文献(表4)。
25篇罕见病MCDA非系统评价文献中,其中15篇应用MCDA指导罕见病药品决策,7篇与优先级决策相关,4篇与授权(报销)决策相关,4篇未明确决策类型;另有5篇评估了准则偏好。19篇明确提出利益相关者的构成和/或成员数量。在作出优先级决策或未明确决策类型时,选择的利益相关者类型常见为医生(9篇,专科/全科医生)、决策者(9篇,医疗机构/区域/国家)、患者代表(6篇,来自患者组织),此外还包括卫生经济学家(4篇)、药师(3篇)、企业代表(2篇)、公众代表(1篇)等。在作出授权(报销)决策时,常见的利益相关者类型为决策者(3篇)、卫生经济学家(3篇)、医生(2篇)和患者代表(2篇),此外还包括企业代表和药师(各1篇)。无论是授权决策还是优先级决策,医生、决策者、患者均会被优先考虑作为利益相关者。相较于对非罕见疾病的治疗方案评估,罕见病的疾病性质决定了患者参与其中更为重要。同理,工作性质决定了卫生经济学家在授权决策中更适合被选择作为利益相关者。
除利益相关者类型外,参与者数量和每个利益相关者群体的比例亦可影响MCDA决策结果。涉及利益相关者组成和/或数量的19篇文献中,17篇具体指出利益相关者的总体数量(5~143人,中位数为19人);12篇具体指出利益相关者的数量和比例,其中9篇明确了医生的占比(6.3%~100.0%,中位数为27.3%)和数量(1~8人,中位数为5人),分别为1/16、2/10、5/5、5/9、5/19、6/11、6/28、6/18、8/24(医生人数/利益相关者总人数);8篇文献明确了决策者的占比(6.3%~33.3%,中位数为20.7%)和数量(1~8人,中位数为4人),分别为1/9、1/11、1/16、2/10、5/19、6/28、6/18、8/24(决策者人数/利益相关者总人数);7篇文献明确了患者代表的占比(5.6%~27.4%,中位数为14.3%)和数量(1~9人,中位数为2人),分别为1/18、1/16、2/9、2/10、3/24、4/28、9/19(患者人数/利益相关者总人数);4篇文献明确了药师的占比(17.8%~36.4%,中位数为22.9%)和数量(2~5人,中位数为4人),分别为2/10、4/11、5/18、5/28(药师人数/利益相关者总人数);4篇文献明确了卫生经济学家的占比(11.1%~25%,中位数为20.4%)和数量(1~7人,中位数为4人),分别为1/9、2/10、5/24、7/28(卫生经济学家人数/利益相关者总人数)。确保足够多的参与者和各方群体间的比例均衡可使评估结果更具有代表性,而对各方利益相关者的观点和思考进行综合考虑,有助于增加研究结果的信度。
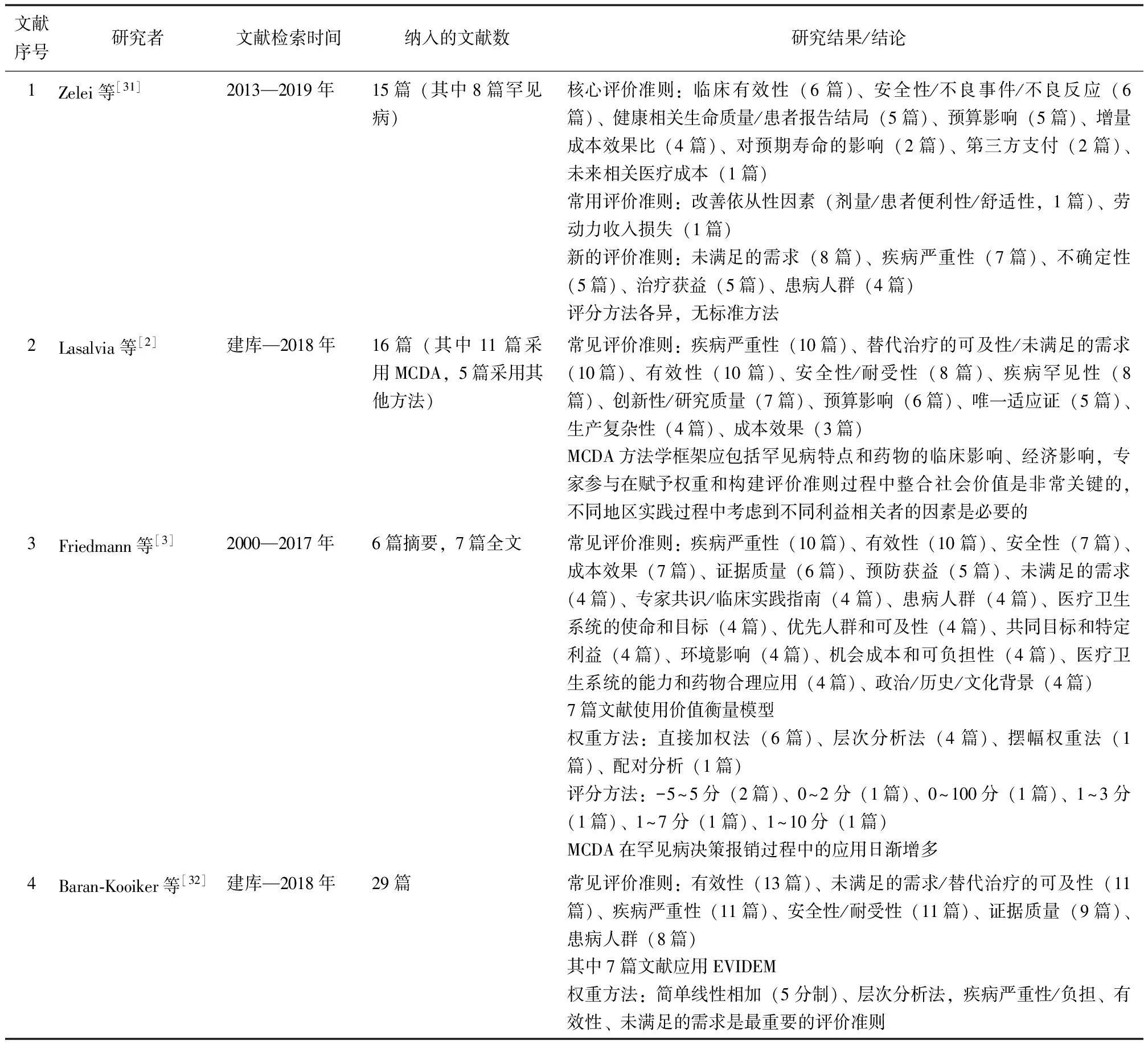
表 3 MCDA应用于罕见病药品的系统评价文献特征

表 4 MCDA应用于罕见病药品的非系统评价文献特征

表 4 MCDA应用于罕见病药品的非系统评价文献特征

表 4 MCDA应用于罕见病药品的非系统评价文献特征

表 4 MCDA应用于罕见病药品的非系统评价文献特征

表 4 MCDA应用于罕见病药品的非系统评价文献特征

表 4 MCDA应用于罕见病药品的非系统评价文献特征

表 4 MCDA应用于罕见病药品的非系统评价文献特征
根据MCDA决策目的,可考虑纳入不同的利益相关者:当应用于国家医保报销决策时,可重点纳入政府部门决策者、医生、药师、卫生经济学与卫生政策专家、患者代表(患者/患者家属)、公众代表;当应用于医疗机构制定遴选药品目录时,可重点纳入医疗机构药品决策者(包括医疗机构管理者、药事管理与药物治疗学委员会专家)、医生、药师;当应用于治疗方案遴选时,可重点纳入医生、药师、卫生经济学家、患者代表(患者/患者家属)。
推荐意见3:根据罕见病MCDA决策目的确定不同利益相关者的构成比例和数量。其中,利益相关者应重点纳入决策者(政府部门/医疗机构)、医生、药师、卫生经济学与卫生政策专家、患者代表(患者/患者家属)、公众代表,此外还可考虑纳入伦理学专家、企业代表。(共识度:100%)
5 评价准则的确定
在纳入的4篇系统评价文献中,有效性、未满足的需求/替代治疗的可及性、疾病严重性、安全性/耐受性、证据质量是报道最多的评价准则(表3)。在纳入的25篇非系统评价文献中,9篇直接引用EVIDEM框架;余16篇文献中评价准则出现次数较多的为疾病严重性(11篇)、安全性/耐受性(11篇)、未满足的需求/替代治疗的可及性(11篇)、有效性(10篇)、经济性(10篇),详见表4。评价准则的构建需满足全面性、非重复、不交叉、独立性的原则。根据检索的循证医学证据,推荐应用EVIDEM框架,其整合了标准化权重和药品在各准则的分值。核心模型的评价准则用于定量评价,情境化准则用于定性评价药品在某方面的价值,具体推荐意见表5和表6。根据评价对象和决策目的,可针对性选择其中的评价准则构建不同的情景,也可将情境化准则调至核心模型准则中进行定量评价。
推荐意见4:推荐应用EVIDEM的基础框架进行罕见病药品临床综合评价,准则设计分为核心模型准则和情境化准则,核心模型准则包括6个一级准则、15个二级准则;情境化准则包括2个一级准则、6个二级准则,详见表5和表6。(共识度:100%)
6 权重及评分方法
MCDA有3种常用的建模方法,分别为价值测量法、优序法和参考模型法,其中价值测量法是目前MCDA在罕见病药品评价中使用最广泛的方法,也是MCDA在HTA领域被多数研究者推荐的方法。其原理是将评价药品的综合绩效分数作为总体价值,用各准则的权重和分数的乘积之和表示,以此来排序。优序法的原理是通过方案间两两比较,逐步判断,最终得到全部方案的排序。参考模型法的原理是预先确定各准则的标准水平,然后找到与这些标准水平最接近的理想方案。
选择适宜的加权和评分技术是MCDA操作过程中的关键和挑战,多种数学和统计方法可用于加权和评分,包括直接评分和简单线性相加法、层次分析法、Keeney-Raiffa MCDA法(摆幅权重法和偏价值函数)和离散选择实验。在罕见病MCDA纳入的25篇非系统评价文献中,20篇文献明确其加权和评分方法,其中最常使用的权重方法为简单线性相加法(8篇)和层次分析法(5篇),其主要优势是实施过程简单,参与者能更好地理解决策过程;少量研究采用Keeney-Raiffa MCDA法(1篇),该方法将摆幅权重和偏价值函数相结合,在作优先级决策时更为精细,对研究者的认知亦有更高要求;1篇文献采用了离散选择实验,其基于适应性联合分析,需参与者在数百个权衡决策中进行衡量,从而生成用于回归建模的数据,以确定参与者对准则内和准则间变化的偏好。此外,5篇文献采用了多种加权方法,并对不同加权方法进行比较,其中仅1篇摘要报道了不同加权方法结果之间存在显著差异。共12篇文献明确了评分方法,主要为5分制(6篇,定性准则:0~5分,定量准则:-5~5分)、百分制(0~100分,3篇)、3分制(1~3分,2篇)、7分制(1~7分,1篇),详见表4。

表 5 MCDA用于罕见病药品临床综合评价的核心模型准则

表 6 MCDA用于罕见病药品临床综合评价的情境化准则
考虑到罕见病领域最常见的决策类型为授权决策(如医保报销)或者优先级决策(如治疗药物选择),MCDA评价结果的有效性至关重要。应用不同的加权和评分方法进行比较分析,能更好地满足利益相关者对准则的优先级和偏好的选择。
替代药物的可及性会影响利益相关者对于评价准则的评分,当唯一的替代药物不可及时,利益相关者对于“未满足的需求”“药物相对有效性”“患者报告的结局”准则的评分更高[41]。因此,应根据实际情况,设置不同的情景对评价药品分别评分并进行对比研究。
综上所述,应用MCDA对罕见病药品进行决策时,研究者最常使用EVIDIM框架,进行直接评分,并采用简单线性相加法或层次分析法的权重处理方法。MCDA模型方法的简化可能会增加接受度,应用EVIDEM框架可为加强MCDA研究过程的可比性迈出第一步。应用MCDA进行罕见病药品决策时,采用不同的加权和评分方法的组合方式,可能更有利于研究结果的解读。
推荐意见5:
(1)MCDA用于罕见病药品临床综合评价研究可采用价值测量法、优序法和参考模型法,常用的价值测量法通过准则的权重和评分的乘积之和决定药物的总体价值。(共识度:100%)
(2)MCDA用于罕见病药品临床综合评价研究通常采用基于EVIDEM框架的加权和评分方法,常用的加权方法包括简单线性相加法和层次分析法,常用的评分方法核心模型中定性准则在0~5分范围,定量准则在-5~5分范围,情境化准则为-1、0、1分。(共识度:95%)
7 研究结果的解读
当前对MCDA总体分值的解释具有挑战性。多项研究应用MCDA比较了不同药物应用于同种疾病的价值,结果显示总体分值更高的药物被推荐应用于疾病的治疗或医保报销目录[8, 12, 36, 39- 40, 50]。另有研究将总体分值与成本数据相结合,分析MCDA总体分值与费用的相关性[8, 49]。
Iskrov等[45]探究将MCDA总体分值结果用于报销决策中,将70分(相当于70%)认定为推荐的界值,利益相关方达成共识,以总体分值≥70分为公共资金无条件报销,≥50分为有条件报销,<50分为不报销。在这种情况下,应推荐总体分值在50至70分之间的卫生技术进行有条件补偿。对于总体分值低于50分的卫生技术,参与者认为这也并不意味着自动拒绝。有研究将MCDA评价结果与HTA结果进行比较,如果评价对象的分值超过总分的50%即可将MCDA结果认定为阳性[19]。此外,对于评价准则的评分和不同情境下权重的差异,也可产生有意义的解释结果。
MCDA评价结果是不同利益相关者之间相互竞争博弈最终取得利益平衡和一致的过程。因此,根据研究目的的不同,利益相关者商议进行边界值的确定。
推荐意见6:对MCDA评估结果可以进行不同方式的解读。根据不同的决策目的,采取不同的MCDA研究方法,可对待评价药品进行价值衡量,也可对待评价药品进行价值排序并作出优先选择。采用MCDA模型衡量不同背景的利益相关者的价值偏好,探索不同情景下的决策结果。最终的研究结果为政府部门或医疗机构制订罕见病药品相关决策提供参考。(共识度:95%)
8 评价结果的稳健性
MCDA评价结果具有异质性,其不确定性来源于每一项操作步骤,主要包括:(1)MCDA模型设定和参数输入的不确定性,包括准则设定、绩效测量、评分和权重的参数;(2)模型参数的确定性,如对接受同一药物治疗不同亚组患者的绩效测量不一致,或对评分和权重的认知存在差异;(3)结构的不确定性,如权重评价方法或问题构建决策树、加和方法等;(4)证据判断的不确定性,如依赖专家的意见来测量绩效;(5)随机不确定性,由随机、无法解释的变化所引起。
证据判断的不确定性可以采用评分范围进行分析;权重的不确定性可以通过不同的权重分配方法进行测量;由于个体视角(权重)和判断(分数)的可变性而产生的不确定性可以通过统计离散度的标准度量进行评估;由于模型结构而产生的不确定性可以通过修改模型结构进行控制,如去掉最低权重的评价准则;重现性的检验可通过重复评估操作实现。
不确定性因素对于MCDA评估结果的影响可通过多种方法实现考量:(1)将不确定性分析作为一个评价准则,但随之带来的挑战是MCDA涉及的所有因素都将受到不确定性的影响,而用统一的分数对所有不确定性进行衡量难以实现,因为MCDA本身就需要对各项准则不同来源的相对价值进行评估,这可能导致利益相关者对不确定性的确切来源感到模糊。(2)进行不确定性分析。当利益相关者对风险持中立态度时,应用不确定性分析可探索MCDA评估结果随不确定性变化的趋势,如确定性敏感分析或概率敏感性分析可用于探索参数不精确性和变异性的影响。确定性敏感分析通过一次改变一个参数(准则权重或绩效分数)可观察该参数改变对评价药品等级顺序的影响。概率敏感性分析是用概率分布描述模型参数的不确定性,通过模特卡罗模拟方法进行评估。建议所有MCDA研究均应进行确定性敏感分析,是否同时进行概率敏感性分析取决于是否需要同时考虑多个参数的不确定性,以及参数之间是否存在相关性。(3)情景分析。设置不同的情景,以讨论不同不确定性因素对MCDA评估结果的影响。(4)不同的操作步骤选取不同的利益相关者。也可在评价准则、权重与评分测定过程中设置多轮投票,或经充分讨论后再次投票,以尽可能减少偏差。
推荐意见7:
(1)对每一步操作过程进行充分验证。
(2)利益相关者应具有代表性。向不同背景的利益相关者提供技术信息培训,确保其透彻理解和实质性参与。
(3)证据质量可靠。证据来源于目前可获得的最佳临床证据,研究结果科学、真实可靠。
(4)推荐对每一操作步骤进行不确定性分析。
(共识度:100%)
9 规范性报告清单
为了给医疗保健决策中的MCDA建立统一的定义和标准,2014年ISPOR成立了MCDA规范指导工作组。工作组提供了关于MCDA规范性报告的建议,包括支持MCDA的设计、实施和审查的标准化清单、支持执行清单的指导意见[10-11]。表7汇总了MCDA规范性报告的条目清单,有利于MCDA研究的报告向着科学性和标准化方向发展。需注意的是,该清单仅提供MCDA研究报告中的关键问题,以及每个步骤相应的报告要点,并不限制特定方法的应用。
推荐意见8:MCDA规范性报告清单详见表7。(共识度:100%)
10 MCDA证据转化为决策的应用经验
MCDA对改善医疗决策的影响体现在药品的定价和报销决策,优先级决策和审批决策等方面:(1)药品的定价和报销决策。Iskrov等[45]探究了MCDA模型在评估罕见病药品价值中的作用,证实MCDA评估结果在制订报销决策中具有合理性。一项西班牙的研究[33]应用MCDA评估了影响罕见病药品报销决策的重点因素,分析对患者健康相关生命质量的影响、疗效的获益程度和替代治疗的可及性对报销决策的影响较大,罕见病的严重程度以及疾病的治愈率也会对报销决策产生影响。Kolasa等[19]比较了HTA和MCDA对于罕见病药品定价和报销的影响,发现MCDA

表 7 MCDA规范性报告清单
有助于发现罕见病药品伦理和社会等方面的价值,从而增加纳入医保报销的概率。MCDA证据的强度是罕见病药品评估的关键标准。证据不仅可支持药品报销决策,还可为孤儿药政策的推行提供合法性依据。(2)优先级决策。MCDA可用于评价风险效益,优化治疗方案[52]。有研究者对非瓣膜性房颤的替代治疗方案进行了评估,以指导临床处方决策和临床指南编写[53]。在印度尼西亚,通过MCDA评估将多个利益相关方的偏好纳入艾滋病治疗的优先顺序设定过程[54]。(3)审批决策。MCDA可以作为新药准入审批决策的工具。Simoens[55]通过MCDA评估,提出罕见病药品市场准入决策中优先考虑的3个准则,即疾病患病率、是否有可替代治疗和老药新用。
11 小结
MCDA通过整合多维度的准则,考虑多方利益相关者的偏好,使得决策过程更加一致、透明和公平。但实施过程尚存在一些挑战和局限性,包括适用的具体决策情境、利益相关者样本的代表性、不同利益相关者在确定权重和评分时存在主观偏差、评估结果能否直接决定最终决策等。为更好地促进罕见病药品评估和应用,本共识对MCDA应用的方法学进行探索,旨在建立以循证医学为基础、公开公正、多维度分析、平衡各方利益相关者的罕见病药品临床综合评价机制,为决策者提供科学证据。
作者贡献:本专家共识由北京协和医院罕见病多学科协作组和中国罕见病联盟共同发起,张抒扬组织建立了指导委员会、共识组和秘书组,并任命张波全权负责共识的制订工作;屈静晗、刘鑫、尚俊美、乔露瑶共同起草了共识初稿,在张抒扬、张波的组织协调下联合其他专家对共识进行讨论、凝练推荐意见;陈丽萌、陈耀龙、崔丽英、戴毅、何江江、胡善联、胡欣、李大魁、李国辉、李林康、刘鑫、梅丹、潘慧、邱正庆、史录文、田庄、王晓玲、吴晶、辛育航、宣建伟、杨志敏、张波、张锋、张抒扬、张文宝、赵琨、郑佳音共同参与了推荐意见的商讨与修订工作;张抒扬、张波对共识全文进行了最终审校,所有参与者均对共识终稿表示认同。
利益冲突:所有参与本共识制订的人员均声明不存在利益冲突
指导委员会(按姓氏首字母排序):
胡善联(复旦大学公共卫生学院),张波(中国医学科学院北京协和医院药剂科),张锋(国家卫生健康委员会药物政策与基本药物制度司),张抒扬(中国医学科学院北京协和医院心内科/疑难重症及罕见病国家重点实验室),张文宝(国家卫生健康委员会医政医管局医疗管理处)
共识组(按姓氏首字母排序):
陈丽萌(中国医学科学院北京协和医院肾内科),陈耀龙(兰州大学循证医学中心),崔丽英(中国医学科学院北京协和医院神经科),戴毅(中国医学科学院北京协和医院神经科),何江江(上海市卫生和健康发展研究中心),胡欣(北京医院药学部),李大魁(中国医学科学院北京协和医院药剂科),李国辉(中国医学科学院肿瘤医院药剂科),李林康(中国罕见病联盟),梅丹(中国医学科学院北京协和医院药剂科),潘慧(中国医学科学院北京协和医院医务处/内分泌科),邱正庆(中国医学科学院北京协和医院儿科),史录文(北京大学药学院),田庄(中国医学科学院北京协和医院心内科),王晓玲(首都医科大学附属儿童医院药学部)、吴晶(天津大学药学院),辛育航(中国罕见病联盟),宣建伟(中山大学药学院医药经济研究所),杨志敏(国家药品监督管理局药品审评中心),赵琨(国家卫生健康委员会卫生发展研究中心),郑佳音(中国罕见病联盟)
秘书组:
屈静晗(中国医学科学院北京协和医院药剂科),刘鑫(中国医学科学院北京协和医院药剂科),尚俊美(中国医学科学院北京协和医院药剂科/中国医学科学院北京协和医学院药物研究所),乔露瑶(中国医学科学院北京协和医院药剂科/中国医学科学院北京协和医学院药物研究所),许婷婷(中国医学科学院北京协和医院药剂科),田欣(中国医学科学院北京协和医院药剂科),安鹏姣(中国医学科学院北京协和医院药剂科),于佳鑫(中国医学科学院北京协和医院药剂科)
执笔人:屈静晗,刘鑫,尚俊美,乔露瑶
