原发性肺黏液腺癌 18F-FDG PET/CT与增强CT影像特征分析
2022-06-06韩萍萍富丽萍冯宏响史艳芬郑玉民
韩萍萍,富丽萍,张 凌,冯宏响,史艳芬,郑玉民
中日友好医院 1核医学科 2放射诊断科 3胸外科 4病理科,北京 100029
原发性肺黏液腺癌(primary pulmonary mucinous adenocarcinoma,PPMA)是肺腺癌的一种特殊亚型,发病率较低[1],病情较隐匿,患者可无明显临床表现或临床表现异质性较强,极易被误诊为肺炎、肺结核或其他肺部疾病,以致治疗延迟。MRI检查对肺黏液腺癌的诊断有高特异度和灵敏度[2],但因其空间分辨率有限,且检查时间长、费用高,一般不作为PPMA常规检查。增强CT可观察病灶形态、密度以及增强放射情况等特征性表现;18F-脱氧葡萄糖(fluorodeoxyglucose, FDG) 正电子发射断层显像/计算机体层成像(positron emission tomography/computed tomography, PET/CT)可显示病灶的代谢活性,并帮助排除胃肠道黏液腺癌转移,以及了解全身情况,有助于疾病分期。目前,PPMA影像学特征相关研究多为病例报道,缺乏大样本研究。本研究对PPMA患者的18F-FDG PET/CT和增强CT影像学特征进行总结,旨在为该病的诊断提供更多影像学信息。
1 资料与方法
1.1 研究对象
本研究为回顾性分析。研究对象为2015年7月至2018年2月中日友好医院经手术或穿刺病理证实的全部PPMA患者。排除标准:(1)18F-FDG PET/CT或增强CT影像资料质量不合格者;(2)合并肺部其他疾病,如结核、肺炎等。
本研究已通过中日友好医院伦理审查委员会审批。
1.2 研究方法
1.2.118F-FDG PET/CT显像
接受18F-FDG PET/CT显像检查前需禁食4~6 h,血糖控制在11.1 mmol/L以下。先行螺旋CT扫描(美国GE公司Discovery PET/CT Elite扫描仪)。扫描范围:颅底至股骨中段,扫描参数:管电压为120 kV,管电流(采用自动毫安技术)为60~180 mA,噪声指数为25,矩阵为512×512,重建层厚为3.75 mm。患者于安静、避光状态下平卧1 h后行全身PET/CT显像。静脉注射18F-FDG 3.70~5.55 MBq/kg(放化纯度>95%,原子高科股份有限公司产品)。扫描参数:床位宽度15.7 cm,2.5 min/床位,共采集6~8个床位,矩阵为192×192,自动进行图像重建,横断位重建层厚为3.27 mm。于病灶放射性摄取最浓聚处勾画感兴趣区,计算最大标准摄取值(maximum standardized uptake value, SUVmax)。
1.2.2 CT检查
采用荷兰Philips公司256层螺旋CT(iCT)扫描仪进行胸部扫描。扫描范围:从肺尖至肺底,首先进行平扫,扫描参数:管电压为120 kV,管电流为200~300 mA,矩阵为512×512,重建层厚为5.0 mm。平扫结束后,使用高压注射器静脉注射对比剂优维显(德国Bayar Schering Pharma AG公司产品)80~100 mL,注射速率3.0 mL/s,扫描结束后自动进行横断位重建。
1.3 质量控制
为减少偏倚,由两名具有丰富经验的核医学科医师在不知病理结果的情况下进行独立读片,意见不同时经协商讨论取得最终意见,以保证诊断结果的稳健性。
1.4 统计学处理
采用SPSS 19.0软件进行统计学分析。SUVmax符合正态分布,以均数±标准差表示,组间比较采用独立样本t检验;计数资料的比较采用Fisher精确概率法;采用Spearman相关法分析SUVmax与病灶密度的相关性。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共入选25例符合纳入和排除标准的PPMA患者。其中男性15例,女性10例;平均年龄(60.68±12.98)岁;经肺叶或肺段楔切病理证实13例,经CT引导下肺穿刺活检证实8例,经支气管镜活检证实3例,经超声引导下肺穿刺活检证实1例。临床表现:咳嗽16例,其中咳白色泡沫样痰1例,咳嗽、痰中带血丝8例;发热2例;因胸痛、呼吸困难及厌食消瘦各1例;余4例无明显症状,为体检发现。
2.2 18F-FDG PET/CT图像特征
25例患者均行18F-FDG PET/CT检查。根据PET/CT图像病灶分布特点分为孤立性PPMA 7例和弥漫性多发PPMA 18例。
2.2.1 孤立性PPMA
形态学表现为肺部孤立性病灶,边缘可见分叶征与棘突,包括结节(病灶直径<3 cm)3例和团块(病灶直径≥3 cm)4例(图1A)。团块密度均呈不均匀分布,其中1例病灶内见空洞、3例见囊性密度区(囊性密度区偏于病灶一侧)。18F-FDG摄取特征:3例低摄取,4例高摄取;实性成分摄取18F-FDG不均匀,空洞或囊性密度区呈18F-FDG低摄取或无摄取。1例SUVmax为2.0,余病灶SUVmax均大于3.5,平均SUVmax为5.09±3.78。
2.2.2 弥漫性多发PPMA
形态学表现为双肺多发病灶,分布、大小、形态不一,包括多发结节或团块5例,实变影5例,结节、团块、空洞、磨玻璃密度影、斑片影及实变影等多种形态占位混合存在8例。6例可见明确原发灶(“母瘤”)伴肺内转移,“母瘤”为肺内明确存在体积最大且有明确的恶性征象,包括分叶征、毛刺征以及周围磨玻璃影,与其他病变有明确不同的病灶(图1B);余12例考虑为多中心病变,未见“母瘤”(图1C)。11例具有实变影(5例表现为实变影,6例与其他形态占位混合存在),为弥漫性多发PPMA最典型的形态学表现,实变灶密度极不均匀,其内均含囊性密度区(图2A),CT值为-71~79 Hu(平均15 Hu);其中6例可见肺叶膨隆征(图2B),4例可见病理性支气管充气征(图2C),3例可见血管造影征(图2D),7例可见实变影周围磨玻璃密度影。弥漫性多发PPMA18F-FDG摄取特征:摄取程度不一,SUVmax为0.5~18.0(7.97±5.08),其中3例SUVmax<3.5,15例SUVmax>3.5。具有实变影的患者中,18F-FDG摄取程度与病灶密度(CT值)呈正相关(r=0.422,P=0.031):CT值<20 Hu的囊性成分中,平均SUVmax为2.7;CT值>20 Hu的实性成分中,平均SUVmax为7.8(图1D、1E)。
6例弥漫性多发PPMA存在远处转移,转移范围累及胸膜、骨、双侧肾上腺、纵隔和肺门淋巴结。转移灶大部分表现为18F-FDG高摄取(SUVmax范围:1.7~23.2)。
孤立性PPMA与弥漫性多发PPMA的SUVmax无显著性差异(P=0.142)。以SUVmax=3.5为界值,将18F-FDG摄取程度转化为二分类变量,Fisher精确概率法检验示,孤立性PPMA和弥漫性多发PPMA的SUVmax亦无显著差异(P=0.296)。

图 1 原发性肺黏液腺癌患者18F-FDG PET/CT显像特征

图 2 原发性肺黏液腺癌患者实变影PET/CT显像特征(箭头)
2.3 增强CT图像特征
6例行增强CT扫描,其中4例呈不均匀强化,2例无强化(表1)。以结节/团块、空洞为主的病灶SUVmax值与CT强化程度(ΔHu)无明显线性相关(由于病例较少未进行Spearman相关性分析):1例单发结节对18F-FDG摄取轻度增高,SUVmax为1.5,ΔHu为73(图3A);1例多发空洞及结节对18F-FDG摄取不均匀增高,SUVmax为7.2~16.6不等,但增强CT扫描无明显强化(图3B)。以实变影为主要表现的病灶中,SUVmax与CT强化程度呈正相关:病灶中18F-FDG摄取高的部分呈明显强化,低摄取或无摄取部分无强化(图3C)。
3 讨论
影像学有助于PPMA的诊断、辅助分期以及预后评估。由于PPMA相对罕见,目前其影像学特征尚缺乏系统总结。本研究对25例PPMA患者的增强CT和18F-FDG PET/CT特征进行了总结,发现CT示病灶呈孤立性或弥漫性存在,增强扫描后示强化程度与病灶密度相关。18F-FDG PET/CT示对18F-FDG摄取程度不一,其中实变影为弥漫性多发PPMA最典型的形态学表现,其内CT征象有助于与肺部感染性疾病进行鉴别诊断。
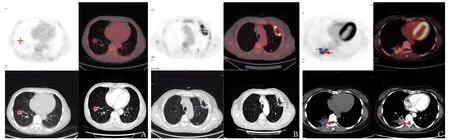
图 3 原发性肺黏液腺癌患者增强CT与18F-FDG PET/CT显像

表 1 原发性肺黏液腺癌患者18F-FDG PET/CT 和增强CT图像特征(n=6)
根据2011年世界卫生组织发布的肺腺癌分类标准,肺腺癌分为黏液性原位腺癌、微浸润性黏液腺癌和浸润性黏液腺癌[1]。PPMA是肺腺癌的一种特殊类型,仅占肺腺癌的0.14%~0.25%,其临床表现包括刺激性咳嗽、咳痰、胸闷、气短等,但缺乏特异性,晚期经典表现为咳大量白色泡沫样痰,通常被认为是PPMA特征性临床表现,但临床较少见。本研究25例PPMA患者中,仅1例具有咳白色泡沫样痰的经典表现,20例表现为咳嗽、咳痰、发热、胸痛、消瘦等非特异症状,4例无明显症状,为体检发现,提示PPMA症状较隐匿,加强早期筛查具有重要意义。
3.1 PPMA的18F-FDG PET/CT显像特征
影像学可为PPMA的诊断提供重要的辅助信息。目前PPMA影像学表现的大宗病例研究较少见,18F-FDG PET/CT显像可同时提供形态学以及代谢信息,有助于疾病的辅助分期,但目前缺乏大样本研究[3- 5]。PPMA的PET/CT特征具有多样化,可表现为孤立性病灶(单发结节或团块)和弥漫多发病灶(多灶性或肺炎型)。Rossi等[6]总结了18例黏液型腺癌的影像学资料,认为其最常见的表现为肺野周围边界不清的实性结节(8例),其他表现包括伴支气管充气征(6例)或呈磨玻璃密度影的实变影(4例)。对本研究25例PPMA患者的18F-FDG PET/CT显像特点总结后发现,弥漫性多发PPMA更多见(72%),且形态学表现多样,呈现为结节、团块、磨玻璃密度影、斑片影及实变影等多种形态占位,其分布、大小、形态不一;多发与单发PPMA的SUVmax并无统计学差异。既往认为,多发病灶是病变经气管或淋巴管肺内播散的结果,但目前多数学者支持多克隆假说,即多发病灶并非皆为肺内转移,也可能是多克隆起源、独立生长[7]。本研究18例弥漫性多发PPMA中,6例(33.3%)可见明确原发灶伴肺内转移(图1B);余12例未见明确的“母瘤”,且病灶对18F-FDG摄取程度不一(图1C),提示肺内播散与多克隆假说可能同时存在。
由于癌细胞分泌大量黏液,细胞核被挤压至一侧、呈新月形,肺泡腔内可见大量黏液,癌细胞产生的细胞外黏液在细胞外形成大小不一的“黏液湖”[8],PET/CT表现为密度低于肌肉组织的实变影[9]。实变影是弥漫性多发PPMA最典型的特征,该类型PPMA是唯一影像学表现为非支气管阻塞性的实变性肺癌[10],其表现与大叶性肺炎、干酪性肺炎等肺部感染性病变的实变影相似,常被误诊。PPMA的实变影具有以下独特特征,有助于PPMA与肺炎等肺部感染性疾病的鉴别诊断:(1)肺叶膨隆征:肿瘤细胞产生的黏液可引起肺叶膨胀,以致叶间裂向外膨隆(图2B)。(2)病理性支气管充气征:表现为叶段性实变内走行僵硬、分支少、呈“枯树枝”状的充气支气管(图2C)。其病理基础是肿瘤细胞沿支气管壁伏壁生长及肺泡腔内黏液挤压。(3)血管造影征:是指增强扫描时在低密度实变肺背景中呈高密度强化的肺血管纹理影像(图2D)[11- 12]。由于大量黏液的存在,一般认为PPMA实变影对18F-FDG摄取程度较低,增强CT强化不明显[13- 14]。本研究11例具有实变影的病例中,9例具有黏液腺癌的特征性PET/CT表现;仅1例(9.1%)实变影对18F-FDG摄取程度较低(2.2),余10例实变影的SUVmax较高(甚至高达18),可能与本研究病例的实变影密度普遍较高、黏液成分含量少有关。
本研究发现实变影对18F-FDG摄取程度与病灶密度具有相关性,实变影中囊性密度成分对18F-FDG摄取程度显著低于实性成分(平均SUVmax:2.7比7.8)。密度较高的实性成分对18F-FDG的摄取可明显提高整个病灶的SUVmax值,因此,不可仅以放射性摄取高低作为判断病变是否为PPMA的标准,而应结合CT征象综合判断。
典型孤立性PPMA的CT表现为实性或部分实性结节,纯磨玻璃密度影少见。病灶呈囊实性肿块,以囊性成分为主,与癌组织分泌大量黏液相互融合后形成的黏液囊有关[15]。肺腺癌多表现为结节或团块,与单发PPMA表现类似,而多发PPMA由于包含结节、团块、空洞以及实变影,特别是实变影,易与肺腺癌相鉴别,因此,需注意孤立性PPMA与肺腺癌的鉴别诊断。由于PPMA病灶是由附壁生长的肿瘤细胞和肺泡内大量黏液组成,因此肿瘤细胞的实际密度较低,既往研究多认为PPMA的SUVmax值较低[16],这与其病理基础相关。文献报道了不同病理类型肺癌的SUVmax值,其中鳞癌的SUVmax均值最高(9.6),其次为大细胞癌(7.5),PPMA最低(1.6)[16- 19]。Chang等[20]研究亦证实,与鳞状细胞癌、非黏液性腺癌或其他恶性肿瘤相比,PPMA的SUV峰值明显降低。最新研究认为,CT表现为恶性病变,而18F-FDG呈低摄取,即形态-代谢分离征可作为孤立性PPMA与其他类型单发结节腺癌的鉴别诊断[21- 22]。本研究7例孤立性PPMA的PET/CT均表现为较明显的恶性病变特征(分叶征与棘突等),3例(42.9%)为18F-FDG低摄取,4例为高摄取,低摄取的比例高于其他腺癌病灶。而高摄取结节或团块,其18F-FDG摄取也与密度呈正相关。3例含囊性密度成分的团块,其囊性成分均偏于病灶一侧,且无放射性摄取或放射性摄取显著低于实性成分,这与其他类型肺腺癌中心坏死液化多位于病灶中心不同,考虑与黏液囊形成有关,可作为PPMA的特征性改变,与肺腺癌进行鉴别。
虽然PPMA病灶对18F-FDG呈低摄取,但18F-FDG PET/CT作为全身显像,可发现远处转移以及隐蔽部位的淋巴结转移,有助于精确TNM分期[14]。本研究18F-FDG PET/CT显像共发现6例患者存在远处转移且无论肺部病灶18F-FDG摄取程度如何,转移灶基本均呈高摄取的特征,其原因有待进一步探究。
3.2 PPMA的增强CT影像特征
CT是PPMA检查的常用影像学方法,可显示孤立性病灶或多发性占位,形态多样,增强扫描后病灶可无明显强化或不均匀强化。本研究6例PPMA患者行增强CT扫描,其中4例呈不均匀强化,2例无强化。PPMA实变影的SUVmax值与CT增强程度有相关性,18F-FDG摄取高的部分有明显强化,18F-FDG摄取低或无摄取的部分不强化,分析原因:密度较高的实性部分肿瘤细胞含量高,因此强化及18F-FDG摄取均较明显;而囊性部分或肿瘤细胞含量低的部分,18F-FDG摄取低或无摄取,因此强化不明显。
本研究局限性:由于PPMA发病率较低,收集的样本受限且为单中心回顾性研究,影响了结果的稳定性。未来需开展大样本多中心研究,以减少偏倚。
综上,PPMA临床表现不典型,18F-FDG PET/CT或增强CT显示病灶可单发也可为弥漫性病变,尤其弥漫性多发PPMA,18F-FDG PET/CT显像常表现为结节、斑片影等多种占位形式与实变影混合存在,需注意与肺部感染性疾病的鉴别诊断。实变影是PPMA的特征性改变,该类型病灶对18F-FDG摄取程度与病灶密度和CT强化程度呈正相关。PET/CT示上肺叶膨隆、病理性支气管充气征以及血管造影征等特征性表现有助于PPMA与肺部感染性疾病的鉴别诊断。此外,通常感染性疾病的代谢分布不均匀(远心端高于近心端),而PPMA病灶的代谢程度与病灶密度呈正相关,亦有助于二者的鉴别。若PET/CT示低密度黏液病灶呈低代谢时或病灶表现为炎症改变时,应警惕PPMA的可能性。
作者贡献:韩萍萍负责病例收集、PET/CT图像解读、论文撰写;富丽萍负责PET/CT图像解读、论文修订;张凌负责CT图像解读;冯宏响提供病例并协助论文修订;史艳芬负责病理图片解读;郑玉民负责病例收集、PET/CT图像解读、论文修订。
利益冲突:所有作者均声明不存在利益冲突
