拟无枝酸菌宿主构建及次级代谢基因簇异源表达
2022-06-06胡欣瑞贺卫军吕金王业民陶美凤
胡欣瑞,贺卫军,吕金,王业民,陶美凤
上海交通大学微生物代谢国家重点实验室,上海 200030
放线菌来源的天然产物具有多样的化学结构和丰富的生物活性,在医疗和农业方面具有重要应用价值[1-2]。其中许多重要抗生素由稀有放线菌产生,如万古霉素、替考拉宁、红霉素和利福霉素[3]。近些年,由于常在链霉菌中重复筛选出已知天然产物,新型活性化合物的获得效率大大降低,稀有放线菌作为挖掘新型抗生素的潜在资源,愈发受到关注[3-5]。通过基因组学和生物信息学研究发现放线菌基因组中通常含有20~40 个生物合成基因簇(biosynthesis gene clusters,BGC)。然而在实验室培养条件下,仅少数BGC 产生对应的天然产物,超过90%的BGC处于沉默状态,这些BGC被称为隐性基因簇[6-7]。由于大多数稀有放线菌生长缓慢、遗传操作困难,将目标化合物的基因簇转到异源宿主中表达成为发现隐性天然产物的有效途径[8]。这种方法主要取决于2个因素:一是将完整的BGC 克隆到合适的表达载体中的能力;二是异源宿主表达外源BGC的兼容性。
目前,链霉菌因其相对完备的遗传操作系统和强大的次级代谢能力被开发成最广泛使用的宿主,如天蓝色链霉菌M145、变铅青链霉菌TK24、白色链霉菌 J1074 和阿维链霉菌 SUKA2 等[8-10]。这些模式异源宿主具备一些共同的特征,如:生长速率快,遗传操作简单,遗传背景清晰,对次级代谢产物的分析背景低;能识别并转录外源DNA,即能识别异源生物合成基因簇的所有表达调控元件,以确保所需蛋白质的功能性表达;能提供丰富的前体和辅因子,满足不同类型化合物生物合成的需求;其内源天然产物的表达与调控已有一定程度的了解,便于对异源途径进行理性设计;能表达必要的转录后修饰系统,如磷酸泛酰巯基乙胺基转移酶,使天然产物生物合成相关蛋白活化[11]。
在实际应用中,针对特定的目标化合物,常遇到在异源宿主中不表达或产量很低的情况,一般还需要进行密码子优化、增加前体供应、使用强启动子、过表达正调控蛋白和敲除负调控蛋白等一系列操作对宿主菌株进行工程化改造,实验周期较长[12-13]。考虑到化合物来源、宿主的转录机制和代谢能力,需要开发亲缘关系更近或兼容性更高的底盘菌株。2018年,Zhang 等[14]首次开发出海洋放线菌Salinispora tropicaCNB-440 作为异源宿主,用于表达来自Salinispora pacifica的硫乳霉素生物合成基因簇,与在超级宿主天蓝色链霉菌M1152 中生产相比产量提高 3 倍。2019年,Wang 等[15]开发了 CRAGE 工具用于快速激活未驯化的细菌来源的生物合成基因簇,发现当基因簇在与天然生产者亲缘关系近的菌株中表达时,产物多样性和产量比远缘菌株更大。这些研究均暗示着开发系统发育多样的底盘菌株可能会显著提高基因簇异源表达的成功率或产量。2020年,Lü 等[16]敲除红色糖多孢菌 HOE107 的内源基因簇,使其成功异源表达来自刺糖多孢菌的多杀菌素和来自天蓝色链霉菌的放线紫红素。稀有放线菌来源的异源表达宿主对于活性天然产物的基因组挖掘具有重要意义,但目前相关报道非常有限。
稀有放线菌拟无枝酸菌(Amycolatopsissp.)TNS106 是一株糖肽抗生素瑞斯托霉素(ristomycin)的产生菌,前期研究发现其发酵2~3 d即可达到产素高峰,发酵周期较短[17]。本研究旨在开发TNS106作为底盘宿主,用于表达异源生物合成基因簇,以补充目前以链霉菌为主的宿主库。为了构建具有干净的次级代谢背景的可整合宿主,用噬菌体ΦC31 和ΦBT1 细菌附着位点attB替换瑞斯托霉素生物合成的非核糖体肽合成酶基因rpsA,并在突变株中异源表达来自链霉菌的放线紫红素和来自糖多孢菌属的多杀菌素,旨在探究该菌株表达不同来源基因簇的适配性。
1 材料与方法
1.1 菌株、质粒与引物
大 肠 杆 菌 DH10B、ET12567、ET12567/pUB307、拟无枝酸菌TNS106、白色链霉菌J1074、变铅青链霉菌TK24、天蓝色链霉菌M145、红色糖多孢菌LJ161/pJTU2554 和LJ161/pMM1 菌株均由上海交通大学微生物代谢国家重点实验室保藏。本研究所用质粒见表1,所用引物由北京擎科生物科技有限公司合成(表2)。

表1 本研究所使用的质粒Table 1 Plasmids used in this study
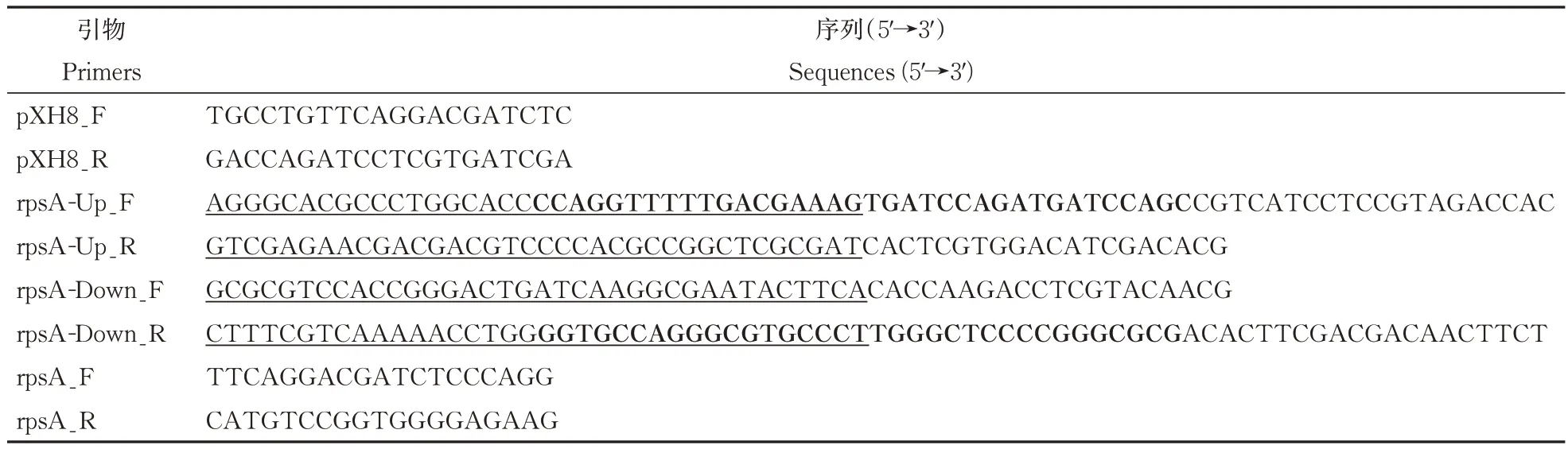
表2 本研究所使用的引物Table 2 Primers used in this study
1.2 培养基
研究中用到的培养基有LB 和LA(大肠杆菌培养基)、MS(放线菌固体培养基)、TSBY 液体培养基、SAM 液体培养基[22]、R5-固体培养基[23]、GMC 液体培养基、CTF4 液体培养基。TSBY、SAM、R5-和CTF4 培养基于115 ℃高压蒸汽灭菌30 min,其余培养基于121 ℃高压蒸汽灭菌30 min。
1.3 拟无枝酸菌TNS106生长曲线的测定
将拟无枝酸菌TNS106 单菌落接种至含有50 mL TSBY 培养基的三凹摇菌瓶中,30 ℃、220 r/min培养48 h;将5 mL种子液接种至含有50 mL SAM 培养基的三凹摇菌瓶中,30 ℃、220 r/min培养7 d;期间每隔24 h 取1 mL 发酵液置于预先称质量的1.5 mL离心管中,12 000 r/min离心5 min,小心弃去上清,将收集的菌体置于烘箱干燥至恒定质量,再次称质量后计算与空离心管的差值,即为生物量;记录1~7 d生物量变化,绘制生长曲线。
1.4 质粒的构建
1)pXH8 的构建。设计引物使得同源重组臂片段之间以及扩增产物与线性化载体之间各有36 bp的末端重叠序列,并分别凝胶回收同源重组臂片段和线性化载体。DNA 无缝克隆采用诺唯赞公司的ClonExpress®Ultra One Step Cloning Kit,配制10 μL反应体系:线性化载体,200 ng;上游同源重组臂片段,40 ng;下游同源重组臂片段,40 ng;2×ClonExpress Mix,5 μL;补加ddH2O 至 20 μL。将体系置于 50 ℃水浴30 min,脱盐后电转化,对单克隆进行验证。
2)pJWJ3H2 的构建。以pHLJ811为模板扩增鼠李糖和福乐糖胺合成基因,以pYH7为模板扩增氨苄青霉素抗性基因,然后利用重叠延伸PCR 获得blagtt-epi-gdh-kre基因盒。通过 PCR-targeting 技术[24]将基因盒敲入pSPI3H2,获得pJWJ3H2。
1.5 三亲本接合转移
将含有待转移质粒的供体菌株ET12567 和含有三亲本接合转移辅助质粒的菌株ET12567/pUB307分别接种至含有相应抗生素的5 mL LB 培养基,37 ℃ 220 r/min 培养至 OD600约为 0.6;取 5 mL 培养24 h 的新鲜TNS106 菌丝体和上述大肠杆菌混合,4 ℃4 000 r/min离心3 min,收集菌体;用无菌水洗涤2 次,每次 4 ℃ 4 000 r/min 离心 3 min;将洗好的菌体用1 mL 无菌水重悬并充分混匀,均匀涂布在2 块含有20 mmol/L MgCl2的MS平板,每块平板500 μL菌液,并于超净台干燥45~60 min,30 ℃倒置培养8~10 h;将抗生素溶液稀释到工作浓度(按平板中培养基的体积计算)后均匀覆盖在培养基表面,在超净台上干燥后于30 ℃继续静置培养3~5 d,观察长出的接合转移子。
1.6 瑞斯托霉素的发酵与检测
将TNS106 野生型和基因置换菌株HXR1 在MS 培养基上培养活化,挑取单菌落分别接种至含有50 mL TSBY培养基的250 mL三凹摇菌瓶中,30 ℃、220 r/min 培养48 h;将5 mL 种子液接种至含有50 mL SAM 培养基的三凹摇菌瓶中,30 ℃、220 r/min培养 2 d;取 1 mL 发酵液 12 000 r/min 离心 5 min,将上清用0.22 μm 滤膜过滤,对滤液进行HPLC 分析。流动相为水(A相)和甲醇(B相),两相均含0.05%甲酸。色谱柱为ZORBAX SB-C18(4.6 mm×250 mm,5 μm),流速为 0.6 mL/min,检测波长为 220 nm,洗脱条件:0~23 min,5%~25% B 相;23~30 min,25%~100% B 相 ;30~35 min,100% B 相 ;35.1~45 min,5%B相。
1.7 放线紫红素的发酵与检测
将含pMM1 的拟无枝酸菌和含载体对照的菌株在MS 培养基上活化,挑取单菌落分别接种至R5-平板固体发酵,30 ℃培养8 d;期间每隔24 h 用 1 mL 蓝枪头末端取同等大小菌块置于1.5 mL 离心管中,加入 1 mL 1 mol/L KOH 溶液,浸提 1 h;12 000 r/min离心5 min,取上清测量OD640,并扣除未接种培养基浸提液的光密度。
1.8 多杀菌素的发酵与检测
将含pJWJ3H2 的拟无枝酸菌和对照菌株在MS 培养基上活化,挑取单菌落分别接种至含有50 mL TSBY 培养基的 250 mL 三凹摇菌瓶中,30 ℃,220 r/min 培养48 h;将5 mL 种子液接种至含有50 mL CTF4 培养基的三凹摇菌瓶中,30 ℃,220 r/min避光发酵10 d;取1 mL发酵液加入等体积甲醇,超声处理30 min,避光静置12 h;12 000 r/min 离心5 min,将上清用0.22 μm 滤膜过滤,对滤液进行HPLC 分析。流动相为体积比为47.5∶47.5∶5.0 的甲醇/乙腈/0.05%乙酸钠溶液(A 相)和乙腈(B 相)。色谱柱为 ZORBAX SB-C18(4.6 mm×250 mm,5 μm),流速为1 mL/min,检测波长为250 nm,洗脱条件:0~15 min,0% B 相;15.1~20 min,100% B 相;20.1~30 min,0%B相。
2 结果与分析
2.1 拟无枝酸菌TNS106生长特性的评估
首先确定其生长曲线(图1A),TNS106 在SAM培养基中,1~3 d生长较快,生物量积累迅速,为对数生长期;3~5 d 达到稳定期,之后进入衰亡期。在TSBY、R5-、SAM 和 GMC 4 种液体培养基中观察,拟无枝酸菌TNS106 都呈现出菌丝体均匀分散的特征,而其他3种常见的链霉菌宿主白色链霉菌J1074、变铅青链霉菌TK24和天蓝色链霉菌M145均出现非常明显的颗粒和团块,且更易沉降(图1B)。菌丝体均匀分散的特征有利于菌体对氧气和营养物质的利用,对于大规模发酵过程具有重要的应用价值。其次,TNS106 在MS 平板上培养1 d 即可观察到非常明显的白色气生菌丝体,培养至后期菌丝体更加浓密,而其他3 种链霉菌宿主生长相对缓慢,菌丝体也较为稀疏和粗糙(图1C)。此外,由于拟无枝酸菌TNS106 产孢少,采用菌丝体代替孢子进行接合转移,省去传统方法中收集孢子、孢子热激和预培养的步骤,遗传操作更加简化。综上,TNS106 生长特性优良、遗传操作便捷,具有开发成底盘宿主的优势。

图1 拟无枝酸菌TNS106的生长特性Fig.1 Growth characteristics of Amycolatopsis sp.TNS106
2.2 rpsA基因置换质粒pXH8的构建
为了对拟无枝酸菌TNS106 中瑞斯托霉素生物合成基因簇内非核糖体肽合成酶基因rpsA进行基因置换以清除背景代谢物瑞斯托霉素,构建了rpsA基因置换质粒。以拟无枝酸菌TNS106的基因组DNA为反应模板,利用引物rpsA-Up_F/R 和rpsADown_F/R 分别扩增获得rpsA上下游各2 kb 的同源重组臂片段。用于扩增同源臂的引物中还添加了attBΦC31和attBΦBT1的序列。同时,将质粒pYH7 用限制性内切酶NdeⅠ和EcoRⅤ酶切制备线性化载体。用一步克隆试剂盒将同源重组臂片段与线性化载体进行重组。最后,将完成重组反应后的体系脱盐,电转化至大肠杆菌DH10B 中,在含有阿泊拉霉素的抗性平板上培养获得单克隆。用引物pXH8_F/R 对单克隆进行PCR 验证(图2B),并测序得到正确的rpsA基因置换质粒pXH8,其中2 个同源臂之间含有attBΦC31和attBΦBT1,因此,在敲除rpsA基因的同时将引入细菌附着位点,利于后续BAC 质粒和其他功能质粒的高效整合。
2.3 rpsA 基因置换菌株HXR1 的构建及其发酵产物分析
通过三亲本接合转移将rpsA基因置换质粒pXH8 转入TNS106 中,挑取接合子至含有阿泊拉霉素的MS抗性平板,筛选获得同源单交换菌株。将单交换菌株接种至不含抗生素的TSBY 液体培养基中松弛培养2 d,转接到TSBY 再松弛培养2 d。然后,取适量菌液划线至不含抗生素的MS平板上,培养获得单菌落。将单菌落一一对应地分别接种至含有或不含阿泊拉霉素的MS平板上培养,筛选获得阿泊拉霉素敏感菌株,即为双交换菌株(图2A)。最后,提取双交换菌株基因组DNA 作为模板,以TNS106 基因组 DNA 为对照,rpsA_F/R 为引物进行 PCR 验证。理论上,TNS106 野生型的扩增产物大小应为6 772 bp,缺失rpsA基因并引入2 个attB位点后的扩增产物大小应为660 bp。PCR 验证结果与预期完全一致(图2C),表明成功获得rpsA基因置换菌株,命名为HXR1。随后,将HXR1 和野生型菌株分别接种至SAM 液体培养基中发酵2 d,并对发酵液进行HPLC分析。如图3 所示,HXR1 的发酵液中不再积累瑞斯托霉素,具有更加干净的代谢产物分析背景。

图2 rpsA基因置换突变株HXR1的构建Fig.2 Construction of the rpsA gene replacement mutant HXR1

图3 基因置换菌株HXR1和野生型发酵液的HPLC分析Fig.3 HPLC profile analysis of ristomycin A in WT and HXR1
2.4 以HXR1为宿主异源表达放线紫红素
放线紫红素(actinorhodin)是天蓝色链霉菌产生的聚酮类色素抗生素(图4A),在碱性环境中呈现蓝色,由Ⅱ型聚酮合酶利用乙酰辅酶A和丙二酰辅酶A催化合成。为评估HXR1 表达异源基因簇的能力,将包含完整放线紫红素生物合成基因簇的质粒pMM1 通过位点特异性重组整合至其染色体上,抗性筛选获得突变株HXR1/pMM1。在R5-培养基上培养3 d 时,HXR1/pMM1 可以明显观察到蓝色色素的产生(图4B)。为了与之前报道的稀有放线菌宿主红色糖多孢菌LJ161 定量比较放线紫红素的产生情况,将HXR1/pMM1 和LJ161/pMM1 发酵产物分别用1 mol/L KOH 溶液浸提(图4C),并测定在640 nm处的光密度。结果显示,HXR1/pMM1在发酵第2天开始产生放线紫红素,第3~6 天迅速积累,在第4 天可以达到LJ161/pMM1发酵的最大产量。与LJ161/pMM1 相比,HXR1/pMM1 中放线紫红素提前 1 d 产生,产量提高了1.3倍(图4D)。

图4 以HXR1为宿主异源表达放线紫红素Fig.4 Heterologous expression of actinorhodin by HXR1 carrying the S.coelicolor actinorhodin BGC on pMM1
2.5 以HXR1为宿主异源表达多杀菌素
通过异源表达多杀菌素来验证HXR1 与稀有放线菌来源的基因簇的适配性。多杀菌素(spinosad)是多杀菌素A 和多杀菌素D 的混合物(图5A),常作为一种高效绿色杀虫剂,由Ⅰ型聚酮合酶负责合成。多杀菌素原始产生菌为刺糖多孢菌,与拟无枝酸菌同为拟诺卡氏菌科,但不同属。BAC 质粒pJWJ3H2含有完整多杀菌素生物合成基因簇和多杀菌素生产所必需的4 个鼠李糖生物合成基因。通过三亲本接合转移将pJWJ3H2 转入HXR1 中获得HXR1/pJWJ3H2。接着,将HXR1/pJWJ3H2 和整合了空载体的对照菌株HXR1/pHL921 分别接种至CTF4 液体培养基中发酵10 d,并对发酵液进行HPLC 分析。如图 5B 所示,与对照相比,HXR1/pJWJ3H2 在 8.592 min 和9.819 min 出现的2 个差异峰与多杀菌素标准品的保留时间一致,推测其分别为多杀菌素A 和多杀菌素D。高分辨质谱分析(UHPLC/Q-TOFMS)结果表明,样品中2 个目标化合物的相对分子质量分别与多杀菌素A 和多杀菌素D 的相对分子质量一致(图5C)。综上,HXR1/pJWJ3H2 成功异源表达多杀菌素生物合成基因簇,产生多杀菌素A和多杀菌素D。
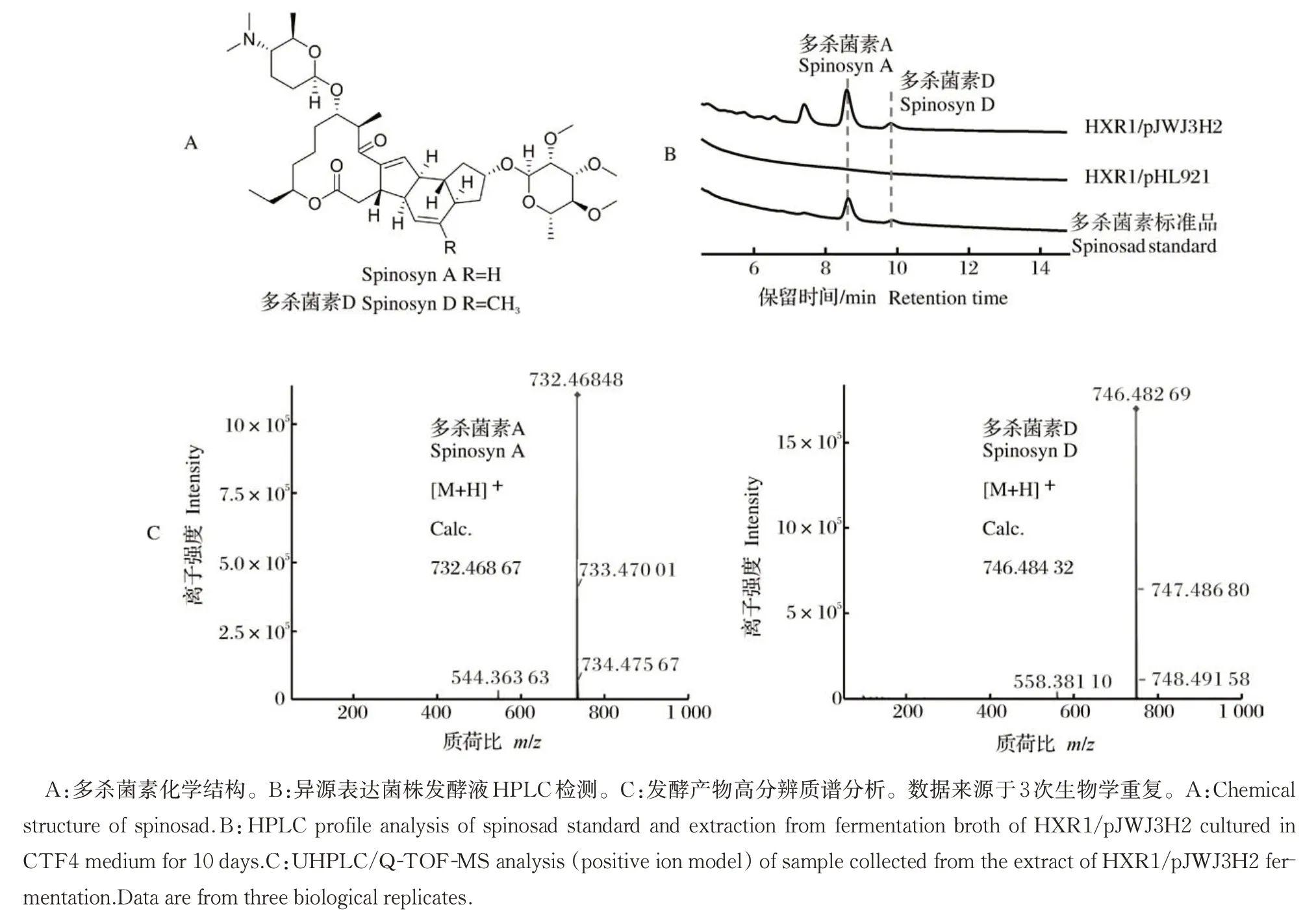
图5 以HXR1为宿主异源表达多杀菌素Fig.5 Heterologous expression of spinosad by HXR1
3 讨 论
异源表达已经成为“隐性”基因簇对应代谢产物的发掘和天然产物生物合成规律研究的常规方法。稀有放线菌蕴含丰富的“隐性”基因簇,采用亲缘关系更近的非链霉菌来源的宿主对于激活这些基因簇更为有利。然而,目前广泛使用的放线菌底盘主要是链霉菌,稀有放线菌由于生长缓慢和遗传改造困难,鲜有被开发成异源表达宿主的报道。
本研究基于快速生长、特性优良的稀有放线菌拟无枝酸菌TNS106,通过同源重组的方法,将其主产物瑞斯托霉素生物合成的必需基因rpsA替换为attB位点,获得一个代谢背景干净的底盘菌株HXR1。HXR1 能成功表达链霉菌来源的放线紫红素和稀有放线菌来源的多杀菌素,表明该宿主对不同来源的BGC具有一定普适性。而且与红色糖多孢菌相比,拟无枝酸菌HXR1 的放线紫红素产生更早、产量更高,具有一定优势。异源表达宿主菌株HXR1对于未来链霉菌和稀有放线菌中天然产物的发现和工程化应用具有重要意义。
