嗜水气单胞菌双组分系统FlrBC的功能探究
2022-06-06马倩倩周洋张永安
马倩倩 ,周洋 ,2,3,张永安 ,2,3
1.华中农业大学水产学院,武汉 430070;2.岭南现代农业科学与技术广东省实验室,广州 510542;3.长江经济带大宗水生生物产业绿色发展教育部工程研究中心,武汉 430070
嗜水气单胞菌(Aeromonas hydrophila)是我国流行最广泛的水生动物致病菌之一,几乎能够感染所有大宗淡水养殖鱼类品种。该菌在高密度人工养殖鱼塘极易引起暴发性疾病[1],造成严重经济损失。近年来该菌引起的运动性气单胞菌败血症对全球水产养殖业造成毁灭性影响[2],甚至观赏鱼养殖也面临该菌的威胁[3]。嗜水气单胞菌致病过程复杂,解析其致病机制对于预防和治疗嗜水气单胞菌病具有重要意义。
双组分系统(two-component system,TCS)是细菌感受环境并及时做出反应的信号转导机制,在细菌生长、分化、代谢、毒力、持留性、致病性等多个方面发挥调控作用[4]。FlrBC 是一对经典的双组分系统,可激活下游鞭毛基因转录,对于细菌极生鞭毛形成至关重要[5]。鞭毛不仅作为细菌的运动胞器参与多种运动过程,在生物被膜形成过程中也起着重要作用,细菌可通过控制生物被膜形成来间接调控致病性[6]。目前在嗜水气单胞菌中关于双组分系统的研究不多,仅见到CpxA/R[7]、QseB/C[8]、EnvZ/OmpR[9]等双组分系统,而嗜水气单胞菌中双组分系统FlrBC 未见报道,该系统的功能未知,调控的下游基因仍不明确,因此,本研究构建了双组分系统FlrBC的单基因缺失株ΔflrB和ΔflrC,以期初步阐明FlrBC在嗜水气单胞菌极生鞭毛合成、生物被膜形成及致病机制中的作用。
1 材料与方法
1.1 菌株和质粒
嗜水气单胞菌野生株ZYAH72[10]分离自湖北省荆州市某渔场患病鲫,由笔者所在实验室保存,NCBI 序列号为 NZ_CP016989.1。大肠杆菌(E. coli)χ 7213 感受态及自杀质粒pRE112 均为笔者所在实验室保存。草鱼肾细胞CIK 细胞系(grass carp kidney cell line,CVCL_CV32)由笔者所在实验室保存并传代。
1.2 试 剂
胎牛血清(FBS)和 M199 培养基购自 Gibco 公司;PrimeSTAR Max DNA 聚合酶、限制性内切酶、DNA Marker 购自诺唯赞公司;青霉素-链霉素双抗和氯霉素均购自海博生物试剂公司;RNA 提取试剂盒、质粒提取试剂盒购自天根生化科技(北京)有限公司;反转录试剂盒PrimeScript TMRT Kit 购自Ta-KaRa 公司;实时荧光定量PCR 检测试剂盒(SYBR Green PCR master mix)购自美国Bio-Rad公司;试验中使用的引物见表1,均由擎科生物技术有限公司合成。

表1 引物序列Table 1 Primers information
1.3 ΔflrB和ΔflrC基因缺失株的构建
通过同源重组法构建ΔflrB和ΔflrC基因缺失株。以ΔflrB缺失株构建为例,以嗜水气单胞菌ZYAH72 基因组 DNA 为模板,用引物 P1/P2 和 P3/P4 扩增flrB上下游同源臂,再将上下游同源臂作为模板通过Overlap PCR连接。将提取的pRE112质粒和上下游同源臂融合片段进行双酶切再利用同源重组酶连接,然后转化至大肠杆菌χ7213。将构建成功的χ7213-pRE112-flrB作为供体菌,嗜水气单胞菌ZYAH72 作为受体菌,进行接合转移。具体操作如下:供体菌和受体菌分别培养至对数生长期,用无菌磷酸盐缓冲液(PBS)洗涤2 次后混合均匀。将混合液加到提前放置在无抗LA 平板上的无菌硝酸纤维素膜上,28 ℃静置6 h后用LB 液体培养基冲洗,适当梯度稀释后涂布于氯霉素抗性平板上。28 ℃生长36 h 待结合子长出,用P1/P4 外部引物进行PCR 验证,验证为阳性的单交换子在7%蔗糖LB 培养基中连续传代筛选。对于氯霉素敏感菌株用内部引物P5/P6 进行PCR 验证,PCR 鉴定结果为阴性即表明ΔflrB缺失株构建成功。
1.4 细菌鞭毛的观察实验
将菌株接种到LA 平板上,28 ℃培养12~14 h 后用无菌PBS 重悬,用铜网蘸取适量菌液,然后用1%钨酸负染5 min,空气中晾干后在透射电镜(日立HITACHI,H-7650,100 kV)下观察。
1.5 菌株游动性观察实验
配制琼脂质量分数为0.25%的半固体平板。将待观察的菌株用LB 液体培养基培养至对数生长期,将各菌株菌液稀释至OD600nm=1.0。用牙签蘸取菌液点在半固体平板中央,平板置于28 ℃条件下培养14~16 h,拍照观察菌株的游动半径,每株菌设置3个重复。
1.6 生物被膜形成能力检测实验
用结晶紫染色检测菌株的生物被膜形成能力。操作步骤如下:将新鲜菌液稀释至OD600nm=1.0,在细胞板中以1∶200体积比接种到3 mL液体LB 中,保证培养基不会完全挥发,28 ℃恒温培养箱静置培养48 h后,用枪头将菌液取出,用无菌PBS洗涤3次,以去除松散黏附的细胞。剩余的附着细菌用甲醇固定15 min。在空气中干燥后,加入3 mL 0.1%的结晶紫溶液染色20 min,无菌PBS清洗3次以除去未被结合的结晶紫,用质量分数为33%的冰醋酸溶解生物被膜,分光光度计测定每孔的OD595nm值。每株菌设置3个重复。
1.7 刚果红吸附实验
收集过夜培养的菌液,以1∶100体积比接种到液体LB 中,培养至OD600nm=1.0。取2 mL稀释后的菌液离心,去上清液,用含 40 μg/mL 刚果红的 LB 液体重悬菌体后置于28 ℃振荡培养12 h。然后离心将菌体及其吸附的刚果红沉淀到底部,取上清液部分测量光密度值OD490nm,用于评价培养基中剩余的刚果红量。另外用同样含40 μg/mL 刚果红的LB 液体的OD490nm做阳性对照,阳性对照值减去培养基中剩余刚果红的值即为被胞外多糖吸附的刚果红含量。每株菌设置3个重复。
1.8 qRT-PCR检测
使用TaKaRa 反转录试剂盒(PrimeScript TMRT Kit)进行反转录,2×SYBR Green PCR master mix 进行荧光定量PCR,用于定量生物被膜合成基因flgB、flgM、flaA、malB、ompAII、malE、deoD、glnA、omp38[11],内参基因为16S rRNA。qRT-PCR 反应体系(20 μL):模板cDNA 2 μL,上下游引物各0.5 μ L,2×SYBR Green master mix 10 μ L,ddH2O 7 μL。反应程序:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,40 个循环。实验独立重复3次,分析方法采用2-ΔΔCT法[12]。
1.9 对草鱼肾细胞CIK黏附实验
收集新鲜菌液,用无血清、无抗生素的M199 培养基将菌浓度调节为1.0×108~2.0×108cfu/mL。取含有单层细胞的24孔细胞培养板,去除培养液,用Hank’s 平衡盐溶液洗涤 3 次,将 100 μL 菌液接种至细胞板孔内,所有孔补加900 μL 培养液,不加细菌的细胞为阴性对照。37 ℃、5%CO2孵育3 h后,去除上清,用 PBS 洗 5~6 次,每孔加入200 μL 0.025%胰酶消化细胞10 min,加入800 μL 培养液吹打细胞。稀释后涂平板,置于28 ℃培养,记录菌落总数[13]。每株菌设置3个重复。
1.10 全血杀伤实验
采集健康成年草鱼全血,用EDTA 作抗凝处理,调节菌浓度为105cfu/mL,菌和全血以1∶9 体积比混匀后于28 ℃培养箱静置培养。作用1 h 后取100 μL菌-全血混合物,使用无菌PBS 10倍梯度稀释后涂布平板,28 ℃培养箱中过夜培养,第2 天进行菌落计数[14]。
1.11 数据分析
数据处理用Graphpad Prism 6.0软件做图,利用t检验进行统计学分析,以P<0.05 为有统计学差异,P<0.01 为有显著统计学差异,P<0.001 为有极显著的统计学差异。
2 结果与分析
2.1 嗜水气单胞菌FlrBC 双组分系统ΔflrB、ΔflrC缺失株构建
以嗜水气单胞菌ZYAH72 基因组为模板,通过flrB基因外部引物(P1/P4)PCR 扩增,野生型获得大约 2 500 bp 产物,ΔflrB产物为 1 120 bp,通过flrB基因内部引物(P5/P6)PCR扩增,野生型获得480 bp产物,ΔflrB无对应片段因此无法获得扩增产物,结果均与预期一致,表明ΔflrB缺失株构建成功(图1)。通过flrC基因外部引物(P7/P10)PCR 扩增,野生型获得大约2 500 bp 产物,ΔflrC产物为 1 122 bp,通过flrC基因内部引物(P11/P12)PCR 扩增,野生型获得466 bp 产物,ΔflrC无对应片段因此无法获得扩增产物,结果均与预期一致,表明ΔflrC缺失株构建成功(图1)。
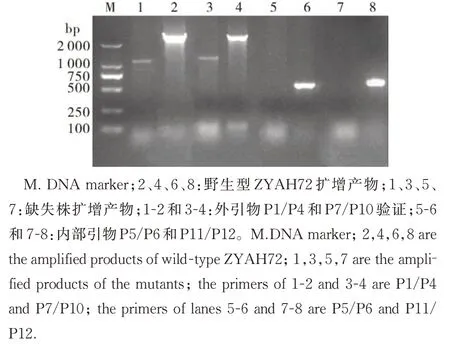
图1 ΔflrB和ΔflrC缺失株PCR验证Fig.1 PCR verification of mutant strain ΔflrB and ΔflrC
2.2 flrB、flrC 基因缺失对细菌极生鞭毛合成及游动性的影响
通过透射电镜多视野观察细菌鞭毛发现,野生型ZYAH72有单根附着的极生鞭毛,flrB或flrC基因缺失不影响这一表型,在ΔflrB和ΔflrC中也均有着生的极生鞭毛(图2A),未观察到鞭毛断裂的现象。半固体培养基检测各菌株游动能力差异,发现野生型ZYAH72、ΔflrB和ΔflrC均有明显扩散,且游动性没有显著差异,表明flrB和flrC缺失对于细菌游动性无显著影响(图2B)。
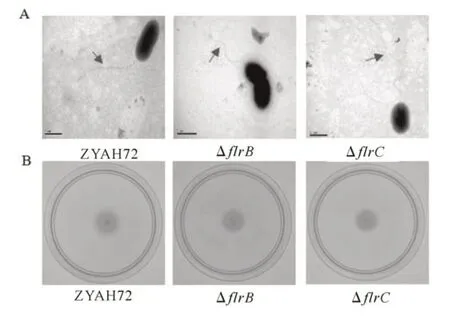
图2 细菌的鞭毛(A)和半固体平板上细菌的游动性(B)Fig.2 Bacterial flagella(A)and motility(B)on semi-solid plates
2.3 flrB、flrC 基因缺失对细菌生物被膜形成能力影响
通过检测生物被膜的形成量,探究双组分系统FlrBC 是否参与嗜水气单胞菌生物被膜形成过程。结晶紫染色结果(图3A)显示,与野生株相比,ΔflrB的生物被膜形成能力下降了27.2%,ΔflrC的生物被膜形成能力下降了22.3%(图3B)。这些结果说明双组分系统FlrBC 参与嗜水气单胞菌的生物被膜形成。

图3 结晶紫染色法定性(A)和定量(B)检测细菌生物被膜形成(n=3)Fig.3 Biofilm formation of qualitative(A)and quantitative(B)detection
2.4 flrB、flrC 基因缺失对嗜水气单胞菌极生鞭毛合成及生物被膜相关基因的影响
实时荧光定量PCR 结果显示,与野生型相比,ΔflrB中flaA、flgB、flgM的表达水平分别下调了67%、65.2%、99.4%,而在ΔflrC中只有flgM下调了74.8%(图4A),说明flrB和flrC 的缺失对不同鞭毛合成编码基因影响程度不同。对于生物被膜相关基因表达水平检测发现,与野生型相比,ΔflrB中malB、ompAII、malE、deoD、glnA、mglB、omp38的表达水平都显著下调,对应为86.4%、83.9%、84.0%、81.3%、82.8%、86.6%、51.7%,而在 ΔflrC中malB、malE、deoD、omp38表达水平与野生株相比无差异,ompAII、glnA、mglB分别下调了20.1%、27.1%、59.2%(图4B)。上述结果表明flrB和flrC基因缺失后对鞭毛组装通路、生物被膜形成相关基因表达都有影响,但对不同的基因调控程度不同,flrB缺失对上述相关通路基因表达的影响明显强于flrC。

图4 细菌鞭毛合成基因和生物被膜基质编码基因的相对表达变化(n=3)Fig.4 Relative expression changes of bacterial flagellar synthesis and biofilm components genes
2.5 flrB、flrC基因缺失对胞外多糖分泌的影响
通过刚果红吸附实验检测细菌胞外多糖产生量,结果显示,与野生型相比,ΔflrB和ΔflrC的胞外多糖产生量分别下降了18.4%和14.2%(图5),该结果与2.3 中ΔflrB和ΔflrC生物被膜形成量减少的表型相符,表明flrB和flrC基因缺失后细菌胞外基质中多糖组分减少,从而导致生物被膜形成减少。
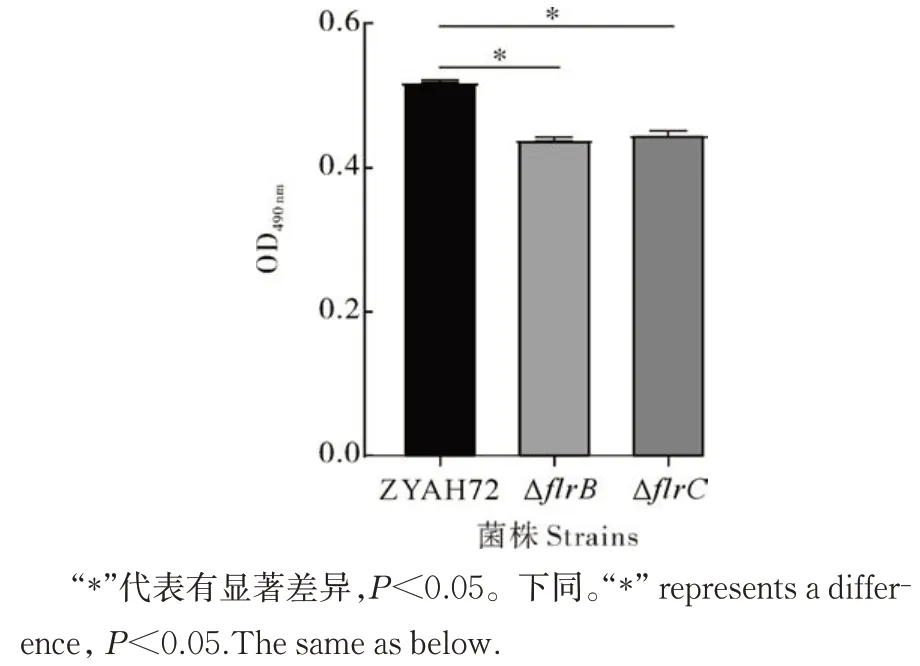
图5 细菌鞭胞外多糖含量检测(n=3)Fig.5 Exopolysaccharide formation test
2.6 flrB、flrC 基因缺失后对草鱼肾细胞CIK 黏附能力影响
与野生株相比,flrB基因缺失后细菌对草鱼肾细胞CIK 细胞黏附下降了23.2%,flrC基因缺失后对草鱼CIK 细胞黏附下降了18.2%(图6),表明双组分系统FlrBC参与细胞黏附过程。
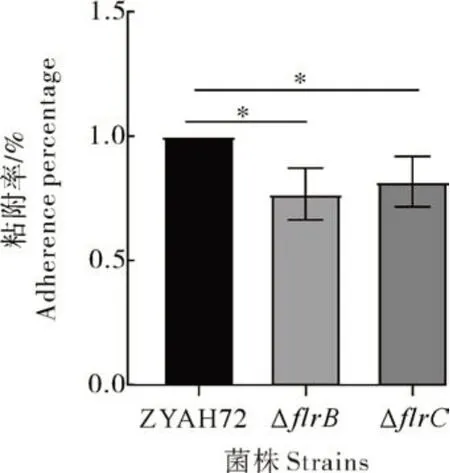
图6 细菌对草鱼肾细胞CIK的黏附能力检测(n=3)Fig.6 Detection of bacterial adhesion to CIK cells
2.7 flrB、flrC 基因缺失对嗜水气单胞菌抗全血杀伤中的作用
在抗全血杀伤实验中,野生型在与草鱼全血孵育3.0 h 后,细菌数量为起始菌量的22.79 倍,而ΔflrB、ΔflrC被草鱼全血有效杀伤,孵育3.0 h 后菌量仅为起始菌量的1.73、2.21 倍(图7),表明flrB和flrC缺失后,细菌抗全血杀伤能力显著下降。

图7 抗全血杀伤能力检测(n=3)Fig.7 Capacity of anti-whole blood killing assay
3 讨 论
本研究成功构建了嗜水气单胞菌双组分系统FlrBC基因缺失株ΔflrB和ΔflrC,并基于此初步探究了双组分系统FlrBC 的功能。鉴于双组分系统FlrBC是嗜水气单胞菌极生鞭毛形成中的二级基因,我们推测其和鞭毛合成有关,本研究结果表明双组分系统flrB或flrC单基因缺失并不影响极生鞭毛形成及细菌游动性,然而参与调控下游鞭毛合成基因表达。该结果与铜绿假单胞菌(Pseudomonas aeruginosa)和霍乱弧菌(Vibrio cholerae)相反,在上述细菌中Flr-BC 对于形成完整极生鞭毛必不可少,且参与调控多个鞭毛合成基因表达[15-16]。但我们的结果与奥奈达希瓦氏菌中FlrBC 对于鞭毛合成调控的结果一致[17],表明在细菌不同种属中,双组分系统FlrBC 对于鞭毛合成的调控机制存在多样性。为进一步验证这一假设,可构建ΔflrB和ΔflrC互补菌株,然而在本研究中未能构建成功。
细菌在感染过程面对宿主免疫系统的清除杀伤或是在环境中面临各种胁迫,建立生物被膜是细菌自我保护最有效的措施之一。据报道,鞭毛在生物被膜形成初期和成熟后期中发挥重要作用[18-19],鞭毛合成基因突变株的生物被膜形成能力下降[20],我们的研究也证实了这一点,表明双组分系统FlrBC作为鞭毛合成基因正调控嗜水气单胞菌生物被膜形成。前人研究证明嗜水气单胞菌生物被膜合成基因包括malB、ompAII、malE、deoD、glnA、mglB、omp38[11],我们也证明在基因表达水平上,FlrBC 调控生物被膜合成基因表达,flrB缺失后大部分生物被膜合成基因malB、ompAII、malE、deoD、glnA、mglB、omp38表达显著下调,flrC缺失后ompAII、mglB、和glnA表达显著下调,表明FlrB 和FlrC 对这些基因的调控模式不同,FlrB 对于嗜水气单胞菌生物被膜形成过程的调控作用大于FlrC。关于生物被膜合成基因研究较少,OmpAII在维氏气单胞菌(Aeromonas versonii)中被证实是黏附因子[21],在大肠杆菌生物被膜形成中过量表达[22]。glnA基因编码的谷氨酰胺合成酶最近证明影响细菌体外生长和体内定植[23]。mglB基因编码的半乳糖ABC 转运蛋白,影响细菌两极的细胞定位[24]。在嗜水气单胞中,这些生物被膜合成基因是否发挥生物被膜形成之外的功能还有待进一步研究。
鞭毛是细菌重要的黏附素,鞭毛组装通路影响细菌黏附[25]。CIK 黏附实验结果表明,flrB、flrC缺失后细菌对CIK 细胞黏附能力显著低于野生株,这意味着虽然flrB和flrC对嗜水气单胞菌极生鞭毛合成及游动是非必需的,但仍然参与嗜水气单胞菌极生鞭毛合成的调控过程。实时荧光定量结果显示,鞭毛合成基因flaA、flgB和flgM在 ΔflrB和 ΔflrC中有不同程度的差异表达,可能导致ΔflrB和ΔflrC的细胞黏附能力变化,其中,flrB和flrC缺失导致flgM表达下调最多。在香鱼假单胞菌(Pseudomonas plecoglossicida)中 FlgM 参与调节毒力,flgM在感染石斑鱼过程中表达水平显著上调,flgM基因沉默菌株感染组石斑鱼较野生型感染组死亡延迟、死亡率降低,脾脏病变减轻,表明flgM基因沉默导致香鱼假单胞菌毒力降低,且转录组测序分析表明,flgM基因沉默株感染组石斑鱼较野生型感染组17个免疫相关基因差异表达[26]。本研究中,抗草鱼全血杀伤结果表明,flrB和flrC基因缺失后嗜水气单胞菌抵抗宿主杀伤能力显著降低,表明缺失株的毒力下降,该表型可能与ΔflrB和ΔflrC中flgM转录下调相关。
综上,本研究初步探究了嗜水气单胞菌双组分系统FlrBC的功能,发现其对极生鞭毛合成及细菌游动是非必需的,但影响生物被膜形成和胞外多糖分泌,调控鞭毛合成和生物被膜胞外基质组分相关基因表达,且在细菌黏附和抵抗宿主全血杀伤过程中发挥重要作用,这一结果可为嗜水气单胞菌致病调控机制的解析提供理论依据。
