斑点叉尾鮰IL-22基因克隆及对不同刺激物的响应
2022-06-06朱霞杨移斌张蕾胥宁艾晓辉
朱霞 ,杨移斌 ,张蕾,胥宁,艾晓辉
1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院长江水产研究所,武汉 430223
白介素-22(Interleukin-22,IL-22)是一种Ⅱ型细胞因子[1],与IL-19、IL-20、IL-24 和IL-26 同属IL-10家族。在所有动物中,细胞因子作为一类重要的蛋白质,通常在协调免疫反应中发挥作用[2]。哺乳动物中主要依靠CD4+效应淋巴细胞和其他淋巴细胞分泌[3],经 JAK-STAT 信号通路或直接利用 Notch 信号途径上调IL-22表达量从而抵御外界病原作用后产生的炎症[4]。此外,IL-22 还具有多种作用,如诱导抗生物肽(AMPs)和促炎症分子,激活屏障表面的上皮细胞,通过限制细菌的复制控制病原体入侵[5];刺激靶细胞释放粘附因子,加速细胞增殖,修复受损组织[6]。在应激状态或IL-22过表达时诱导机体产生保护性免疫应答[7]。2005年IL-22基因首次在哺乳动物以外的斑马鱼(Danio rerio)[8]上被克隆,随后分别在硬骨鱼虹鳟(Oncorhynchus mykiss)[9]、大菱鲆(Scophthalmus maximus)[10]、黄 颡 鱼(Pelteobagrus filvidraco)[11]、鳜(Siniperca chuasti)[12]和 草 鱼(Ctenopharyngodon idellus)[13]中被陆续报道。IL-22在斑马鱼、草鱼、虹鳟等硬骨鱼中能够促进宿主抵抗外源病原的感染,因此,了解免疫因子的表达动态是提高鱼类自身免疫限制疾病暴发的关键。
斑点叉尾鮰(Ictalunes punctatus)隶属于鮎形目(Siluriformes),鮰科(Lctaluridae),真鮰属,自1984年引入湖北以来颇受广大消费者喜爱。近年来已成为鮰科的主要养殖对象,但养殖中受限的养殖环境常导致鱼体自身健康受到威胁。因此,研究斑点叉尾鮰的免疫基因,探明斑点叉尾鮰应答过程中的机制十分必要。先前关于IL-22在硬骨鱼中的研究已有不少,为进一步探究斑点叉尾鮰IL-22编码区序列特征以及不同诱导模式下IL-22表达变化,本研究利用聚合酶链式反应技术(PCR)克隆了斑点叉尾鮰IL-22基因CDS 区,通过实时荧光定量 PCR 技术(quantitative real-time PCR,qRT-PCR)检测其在各组织中的表达分布以及不同免疫刺激诱导和病原菌感染后的表达情况,旨在丰富硬骨鱼类IL-22研究内容。
1 材料与方法
1.1 材料与试剂
854 尾体质量为(200±20)g 的健康斑点叉尾鮰购自武汉白沙洲水产品大市场,于养殖箱中暂养1周,水温(25±1)℃,养殖用水充分曝气,每天清污换水,试验期间不投喂。鲁氏耶尔森氏菌(Yersinia ruckeri)和海豚链球菌(Streptococcus iniae)菌种均为西北农林科技大学王二龙副教授赠送;斑点叉尾鮰病毒(channel catfish virus,CCV)由华中农业大学袁军法副教授赠送;脑心浸出液培养基(BHI)购自上海生工生物工程有限公司。脂多糖(lipopolysaccharide,LPS),聚肌胞苷酸(polyinosinic-polycytidylic acid,Poly(I:C)),植物血球凝集素(phytohaemagglutinin,PHA)、佛波酯(phorbol ester,PMA)和溴氰菊酯均购自上海源叶生物科技有限公司。斑点叉尾鮰肾细胞(channel catfish kidney cells,CCK)由上海海洋大学国家水生动物病原库赠送。pMD19-T 和DH5α 购自TaKaRa 宝生物工程(大连)有限公司。TRIzol Reagent 购自 Invitrogen 公司,cDNA 反转录试剂盒及荧光定量(qRT-PCR)试剂盒均购自上海慧凌生物技术有限公司。
1.2 白介素-22 CDS区克隆
根据NCBI中斑点叉尾鮰白细胞介素-22的预测序列(NCBI 登录号为XM_017494747.1)设计特异性引物(表1)。以斑点叉尾鮰脾脏的cDNA 为模板,进行IL-22序列扩增。扩增条件为95 ℃预变性5 min,95 ℃ 30 s、60 ℃ 45 s、72 ℃ 80 s,35个循环,72 ℃延伸15 min。扩增产物通过1%的琼脂糖凝胶电泳验证片段大小,割胶回收,将胶回收产物与pMD19-T 载体(TaKaRa)连接,转入大肠杆菌DH5α中进行转化,涂平板,挑取阳性克隆培养10 h 后送武汉天一辉远生物公司进行测序。

表1 本研究所用引物Table 1 Primers used in this study
1.3 氨基酸序列分析
测序结果通过Nucleotide BLAST:Search nucleotide databases using a nucleotide query(nih.gov)进行序列Blast 比对,通过ORF Finder(Home -ORFfinder-NCBI(nih.gov))查找开放阅读框,采用ExPASy -ProtParam tool 预测氨基酸序列分子质量和等电点,蛋白质二级结构预测通过https://predictprotein.org/完成,多序列比对和美化通过DNAMAN和 GeneDoc 软件,用 http://130.88.97.239/cgi-bin/dbbrowser/fingerPRINTScan/FPScan_fam.cgi 查找所归属家族特征,通过MEGA 5.0 构建IL-22 的氨基酸序列N-J(neighbor-joining,NJ)系统发育树。
1.4 IL-22组织表达分布
用MS-222 麻醉斑点叉尾鮰后,无菌条件下取后肠、中肾、头肾、皮肤、肌肉、鳃、性腺、肝脏、脾脏和心脏10 个组织,迅速放于含1 mL TRIzol 溶液的无RNA酶EP管中,设置4个平行组,每组只包含1尾斑点叉尾鮰相应组织样品。随后将样品用组织匀浆仪于4 ℃破碎,以氯仿抽提法获取各组织总RNA,经1.0%琼脂糖凝胶电泳检测完整性,微量分光光度计进行纯度检测合格的RNA 样品,用反转录试剂盒将其反转成cDNA 后用于荧光定量PCR 实验。采用QuantStudioTMDesign & Analysis Software 3.0 实时荧光定量PCR 系统结合2×SYBR qPCR Mixture(HLINGENE)检测不同组织样品中IL-22的mRNA表达量。以斑点叉尾鮰EF-1α作为内参基因,每个样品进行3 个操作重复,引物见表1。实验体系10 μL 包括 5 μL 2× SYBR qPCR Mixture,4.5 μL cDNA 模板,0.25 μL 引物。PCR 程序:94 ℃ 2 min,94 ℃ 12 s,60 ℃ 15 s,72 ℃ 25 s,共 40 个循环。结果采用2-△△Ct法分析。
1.5 不同免疫刺激剂诱导CCK 细胞后IL-22 表达分析
取出液氮中冻存的CCK 细胞,放置37 ℃水浴锅中解冻90 s 后快速将细胞悬液转移至含有5 mL 10%FBS 和1%双抗的M199 培养基(25 cm2细胞培养瓶)中,在28 ℃恒温培养箱中静置培养,次日更换1次培养基,培养至细胞数为5×106/mL 时,消化。用培养基调节浓度至每孔细胞约106个,每孔2 mL,铺满6 孔板。待细胞贴壁稳定后,用LPS(50 μg/mL)、Poly(I:C)(50 μg/mL)、PHA(10 μg/mL)、PMA(0.5 μg/mL)分别刺激细胞,用同等剂量的PBS刺激CCK做对照,每个处理4个平行。每个取样时间点都设置相应对照组,分别于刺激后0、24 和48 h 收集细胞。弃去培养基,加入1 mL TRIzol 反复吹打裂解细胞后,快速保存于-80 ℃,RNA 提取方法、质量检测及表达量检测同本文材料与方法“1.4”。
1.6 细菌感染斑点叉尾鮰后IL-22表达分析
取出-80 ℃保存的鲁氏耶尔森氏菌菌种,待其解冻后取200 μL 放入脑心浸出液(BHI)培养基中,28 ℃震荡培养 18 h 后,3 000 r/min 离心 5 min,弃去培养液并用PBS 洗涤2 次。加入2 mL PBS 重悬细菌,以10-1为单位依次用PBS 稀释。经预实验最终选取稀释至10-3的菌液,终浓度为1.5×107CFU/mL,该浓度能导致斑点叉尾鮰感染且不致死。将180 尾规格一致且健康的斑点叉尾鮰随机分为2组(对照组和鲁氏耶尔森氏菌注射组)。实验组斑点叉尾鮰腹腔注射200 μL 鲁氏耶尔森氏菌(1.5×107CFU/mL),每个取样时间点对应的对照组均注射等剂量PBS。注射后6、12、24和48 h取样,每个时间点取样时实验组和对照组各取4个平行。MS-222将斑点叉尾鮰麻醉后分别取鳃、皮肤、后肠、脾脏、中肾和头肾组织,放于TRIzol溶液中,待组织充分破碎后,暂存于-80 ℃。RNA 提取方法、质量检测及表达量检测同本文“1.4”。海豚链球菌注射实验参照鲁氏耶尔森氏菌注射实验进行。
1.7 病毒感染斑点叉尾鮰后IL-22表达分析
斑点叉尾鮰肾细胞复苏、培养详见本文材料与方法“1.5”。显微镜下观察到6孔板中平铺单层对数生长期的CCK后,接种CCV。待其在28 ℃成功吸附2 h后,弃去未吸附病毒悬液,再用无菌PBS洗涤3次后,加入含5% FBS 的DMEM 培养基培养。显微镜下观察,待细胞培养瓶中90%细胞出现细胞病变(CPE)后收毒,置于-80 ℃保存备用。将194尾斑点叉尾鮰均分为2 组,实验组腹腔注射80 μL CCV,对照组注射等体积DMEM 处理。每个采样时间点对照组和实验组各取4 个平行。感染后1、3 和5 d 分别取鳃、皮肤、后肠、脾脏、中肾和头肾组织并放于TRIzol 溶液中,待组织充分破碎后,暂存于-80 ℃。RNA 提取方法、质量检测及表达量检测同本文“1.4”。
1.8 农药刺激斑点叉尾鮰后IL-22表达分析
将300 尾斑点叉尾鮰随机均分为3 组,对照组养殖用水为充分曝气自来水,试验组为溴氰菊酯浸泡低质量浓度组(0.5 μg/L)、高质量浓度组(5 μg/L)。浸泡期间时刻观察鱼体状态。取样时实验组和对应对照组随机选4 尾进行取样。取样前先用MS-222麻醉鱼体,剪刀无菌处理后剪断鳃弓放血处死,迅速取鳃、皮肤、后肠、脾脏、中肾和头肾组织。置于含1 mL TRIzol溶液的无菌无酶EP管中,4 ℃充分破碎后,-80 ℃暂存,RNA 提取方法、质量检测及表达量检测同本文“1.4”。
1.9 数据分析
数据均采用“平均值±标准误”表示。采用SPSS 25.0 对数据进行单因素分析以及t检验,采用Prism8.0 作图,P<0.05 表示数据显著相关,P<0.01表示数据具极显著相关性。
2 结果与分析
2.1 IL-22 CDS区克隆与多序列比对分析
对PCR 扩增产物进行测序,获得IL-22CDS 区534 bp,前18 个氨基酸残基为预测的信号肽(MNCAVLAVLVVLCCCCAL),编码 177 个氨基酸,分子质量20.07 ku,理论等电点7.06。该序列含有IL-10 家族的特征序列(NNTKAQNKAIGETDILF)(图1)。

图1 斑点叉尾鮰核苷酸及预测氨基酸序列Fig.1 Nucleotide and predicted amino acid sequence of channel catfish
斑点叉尾鮰IL-22和其他物种IL-22氨基酸多序列比对结果(图 2)显示,该序列含有 6 个α 螺旋,4 个保守的半胱氨酸残基,分别位于118、119、166 和215位。118 位和 166 位,119 位和 215 位分别形成 2 个二硫键。

图2 斑点叉尾鮰与其他物种IL-22氨基酸序列比对Fig.2 Multiple sequence alignments of I.punctatus with other known IL-22 amino acids sequences
2.2 序列相似性和进化分析
IL-22 氨基酸序列与硬骨鱼类、哺乳动物、飞禽和两栖类共14种脊椎动物的氨基酸序列比对结果显示具有一定的保守性。斑点叉尾鮰与黑鮰(Ameiurus melas)IL-22 氨基酸序列一致性高达95.48%;与条纹鲶(Pangasianodon hypophthalmus)一致性为88.7%,与巨魾(Bagarius yarrelli)一致性为85.88%。系统发育树显示,硬骨鱼类的IL-22 各自聚为一支;飞禽、哺乳类、两栖类各聚为一支(图3);其中斑点叉尾鮰IL-22 与条纹鲶和黑鮰亲缘关系最近。如图4所示,从进化结果看,IL-22 位于 IL-26 和 MDM1 之间,并与IFN-γ 共线。整体分析看来,从哺乳动物人(Homo sapiens)、禽类鸡(Gallus gallus)、两栖类中华鳖(Pelodiscus sinensis),一直到脊椎动物斑马鱼、斑点叉尾鮰,序列相似性和进化分析充分体现了不同物种的IL-22基因在进化过程中的保守性。

图3 IL-22氨基酸系统进化树(NJ)Fig.3 The phylogenetic trees of IL-22 amino acids sequences(Neighbor-joining)
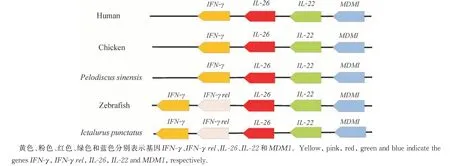
图4 基因同线性Fig.4 Genetic synteny
2.3 IL-22 的组织分布表达分析
qRT-PCR 检测IL-22在斑点叉尾鮰各个组织中表达量的结果显示,IL-22广泛分布于后肠、中肾、皮肤、头肾、肌肉、鳃、性腺、肝脏、脾脏和心脏中。其中后肠中IL-22表达量最高,其次是中肾,脾脏和心脏中表达量较低(图5)。

图5 斑点叉尾鮰IL-22的组织分布Fig.5 The distribution of IL-22 mRNA in I.punctatus
2.4 不同诱导模式下IL-22的表达状况
1)IL-22在 CCK 中的表达。如图6 所示,Poly(I:C)和LPS 刺激斑点叉尾鮰肾细胞后24~48 hIL-22持续上调,LPS刺激后IL-22mRNA 表达量呈逐渐上升趋势。斑点叉尾鮰肾细胞在PHA 和PMA 刺激下24~48 h表达量持续下调,显著低于正常表达水平。
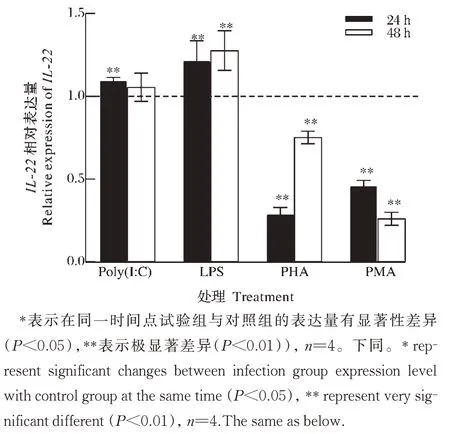
图6 不同诱导下IL-22在CCK中相对表达图谱Fig.6 The relative expression profile of IL-22 in CCK under different induction
2)微生物胁迫下IL-22的表达变化。(1)鲁氏耶尔森氏菌感染鱼体后IL-22的表达变化。随着感染时间的变化,鲁氏耶尔森氏菌感染斑点叉尾鮰后6~48 h内在鳃、皮肤、后肠、脾脏、中肾和头肾组织中IL-22mRNA 表达量整体呈上调状态,鳃中IL-22表达量下调。鳃中表达量于24 h 达峰值,随后下降。后肠中IL-22整体呈升高趋势,48 h 检测到表达量最高。脾脏表现为急性期6 h 瞬时上调应答,但整体呈下降趋势。中肾和头肾中IL-22整体呈上调变化,12 h达峰值(图7 A(e)和(f))。
(2)海豚链球菌感染鱼体后IL-22的表达变化。海豚链球菌感染斑点叉尾鮰48 h 内IL-22动态表达谱如图7B 所示。皮肤、后肠、脾脏和头肾中IL-22表达量均于48 h 达最高值,整体呈持续上升。感染后24 h,中肾中表达量最高,整体呈先升高后下降趋势。6~48 h内鳃中IL-22表达量下调。
(3)CCV 感染鱼体后IL-22的表达变化。对斑点叉尾鮰进行攻毒后第1 天,鳃、脾脏和头肾中IL-22mRNA 表达量均达到峰值,且表现为逐渐下降,1~3 d 持续性上调变化。CCV 感染后,后肠中IL-22表达量变化趋势先下降后上升,第5 天表达量最高。中肾中IL-22表达量第1 天上调后,随攻毒时间发展(3~5 d)均下调(图7 C(e))。
(4)溴氰菊酯浸泡鱼体后IL-22的表达变化。如图7 D 所示,溴氰菊酯浸泡后斑点叉尾鮰鳃中持续下调反应,皮肤、后肠、中肾和头肾均表现为低浓度IL-22mRNA 表达量上升,高浓度下降,持续上调应答。脾脏则表现为逐渐上调变化,高浓度刺激后表达量为对照组2.2倍。
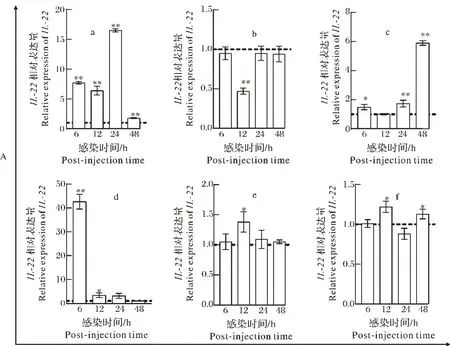

图7 不同刺激下IL-22在鱼体中mRNA表达分析Fig.7 The mRNA expression analysis of IL-22 in channel fish under different stimulate
3 讨 论
IL-22 作为IL-10 家族的一员,在免疫反应中常发挥重要作用。qRT-PCR结果显示,IL-22基因在斑点叉尾鮰多种组织中均有表达。这种表达模式存在物种间宿主差异。在草鱼中,IL-22 主要分布于鳃和后肠[13];在黄颡鱼鳍条、鳃和皮肤黏液中表达较高[11];而鳜中鳃、幽门盲囊分布较多[14]。虹鳟中肠道表达量最高,其次是尾鳍、鳃和性腺[9]。本研究显示IL-22主要分布在斑点叉尾鮰的后肠和中肾,心脏中最少。这些结果表明IL-22 主要表达于黏膜免疫组织或一些系统性免疫器官中。
IL-22 的有效诱导通常体现在细菌、病毒以及一些外源诱导下鱼的黏膜组织和相关免疫器官中IL-22mRNA 表达水平的上调[11,14-15]。这与本试验中鲁氏耶尔森氏菌和海豚链球菌、CCV 感染斑点叉尾鮰以及溴氰菊酯浸泡斑点叉尾鮰后IL-22mRNA 表达量上调一致,不同的是海豚链球菌和CCV 感染后鳃和皮肤中呈现下调,究其原因可能是免疫细胞迁移的结果。鲁氏尔森氏菌感染后斑点叉尾鮰脾脏6 h响应最激烈,随后是鳃24 h,后肠48 h。符合其致病机制中早期阶段先通过鳃和胃肠道上皮细胞侵入,随后经血液循环,加速病原扩散,进一步感染免疫器官,最后全面攻击免疫系统的规律[16]。海豚链球菌攻击斑点叉尾鮰后,皮肤、后肠、脾脏和头肾IL-22mRNA 表达量于48 h 达到峰值,随后恢复正常水平。中肾于24 h 达到峰值后下降。类似的结果出现在无乳链球菌(Streptococcus dysgalactiae)刺激鮻鱼(Liza haematocheila)后,其肾脏、脾脏和肠中IL-22均上调约5 倍[17]。从某种角度反映出革兰阳性菌刺激宿主后短时间内细菌持续复制,机体强烈的反应导致IL-22分泌量大幅上调。这可能与海豚链球菌粘附侵入、破坏上皮细胞后经巨噬细胞内化快速传播至整个鱼体有关[18]。斑点叉尾鮰发病后期体表大面积弥漫性出血,内脏明显肿胀,推测IL-22分泌量与组织的健康状况呈正相关,一定程度上IL-22 可成为健康状态的评判指标。低浓度溴氰菊酯浸泡斑点叉尾鮰后大部分组织IL-22呈现高表达,高浓度下则相反。当斑点叉尾鮰暴露于合适浓度溴氰菊酯下时,游离氨基酸上升促进了应答时能量的供应[19-20],故也很可能对免疫系统产生激活作用。此外,鳃中表达量的下调可能是免疫细胞特别是黏膜组织的损伤,抑制表达的结果。研究表明溴氰菊酯能导致鱼鳃上皮细胞的病变[21-22],溴氰菊酯作为一种杀虫剂主要攻击机体的呼吸系统,鳃中IL-22下调极可能是由此引发。
受 Poly(I:C)和 LPS 刺 激 后 CCK 中IL-22mRNA 表达量均呈现上升趋势,能促使非特异性免疫得到一定程度的刺激[23]。已证实PHA和100 ng/mL PMA刺激大菱鲆头肾细胞、虹鳟脾细胞3~24 h持续高表达[9-10],而本研究中 0.5 μg/mL PMA 作用于斑点叉尾鮰肾细胞后表达下调。PMA 和PHA 都是T细胞诱导剂,同时PMA 也可作为细胞内信号通路的刺激因子,刺激相关细胞因子间接促进IL-22的表达[10]。本研究中24~48 h 内PHA 和PMA 刺激斑点叉尾鮰肾细胞后IL-22均显示下调反应,这可能是观察时间不同所造成的。此外不同浓度的PMA 对于细胞本身的诱导程度也有区别。
斑点叉尾鮰在不同诱导模式下,肠道、脾脏、中肾和头肾中IL-22均上调表达。此外,由于本试验中细菌和病毒是腹腔注射的,此感染模式下可能存在部分黏膜组织应答的延迟,亦导致鳃和皮肤不同刺激下IL-22表达的不稳定。从免疫学的角度上看,T淋巴细胞和B 淋巴细胞存在于鱼的肠道中[24],肠道可能是病原体的入口[25],通过白细胞浸润促使IL-22的分泌,从而抑制肠道炎症[26-27]。免疫器官脾脏、中肾和头肾在细菌和病毒入侵后刺激免疫细胞迁移,调节免疫应答。
综上,本试验获得的斑点叉尾鮰IL-22 氨基酸序列在进化上高度保守,IL-22在斑点叉尾鮰各检测组织中均表达并且能够参与不同诱导下鳃、皮肤、后肠、脾脏、中肾和头肾组织以及CCK 中的免疫响应,不同诱导下不同组织中表达模式存在差异,推测斑点叉尾鮰IL-22基因参与抗病原免疫反应。
