mlnB基因敲除对解淀粉芽孢杆菌W1杀螨活性的影响
2022-06-06黄莎莎何鹏飞何月秋李兴玉吴毅歆
黄莎莎,何鹏飞,何月秋,李兴玉,吴毅歆
( 1.云南农业大学农学与生物技术学院,昆明 650201;2.云南农业大学植物保护学院,昆明 650201;3.云南农业大学基础与信息工程学院,昆明 650201)
【研究意义】解淀粉芽孢杆菌W1是实验室从一种自然死亡的二斑叶螨中分离出来的,具有很强的导致二斑叶螨死亡的能力。通过研究可为二斑叶螨的防治提供一种新的微生物资源和防治策略,为后续开发利用更多微生物资源奠定基础,也为新型微生物杀螨剂的研发与应用提供理论基础。【前人研究进展】二斑叶螨是一种分布于世界各温带、亚热带地区的害螨。寄主植物种类广泛,共有140多个科1100余种[1],严重为害蔬菜、花卉、果树和温室栽培等经济作物。该螨以刺吸式口器吸取植物的汁液,幼螨、若螨和成螨均能危害寄主的叶片、芽和嫩茎[2]。因其具有个体小、世代短、繁殖快、寄主广、适应性强及易产生抗药性等特点,极易爆发成灾,对农业生产造成极大的影响[3]。因此,二斑叶螨防治成为农作物虫害亟待解决的重要问题之一。目前常用的防治手段包括农业防治、化学防治和生物防治,但农业防治周期长、可控性小,而化学防治虽见效快,但可持续利用性低、易产生抗药性且对环境污染大等缺点,生物防治具有不易产生抗性、对环境安全等优点,越来越受到广泛的关注。生物防治中主要是利用捕食螨且均已不同程度商品化利用[4]。而微生物中具有杀螨效果的主要群体是真菌,有研究报道新接霉属的一些种在很多作物上寄生于叶螨[5-7]。豹斑毒鹅膏菌、褐鳞环柄菇、被毛孢属以及顶孢霉属等对二斑叶螨具有致病性[8-10]。而关于细菌有杀螨活性的报道少,目前研究最多的是苏云金芽孢杆菌(BacillusthuringiensisBerliner,简称Bt)和内共生菌Wolbachia。研究发现,Bt除了对鳞翅目昆虫有高效杀虫活性外[11],对朱砂叶螨的幼螨、若螨、成螨具有毒杀作用,对幼螨的毒杀作用效果最好,其次生代谢产物苏云金素对二斑叶螨幼螨的毒杀作用高效且无选择性[12-14]。Macrolactins是一类具有抗菌活性的新型大环内酯类化合物,由深海细菌、放线菌属和芽孢杆菌属代谢产生。目前,对macrolactins类物质研究最多的是大环内酯A,它最早是由Gustafson等[15]从一些未分类的深海细菌的代谢产物中发现。研究表明,大环内酯A具有选择性的抗菌活性,除此之外还能够抑制B16-F10小鼠黑色素瘤癌细胞的生长以及哺乳动物单纯性疱疹病毒的增殖,也能通过抑制艾滋病病毒的复制以此来保护淋巴细胞[15]。Lee等[16]于2003年从土壤中分离鉴定出一株解淀粉芽孢杆菌 CHO104,并从其代谢产物中发现大环内酯A,对Staphylococcusaureus、Eescherichiacoli、Botrytiscinerea等有很强的抑制作用。但对其具有杀虫活性的报道少见。【本研究切入点】对解淀粉芽孢杆菌W1的次级代谢产物的活性化合物进行研究,已确定其对红蜘蛛的杀虫活性物质为二酮哌嗪类,大环内酯类及巨杆菌素类等化合物[17]。大环内酯类化合物中以大环内酯A为主要杀螨活性物质,而大环内酯A是由mln基因簇调控合成,通过基因敲除技术构建mlnB基因缺陷突变体,研究其对杀螨抑菌活性的影响。【拟解决的关键问题】通过同源重组构建大环内酯生物合成缺陷突变体并利用PCR和HPLC-MS/MS技术验证,检测其杀螨抑菌活性,为解淀粉芽孢杆菌W1杀螨活性的机制提供理论基础。
1 材料与方法
1.1 细菌菌株、质粒及培养条件
大肠杆菌TG1、解淀粉芽孢杆菌以及供试植物病原细菌(大白菜软腐病菌、柑橘溃疡病菌、大白菜黑腐病菌及茄科青枯病菌)均使用LB固体或液体培养基培养。除供试植物病原真菌的培养温度为30 ℃外,大肠杆菌和解淀粉芽孢杆菌均置于37 ℃培养;液体振摇培养的转速为160 r/min。所使用的抗生素种类及终浓度分别如下:氨苄青霉素100 μg/mL(大肠杆菌)、氯霉素10 μg/mL(解淀粉芽孢杆菌)及卡那霉素30 μg/mL(解淀粉芽孢杆菌)。
二斑叶螨饲养于实验室温室的玉米(会单4号)幼苗植株上。阿维菌素由安徽久易农业股份有限公司生产。
1.2 敲除载体pBS-mlnB-kanR的构建
研究所用的引物见表1。为获取解淀粉芽孢杆菌W1的大环内酯合成缺陷突变体,以大环内酯生物合成基因簇mln中的基因成员mlnB为敲除对象,构建对应的敲除质粒。
构建的基本流程如下:首先使用引物mlnB-F/mlnB-R扩增出解淀粉芽孢杆菌W1菌株体内mlnB部分序列(此片段中央处含有单个Hind III切点);利用胶回收纯化试剂盒回收靶标条带,BamHI/XhoI双切,随后将之克隆到被相同酶组合消化的pBS(即pBluescript)质粒内部,即生成中间载体pBS-mlnB;Hind III单切pMD18-kanR,胶回收含有卡那霉素抗性基因的条带,然后插入到Hind III单切且去磷酸化的pBS-mlnB,即获得最终的敲除载体pBS-mlnB-kanR。
1.3 解淀粉芽孢杆菌W1-comK的诱导转化
参照前人采用的方法[18],以IPTG为诱导物,诱导解淀粉芽孢杆菌W1-comK(胞内含有pHT01-comK[17]的W1菌株)形成自然感受态,完成pBS-mlnB-kanR向解淀粉芽孢杆菌W1-comK自然感受态细胞的转化。37 ℃培养16~24 h后,在含有卡那霉素的LB琼脂平板上挑选转化子。
采用水煮冻融法快速提取转化子的基因组DNA,以DNA为模板,使用表1中的引物PCR扩增。琼脂糖凝胶电泳检测条带的有无以及长度是否符合预期,并送交PCR产物给昆明擎科生物技术公司测序。分析测序结果以确认卡那霉素抗性基因是否被整合插入到转化子mlnB基因内部。将正确的重组子转接到含有卡那霉素的LB液体培养基内,37 ℃振摇过夜。次日,加入等体积无菌40%(v/v)甘油,均匀混合后,-80 ℃冰箱保存。
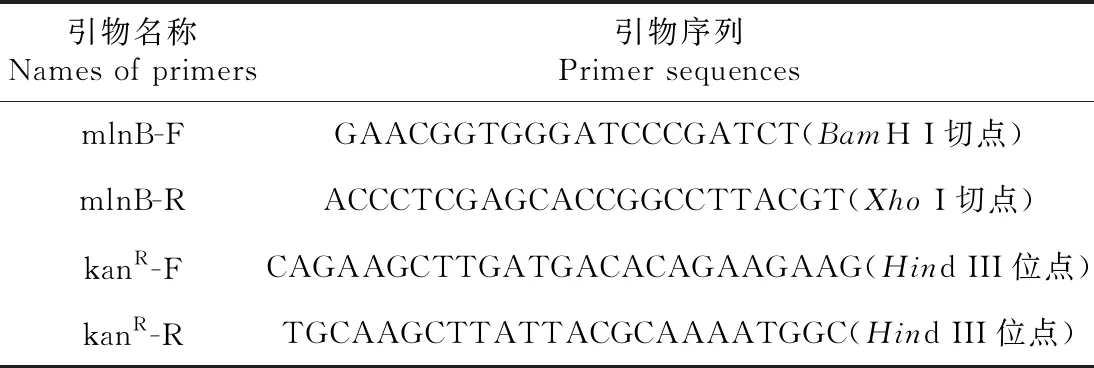
表1 研究所使用的引物
1.4 解淀粉芽孢杆菌W1菌株大环内酯合成缺陷突变体的HPLC-MS/MS验证
1.4.1 样品前处理 从-80 ℃冰箱中取出所保存的解淀粉芽孢杆菌W1大环内酯合成缺陷突变体甘油菌,待其呈熔融状态,使用无菌接种环蘸取少许甘油菌液体,划线于含有卡那霉素的LB琼脂平板。37 ℃过夜培养后,挑取单菌落,接种到试管内装有5 mL含卡那霉素的液体LB培养基内,37 ℃振摇培养过夜。然后,按1∶100的接种比例转接入装有50 mL含卡那霉素的液体LB培养基的250 mL三角瓶,37 ℃振摇培养。72 h后,12 000 r/min室温离心2 min,收集上清液。使用等体积的乙酸乙酯萃取3次,合并萃取液,旋转蒸发仪浓缩后称重。使用甲醇溶解乙酸乙酯萃取出的蒸干产物,随后用0.22 μm孔径的纤维素微孔滤膜过滤,获得无菌的萃取物甲醇饱和液,贴好标签即可上样。野生型W1也是同样的操作,只是培养基中无需加入抗生素。
1.4.2 色谱条件 色谱柱使用UltimateAQ-C18柱,流动相为甲醇/水(含甲酸),梯度洗脱条件及操作
见表2,流速控制为1 min/mL。柱温40 ℃,检测波长为254 nm,进样量10 μL。

表2 梯度洗脱程序
1.4.3 质谱条件 离子化模式:ESI 离子源;扫描方式:正、负离子扫描;检测器电压:1.70 kV;CDL温度:200 ℃;加热模块温度:200 ℃;雾化气:氮气,1.5 L/min;干燥气:氮气,1.5 L/min;碰撞气:氩气;采集范围:一级和二级质谱均为m/z 100-1500。
1.5 W1 大环内酯合成缺陷突变体对植物病原细菌的拮抗活性
分别在LB琼脂平板内划线培养出解淀粉芽孢杆菌W1野生型及其大环内酯合成缺陷突变体、白菜软腐病菌、柑橘溃疡病菌、大白菜黑腐病菌和茄科青枯病菌的单菌落。挑取各菌株的单菌落,转接至LB液体培养基内振摇培养。36 h后,利用10倍稀释法测定芽孢杆菌和供试植物病原细菌培养物的菌体细胞浓度,将芽孢杆菌和植物病原细菌的浓度分别调整为106和107CFU/mL。取病原菌菌液(107CFU/mL)200 μL均匀涂布于LB固体培养平板(9.0 cm),超净台吹干平板表面水分;使用移液枪吸取上述芽孢杆菌菌液(106CFU/mL)各2.0 μL,分别滴加至表面涂有植物病原细菌的固体平板上(4点/皿)。30 ℃恒温培养数天不等,观察芽孢杆菌菌落生长情况及其周围有无抑菌圈。
1.6 W1大环内酯合成缺陷突变体的杀螨活性
解淀粉芽孢杆菌W1菌株大环内酯合成缺陷突变体对二斑叶螨的毒杀活性采用玻片浸渍法[19]进行,具体细节略有改动,主要是将其中的载玻片替换成毛细管。选取行动活泼、大小一致的成螨个体,毛细管黏附成螨背部(20头活螨/根)。将上述毛细管浸于W1野生型或其突变体培养物(108CFU/mL)内5 s,取出并使用滤纸吸干残留菌液。定时用毛笔轻触螨体观察其反应,统计各处理组的成螨死亡情况。以对照组死亡率小于5%为有效试验[20],按下式计算出各组的校正死亡率。
死亡率(%)=死亡虫数(头)/处理总虫数(头)×100
校正死亡率(%)=(处理死亡率-对照死亡率)/(1-对照死亡率)×100
以阿维菌素(3000倍液)和稀释相同倍数的无菌液体LB培养基分别为正、负对照,每个处理设有3次重复。独立重复此试验至少3次。
2 结果与分析
2.1 敲除载体pBS-mlnB-kanR 的构建
通过0.8%(w/v)琼脂糖凝胶电泳检测引物对mlnB-F/R的PCR扩增产物,可见在与250 bp I型 DNA Marker(上海捷瑞)中的2.0 kb条带水平位置处下方有清晰的单一亮带(图1-A),表明含有部分mlnB编码基因的片段(1584 bp)被成功地从W1菌株中扩增出来。菌落PCR检测结果还显示,mlnB片段已插入到pBS内部(图1-B)。mlnB-F/R的菌液PCR产物检测显示,卡那霉素抗性基因顺利地克隆到中间载体pBS-mlnB(图1-C),获得最终的敲除载体pBS-mlnB-kanR。最终载体pBS-mlnB-kanR的Hind III单切产物电泳带型(图1-D)也表明,kanR已插入到中间载体pBS-mlnB内部。
A:mlnB的PCR扩增(CK扩增模板为ddH2O);B:携带pBS-mlnB的大肠杆菌转化子菌液PCR(1~8道扩增模板为转化子,CK和W1分别为负和正对照);C:携带pBS-mlnB-kanR的大肠杆菌转化子菌液PCR(1~6道扩增模板为转化子,CK和W1分别为负和正对照);D:Hind III分别切pBS-mlnB和pBS-mlnB-kanR的电泳检测(1道为pBS-mlnB,2道为和pBS-mlnB-kanR);M:DNA marker;箭头:本实验最终选择的携带pBS-mlnB和pBS-mlnB-kanR的大肠杆菌阳性转化子
2.2 解淀粉芽孢杆菌W1大环内酯合成缺陷突变体的构建
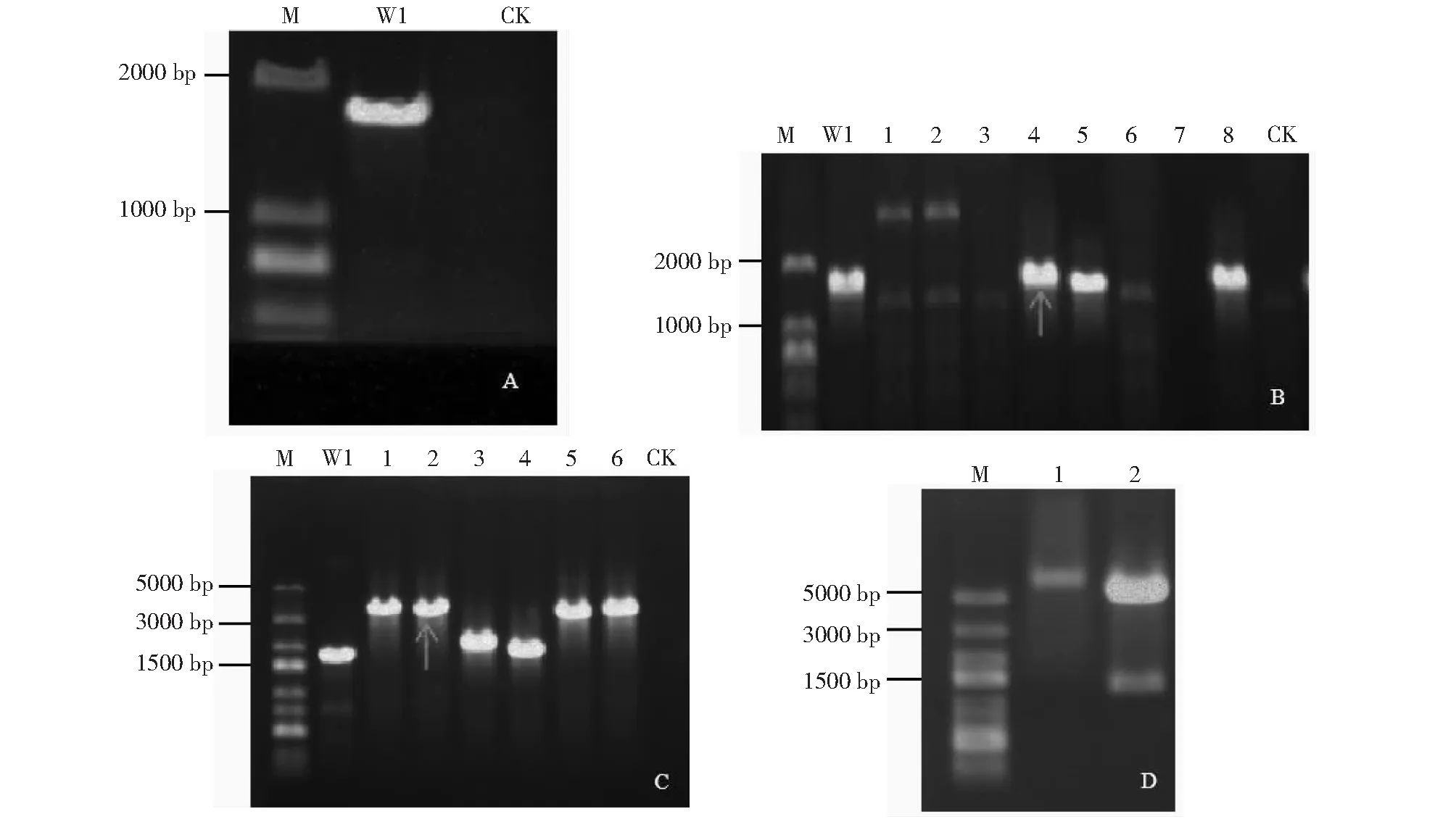
通过IPTG人工诱导W1-comK菌株形成自然感受态及随后转化导入整合型敲除载体pBS-mlnB-kanR等操作,在含有卡那霉素的LB平板发现有多个转化子菌落。从中随机挑取13个抗性转化子,通过特异性引物PCR扩增检测,发现从大部分转化子的基因组DNA中均能扩增到与kanR大小相近的条带(1.1 kb,图2-A),PCR产物的测序分析显示其序列与金黄色葡萄球菌pUB110质粒内部卡那霉素抗性基因一致性达95.6%(数据未显示)。使用最外围引物mlnB-F/R从突变体中扩增出的产物电泳位置明显高于以W1野生型基因组DNA为模板所扩增的,与阳性对照(敲除载体pBS-mlnB-kanR为扩增模板)的相接近(图2-B),表明卡那霉素抗性基因的确被成功地整合插入到解淀粉芽孢杆菌W1菌株的mlnB基因内部。故将此大环内酯合成突变体命名为解淀粉芽孢杆菌W1-comK △mlnB::kanR。

A:mlnB-F/R的PCR扩增检测(1~12道扩增模板为W1 ΔmlnB::kanR转化子;13道扩增模板为质粒pBS-mlnB-kanR为阳性对照:W1作为阴性对照,CK为空白对照);B:卡那霉素抗性基因表达盒的PCR扩增检测(2~13道扩增模板为W1 ΔmlnB:kanR转化子;1道扩增模板为质粒pMD18-kanR作为阳性对照,W1作为阴性对照,CK为空白对照);M:DNA marker;箭头:本实验最终选择的携带pBS-mlnB-kanR的解淀粉芽孢杆菌阳性转化子
2.3 解淀粉芽孢杆菌W1-comK ΔmlnB::kanR发酵上清的HPLC-MS/MS质谱分析
从pubchem网站上查到化合物大环内酯A的相对分子量(Mr)为402.241 Da。图3-A为野生型W1在47.288 min时的一级质谱图,正离子模式下,该化合物的[Mr+Na]+和[Mr+K]+的离子峰分别为425.224和441.251 Da,可断定其分子量为402 Da,与pubchem网站上查询结果一致,推测此化合物为大环内酯A。根据其二级质谱图(图3-C)可推测其断裂方式如图3-B所示。相同时间点,将解淀粉芽孢杆菌W1大环内酯合成突变体发酵上清的HPLC/MS结果与其野生型相对比(图4-A),虽然大环内酯合成突变体在一级质谱中也有此两类信号,但与W1野生型相对应的信号峰在二级质谱图中没有再出现(图4-B),表明突变体因大环内酯合成基因簇成员基因mlnB被插入破坏而不再合成大环内酯A。
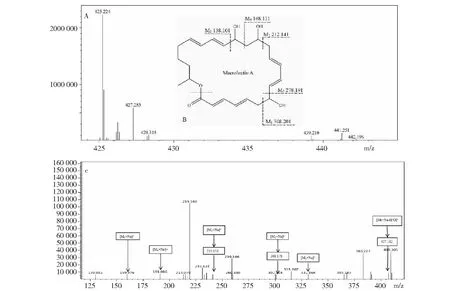
A:以正离子模式检测大环内酯A的一级质谱;B:推测大环内酯A的二级质谱的断裂方式;C:以正离子模式检测大环内酯A的二级质谱
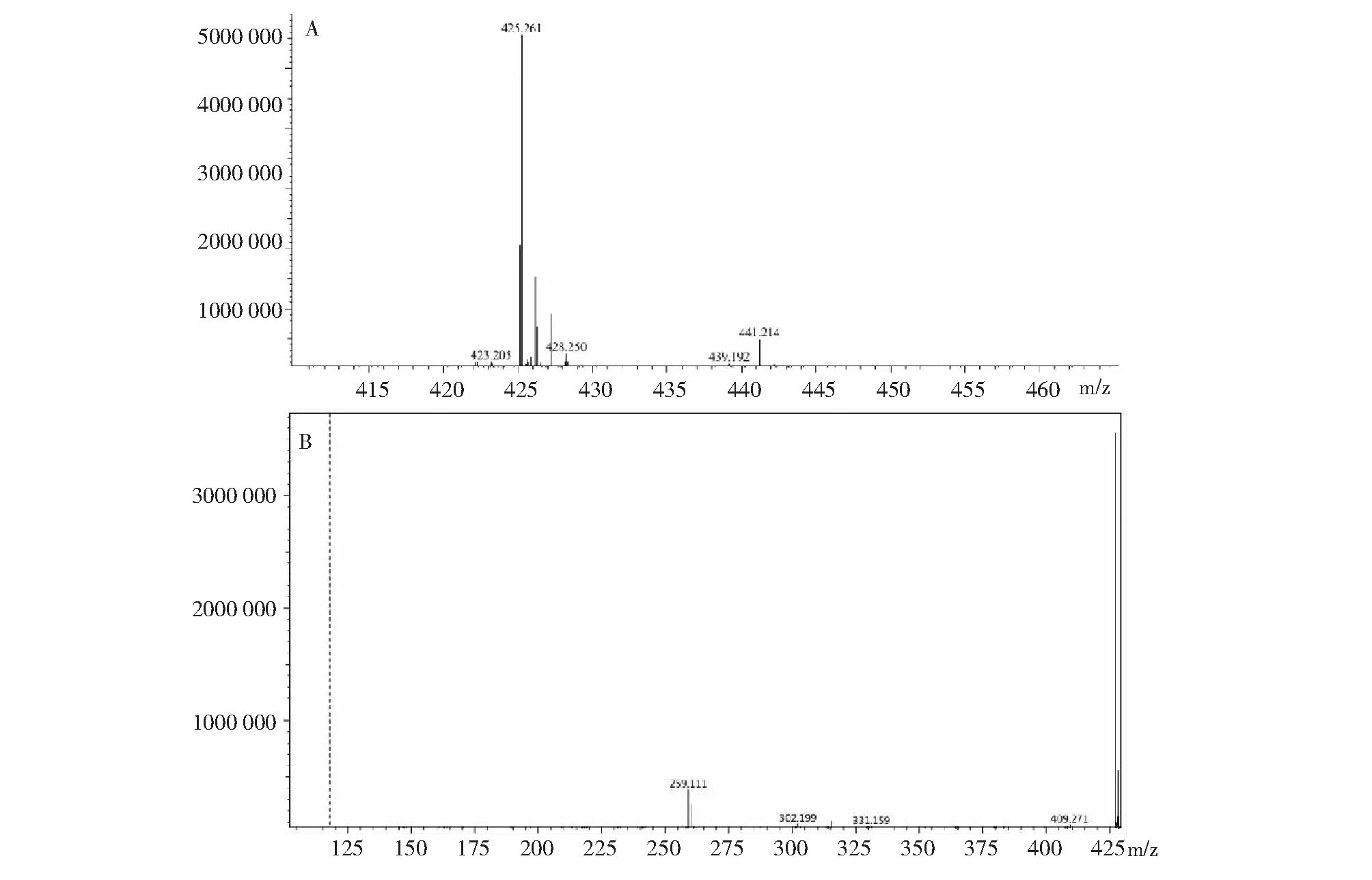
A:以正离子模式检测大环内酯A的一级质谱;B:以正离子模式检测大环内酯A的二级质谱
2.4 大环内酯合成缺陷对解淀粉芽孢杆菌W1-comK ΔmlnB::kanR病原拮抗活性的影响
如图5所示,在解淀粉芽孢杆菌W1野生型及其大环内酯合成缺陷突变体的菌落周围并没有看到肉眼可见的透明抑菌圈,但明显可见W1野生型菌落,而突变体菌落色泽较淡,与供试植物病原细菌的界限不清晰,显示野生型菌株在表面长满有供试植物病原细菌的LB琼脂平板中仍有一定的竞争优势,但大环内酯合成缺陷削弱了突变体在上述平板对柑橘溃疡病菌、大白菜黑腐病菌及茄科青枯病菌的拮抗活性。
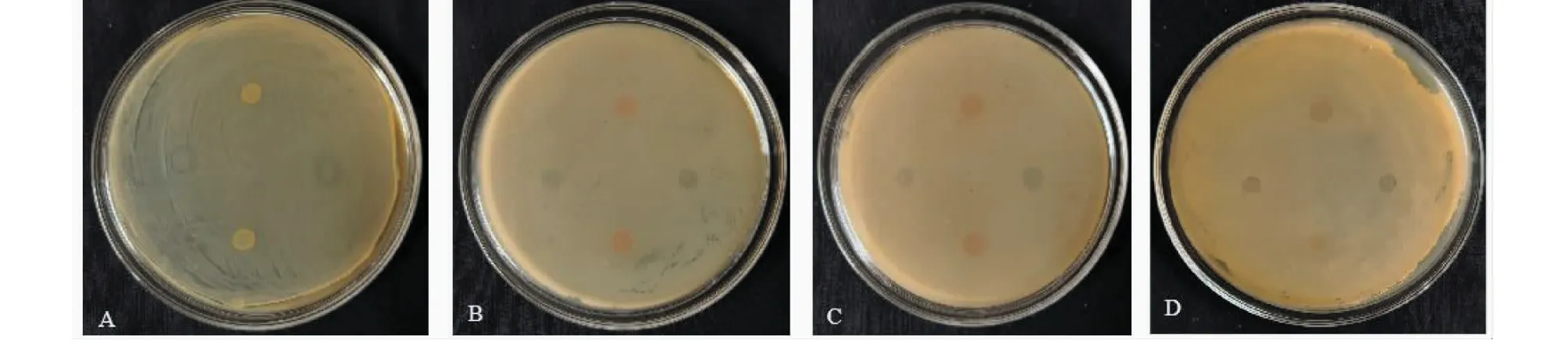
A:白菜软腐病菌;B:柑橘溃疡病菌;C:大白菜黑腐病菌;D:茄科青枯菌;垂直方向上点样菌落均为野生型W1,水平方向上点样菌落均为缺失突变体W1 ΔmlnB::kanR
2.5 大环内酯合成缺陷对解淀粉芽孢杆菌W1-comK ΔmlnB::kanR杀螨活性的影响
在4个处理组中,浸蘸阿维菌素的处理组二斑叶螨的死亡率最高(91.67%~93.33%),W1野生型菌株次之(73.33%~77.22%),而大环内酯合成缺陷突变体的杀螨活性(26.67%)仅高于液体LB(3.89%~4.44%),显著低于野生型(图6)。定时检测结果显示在W1野生型、阿维菌素和液体LB对照组3个处理组中,成螨死亡率6 h后的均略高于30 min的,而突变体却并未表现这一点。
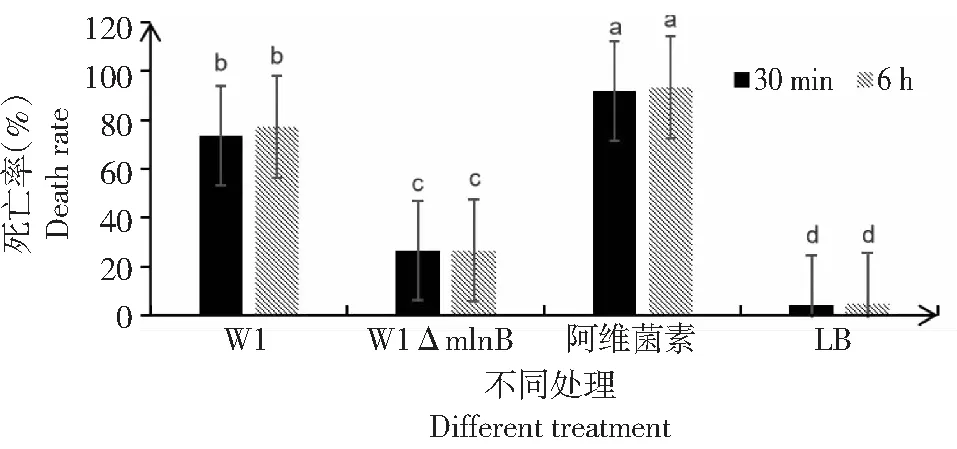
图6 野生型W1与缺失突变体W1 ΔmlnB::kanR杀螨活性测定
3 讨 论
解淀粉芽孢杆菌是一种被广泛研究的微生物,其基因组中有至少4%~5%的基因信息与抗生素的合成相关,大约能够合成二十几种拮抗物质[21]。在这些拮抗物质中,surfactin和iturinA家族是研究和发现最多的,不同家族的脂肽可以让芽孢杆菌在各种生境与其他微生物的竞争中保持优势[22]。除了在制酶等工业领域有广泛应用外,解淀粉芽孢杆菌还是一类重要的植物生防资源,表现出良好的植物促生、抗逆以及病虫害防控特性[23-25]。解淀粉芽孢杆菌AG1菌株合成表面活性物质被证实可破坏番茄斑潜蝇幼虫中肠上皮细胞的完整性,从而具有杀虫活性[25]。前期研究发现,解淀粉芽孢杆菌W1菌株毒杀二斑叶螨的活性物质较为多样,其中大环内酯(Macrolactin)在其中扮演着重要角色[17]。不同于合成大环内酯A、7-O-丙二酰大环内酯A及7-O-琥珀酰大环内酯A的解淀粉芽孢杆菌NJN-6[26]及合成大环内酯A、大环内酯D、7-O-丙二酰大环内酯A及7-O-琥珀酰大环内酯A的解淀粉芽孢杆菌FZB42[27],通过研究W1菌株发酵上清液中目前只检测到合成了其中的大环内酯A,与另一株近缘海洋细菌——解淀粉芽孢杆菌ESB-2相类似[28],表明大环内酯合成及后续加工修饰可能会因菌株种类不同而有所差异。
研究发现相比于野生型,mlnB发生突变的W1菌株对白菜软腐病菌、柑橘溃疡病菌、大白菜黑腐病菌以及茄科青枯病菌的抑制活性均下降,但两者均未看到常见的透明抑菌圈,仅能通过自身菌落生长来判断,这可能与植物病原细菌和生防芽孢杆菌的数量比例不理想等原因有关。需更有力的数据来支持W1大环内酯合成缺陷突变体对植物病原细菌的拮抗活性出现削弱迹象。但拮抗活性试验结果仍说明解淀粉芽孢杆菌W1合成的大环内酯A具有抑制植物病原细菌的活性,与前人报道也相一致[29]。W1菌株作为二斑叶螨生防菌株被应用,实验结果表明了其在防治细菌性病害方面的潜力。
杀螨活性研究则显示大环内酯A不再合成后,W1-comK ΔmlnB::kanR的杀螨能力下降明显,再次证实大环内酯A是解淀粉芽孢杆菌W1菌株杀螨的活性物质。浸润W1野生型发酵液后6 h的成螨死亡率比30 min的成螨死亡率略有增加,而大环内酯突变体却未表现出这一点,表明W1菌株对二斑叶螨的杀灭活性有一定的持效期。此特点是否与W1野生型菌株及其大环内酯突变体在害螨体内定殖能力差异有关,尚待研究。
4 结 论
解淀粉芽孢杆菌W1菌株合成的大环内酯A具有杀二斑叶螨活性,同时还能抑制大白菜软腐病菌、柑橘溃疡病菌、大白菜黑腐病菌以及茄科青枯病菌。大环内酯A合成受阻后,W1菌株的活性均明显地被削弱。
