基于LAMP 技术的弧菌快速检测方法的建立
2022-06-06张芳芳
张芳芳
(福建省闽东水产研究所,福建 宁德 352100)
弧菌(Vibrio)是一种菌体短小、弯曲成弧形、尾部带一鞭毛的革兰氏阴性细菌,也是一类兼具遗传多样性与生态多样性的兼性厌氧细菌,广泛分布于近岸海域及海洋环境中,是海水及养殖生物的主要致病菌之一[1]。海洋弧菌可引起海洋经济动物的大规模感染和死亡,给养殖业造成巨大的经济损失。如哈维弧菌(V.harveyi)可以引起海水养殖生物,包括琥珀鱼、大菱鲆、暗纹东方鲀、斜带石斑鱼、鲍鱼、对虾和大黄鱼等的全球性疾病[2];溶藻弧菌(V.alginolyticus)能够使大菱鲆、大黄鱼、石斑鱼等致病,还可引起珊瑚白化病[3]。此外,海洋弧菌还可能对人类的健康产生危害,例如:副溶血弧菌(V.parahemolyticus)可感染贝类、甲壳类、鱼类等,人类如果食用腌制或未完全煮熟的带病菌海鲜,容易引起严重的肠胃炎[4];人体皮肤损伤后接触到带有创伤弧菌(V.vulnificus)的海水或者海产品,会发生感染,病情严重的会导致败血症、器官衰竭等[5]。因此,弧菌的快速检测和监控对于海洋养殖和人类健康的安全有着重要的意义。
传统的弧菌检测方法主要包括选择性培养基、生化和血清学检测、组织切片观察法、超薄切片电镜观察法[6]。近年来,弧菌的分子生物学检测技术也有较大进展,包括分子杂交法、DGGE 法、TGGE 法、RFLP 法[7]、高通量液相芯片法[8]、多重PCR 检测、微阵列技术[9]等,然而这些技术普遍存在成本高、耗时耗力、依赖专业人员和专业检测设备等缺点,不适合在养殖场及鱼排上推广。而环介导等温扩增(loopmediated isothermal amplification,LAMP)技术是一种新的病原核酸检测技术,该技术凭借高效简便、灵敏度高、成本低等优势在病原检测领域广泛应用,并取得了较好的效果[10]。相关研究显示,LAMP 技术已在副溶血性弧菌、霍乱弧菌、创伤弧菌、哈维氏弧菌和溶藻弧菌等的检测上应用[5,11-16],但现有LAMP 技术大部分都只针对单一的弧菌检测,该研究针对上述问题,根据弧菌属保守基因序列设计引物,并对LAMP反应条件进行筛选优化,建立了可检测多种致病性弧菌的LAMP 快速检测方法。最后利用水样和不同菌株进行方法特异性和灵敏度分析,旨在为弧菌快速检测及早期诊断提供技术支持和数据支撑。
1 材料与方法
1.1 试验材料
试验使用的菌株包括:哈维氏弧菌(V.harveyi,vha)、副溶血弧菌(V.parahemolyticus,vpa)、创伤弧菌(V.vulnificus,vvu) 和 溶 藻 弧 菌(V.alginolyticus,val),由福建农林大学海洋研究院从大黄鱼身上分离并保存;维氏气单胞菌(Vickers aeromonas,vae)、嗜水气单胞菌(Aeromonas hydrophila,vhy)、豚鼠气单胞菌(Aeromonas caviae,aca)、温和气单胞菌(Aeromonas sobria,aso)、大肠杆菌(Escherichia coli,eco)、金黄色葡萄球菌(Staphylococcus aureus,sau)、迟钝爱德华菌(Retarded Edwards,red)、绿脓杆菌(Pseudomonas aeruginosa,pae),由集美大学鳗鲡病害防控课题组提供。
主要试验试剂包括:硫酸镁、钙黄绿素与甜菜碱[Sigma Aldrich 公司(美国)],Tris-HCl (pH 值8.8)、KCl、(NH4)2SO4(索莱宝生物科技有限公司),MiniBEST 细菌基因组DNA 提取试剂盒、Taq DNA 聚合酶、dNTPs 和DNA Marker DL 2 000 [宝生物工程(大连)有限公司],Bst DNA 聚合酶、10× Reaction Buffer 和Solution Mix[New EnglandBiolabs 公 司( 美国)],胰酪大豆胨琼脂(TSA)培养基、胰酪大豆胨肉汤(TSB)培养基(厦门琉联生物科技有限公司),ALL-DNA-OUT 试剂盒[生工生物工程(上海)股份有限公司]。
根据弧菌属16S rRNA 高度保守区域的基因片段,利用Primer Explorer version 4.0 设计3 套LAMP 特异性引物,引物由生工生物科技有限公司合成。通过预试验进行比较筛选,最终确定1 套最优的LAMP 引物(见表1)。
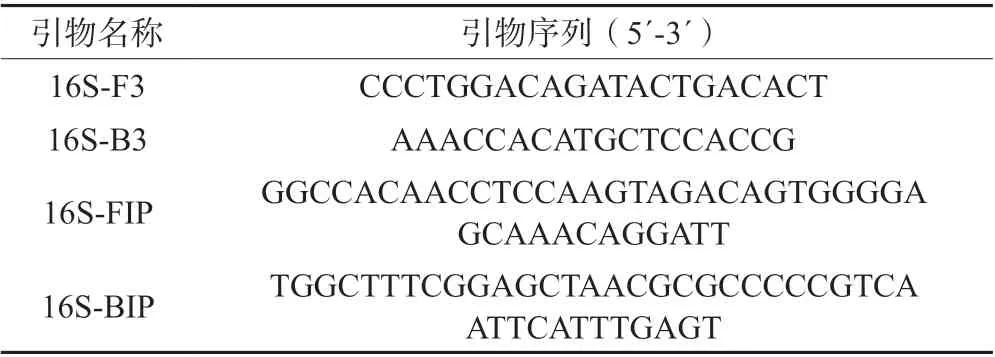
表1 LAMP 引物序列
1.2 试验方法
1.2.1 细菌DNA提物制备 将菌种从-80 ℃冰箱取出后快速复温,接种在TSA 平板上,并将平板倒置于培养箱中30℃过夜培养,从过夜培养的平板中各挑出3 个单菌落至TSB 培养基中,震荡培养12 h,按照细菌基因组DNA 提取试剂盒说明书进行DNA 提取,用分光光度计检测DNA 浓度及纯度,-20℃保存备用。
1.2.2 LAMP反应体系和反应程序的优化 根据相关文献使用LAMP 25 μL 反应体系,各种成分及其浓度为:内引物16s-FIP 和16s-BIP 各1.6 μmol/L、外引物16s-F3 和16s-B3 各0.2 μmol/L、20 mmol/L Tris-HCl (pH值8.8)、10 mmol/L KCl、8 mmol/L MgSO4、10 mmol/L(NH4)2SO4、0.1% Tween-20、0.8 mol/L 甜 菜 碱、1.6 mmol/L dNTPs,8U Bst DNA 聚合酶及模板2 μL,使用超纯水补齐至25 μL。反应程序为63 ℃、45 min。通过对Mg2+浓度(4、6、8、10 mmol/L)、甜菜碱浓度(0.4、0.6、0.8 、1.0 mol/L)、dNTPs浓度(1.2、1.4、1.6、1.8 mmol/L)和反应温度(61、63、65、67 ℃)4 个变量参数进行单因素试验,以扩增条带的清晰度为考察指标优化反应体系及反应程序。
1.2.3 特异性试验根据优化好的LAMP 反应体系及反应程序,以vha、vpa、val、vvu、vae、vhy、aca、aso、eco、sau、red 和pae 的DNA 为模板进行检测,以灭菌超纯水为阴性对照,同时向反应管中加入1 μL钙黄绿素,通过颜色变化来判断是否存在扩增,变黄绿色,说明发生了LAMP 特异性扩增,反之则无。同时进行常规PCR 扩增,引物为16S-F3 和16S-B3。反应体系(25 μL):Taq DNA 聚合酶0.3 μL,10×PCR Buffe 2.5 μL ,dNTP 2 μL,上下游引物 各0.5 μL,DNA 模板2 μL,用ddH2O 补齐至25 μL。反应程序:预变性94℃,5 min;变性94℃,30 s;退火58℃,30 s;延伸72℃,45 s,进行30 个循环;最后72℃终延伸10 min。反应结束后,将LAMP 扩增产物和常规PCR 扩增产物在1.2%琼脂糖凝胶上110 V 电泳分离30 min,并观察LAMP 扩增产物在紫外光照射下的颜色变化,以验证所建方法的特异性。
1.2.4 敏感性试验以vvu 为代表,将提取的DNA模板加入双蒸水,进行10 倍递进稀释,在相同反应条件下对不同浓度DNA 模板进行LAMP 扩增和常规PCR 扩增,通过琼脂糖电泳结果及颜色变化验证所建方法的最低检测限。
1.2.5 实际样品检测为了评价LAMP 检测方法的有效性,2019 年7 月从宁德蕉城区泥土澳养殖场采集体表有肉眼可见溃烂的大黄鱼6 条,采集其肝脏取约芝麻粒大小,加入到含有50 μL All-DNA-Fast-Out 的0.2 mLPCR 管中,在80℃孵育15 min 后,将上清液直接用做LAMP 检测的模板进行检测,并对常规PCR 方法与LAMP 方法的检测结果进行比较,同时对PCR产物进行测序。
2 结果与分析
2.1 LAMP 检测方法优化
在不同的Mg2+浓度、dNTP 浓度、甜菜碱浓度及反应温度下扩增,分别取5 μL 反应产物进行1.2%琼脂糖凝胶电泳,结果如图1 所示。
由图1A 可知,随着Mg2+浓度增加,LAMP 反应效率呈降低趋势,Mg2+浓度为4 mmol/L 时LAMP产物跑胶时条带最亮,与负对照相比差异最明显,这说明在LAMP 反应体系中Mg2+浓度为4 mmol/L 时反应效率最优。相反,反应体系中随着dNTPs 浓度的增加,LAMP 反应效率呈上升趋势(图1B),dNTPs 浓度为1.8 mmol/L 时,LAMP 产物跑胶时条带最亮,与负对照相比差异最明显。因此,选择dNTPs 浓度为1.8 mmol/L 进行LAMP 后续反应。
LAMP 反应体系中加入4 种不同浓度甜菜碱均可以得到梯型条带(图1C)。但0.4 和0.6 mol/L 条带亮度差异不大,与负对照相比差异最明显,考虑到试验成本,确定加入0.4 mol/L 甜菜碱进行LAMP 后续反应。此外,LAMP 反应体系中,61、63 和65℃均可以扩增出条带,说明反应温度条件具有比较好的宽容性,其中61 和63℃扩增产物亮度比较接近,与负对照相比差异最明显,说明在LAMP 反应体系中反应温度为61 或63℃时反应的产量相对更高。同样考虑到试验成本问题,确定最优的LAMP 反应温度为61℃。
综上所述,优化后LAMP 反应条件为:在25 μL 反应体系中内引物16S-FIP 和16S-BIP 浓度为1.6 μmol/L、外引物16S-F3 和16S-B3 浓度为0.2 μmol/L,反 应 体 系 中 包 含20 mmol/L Tris-HCl( pH 值8.8),KCl 10 mmol/L,MgSO44 mmol/L,(NH4)2SO410 mmol/L,Tween-20 0.1%,甜菜碱0.4 mol/L,dNTPs 1.8 mmol/L,8U BstDNA 聚合酶及模板2 μL;最终反应程序为61℃条件下运行45 min。
2.2 LAMP 反应特异性评价
使用优化后的LAMP 反应体系对供试的12 种菌株进行扩增,结果如图2 所示,仅溶藻弧菌、哈维氏弧菌、副溶血弧菌和创伤弧菌4 种菌株发生显色反应。常规PCR 结果(图3)显示,也只有溶藻弧菌、哈维氏弧菌、副溶血弧菌和创伤弧菌4 种菌株扩增出了条带,其他8 种常见致病菌及阴性对照样本均未扩增出条带。这表明优化后的LAMP 反应体系特异性较好。

图2 12 种供试菌株的LAMP 检测结果

图3 12 种供试菌株的常规PCR 检测结果
2.3 LAMP 反应灵敏度评价
由图4 可知,将创伤弧菌提取的DNA 进行系列稀释作为扩增反应模板,当浓度依次为94 ng/μL~ 940 fg/μL 时,均有发生显色反应,当浓度为94 fg/μL 时未出现显色,说明没有扩增。由图5 可知,常规PCR法的最低检测限为94 pg/μL。两相比较,说明LAMP检测比常规PCR 检测具有更好的灵敏度。

图4 LAMP 的灵敏性检测结果
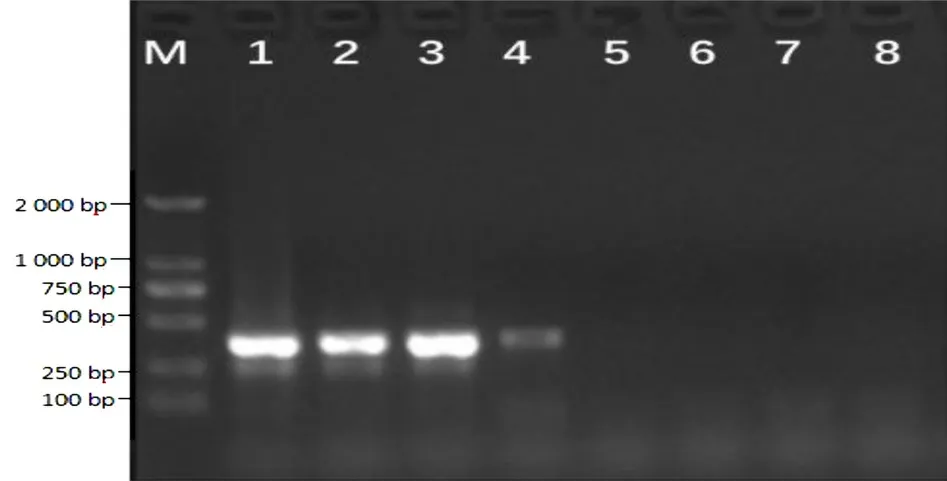
图5 常规PCR 的灵敏性检测结果
2.4 LAMP 检测方法的应用
用该研究建立的LAMP 法以及常规PCR 法对采集的体表有肉眼可见溃烂的大黄鱼进行检测,二者结果相一致,结果见图6 和图7,而且LAMP 反应液显色结果(图8)与电泳结果也是一致的。对PCR 产物进行测序,序列比对结果显示,PCR 扩增出的目的条带与Gene Bank 上公布的弧菌属序列同源率高达99%以上,表明大黄鱼感染了致病弧菌。同时,也验证了该LAMP 方法可准确检测出水产品上的弧菌,在实际应用中具有一定的可行性。
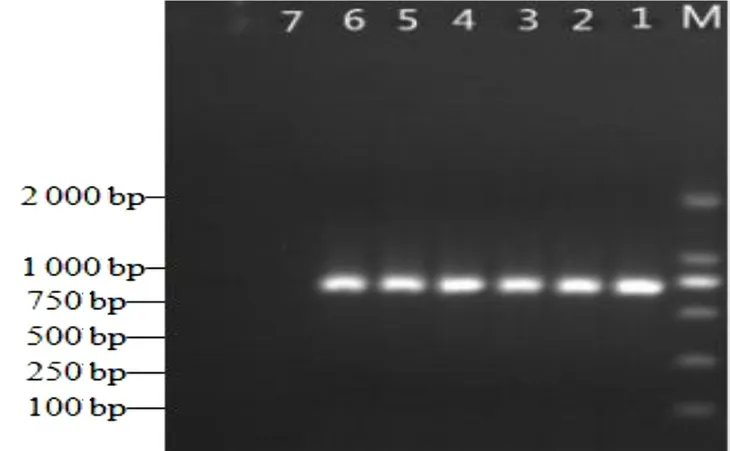
图6 实际样品的常规PCR 检测结果
图7 实际样品的LAMP 检测电泳结果

图8 实际样品的LAMP 检测显色结果
3 讨 论
相关研究显示,海水养殖水生生物在感染弧菌的早期由于无临床征象,往往难以察觉。然而,一旦感染,溶藻弧菌、哈维氏弧菌、副溶血弧菌、霍乱弧菌、创伤弧菌等弧菌在合适的外界环境下便会大量繁殖,当鱼体中的病原微生物大量积累,导致鱼群发生应激反应,鱼体组织出现明显溃烂时,养殖户们才会发现,此时已错过弧菌防治的最佳时机[17]。而且,水产养殖中弧菌病暴发的概率高,感染比例大,已成为阻碍水产养殖产业健康发展的主要因素[18]。
该研究针对致病性弧菌基因保守序列中的6 个位点设计了2 对特异性引物(内、外引物各一对),利用具有链置换活性的Bst DNA 聚合酶,通过链置换方式进行高效扩增,建立了一种针对致病性弧菌的快速通用LAMP 检测方法。由于LAMP 独特的核酸扩增机制,反应过程在恒温下即可完成,不再需要像常规PCR 那样复杂的程序(需经历预变性、变性、退火、延伸等多个温度),操作简便高效且成本低,对仪器要求也不高[19]。此外,LAMP 的产物是由多重复靶序列的茎-环状DNA 和花椰菜状DNA 所组成的混合物,在琼脂糖凝胶电泳上会呈现出LAMP 所特有的阶梯状条带,故可通过跑胶后的条带判断反应是否进行,另外可结合特定的荧光染料进行显色反应,检测人员可以直接根据颜色的变化来得出结果,对场地和人员的操作要求相对较低,在条件相对简陋的情况下也可以展开工作[20]。目前,LAMP 方法已成功应用于多种病毒、真菌、细菌等病原的分子生物学检测和诊断[21-23],在水产养殖领域也得到了有效推广。弧菌在海水和海洋动物中广泛存在且常年引发疾病,但大部分LAMP 检测都仅针对单一弧菌属细菌,对致病性弧菌进行通用性检测,可以显著提高检测效率,进而增强水生生物和海产品的安全性。
反应体系中反应温度以及Mg2+、dNTPs 和甜菜碱的浓度都会对LAMP 反应产生影响,浓度过高或过低都不利于反应的进行,甚至会终止反应,该研究对各反应条件进行优化,保证了方法的可靠性和特异性。整个LAMP 检测反应时间为45 min,较之于传统的检测方法和其他常规分子检测具有极大的优越性。优化后的LAMP 反应体系对溶藻弧菌、哈维氏弧菌、副溶血弧菌、创伤弧菌4 种弧菌检测均为阳性,其他菌株则未发生扩增反应,表明该研究的LAMP 引物可以有效对弧菌做出特异性检测。这是由于LAMP 反应需要在4 个不同序列的引物与模板发生特异性配对后才能启动,故其具有高度的特异性。在灵敏度检测中,当创伤弧菌核酸模板浓度为94 ng/μL ~940 fg/μL 时,每个浓度均可在紫外光下观察到蓝绿色且电泳结果也出现阶梯状条带,当模板浓度降低到94 fg/μL 时未发生显色反应,说明该体系检测的灵敏度为940 fg/μL,而常规PCR 检测的灵敏度为94 pg/μL,表明LAMP 检测下限比常规PCR 法降低了2 个数量级。LAMP 检测不需要对模板进行热变性处理,节省了因温度循环而消耗的时间,对仪器依赖性小,肉眼检测即可得出结果,更适合于现场的实地诊断。
综上所述,该研究开发了一种灵敏、快速、操作简便的LAMP 通用检测方法检测水生生物中的弧菌,而且可以直观地观察反应进行情况,便于试验室快速分析,也适用于养殖场的现场诊断,为实现致病性弧菌的早期诊断和现场即时检测,从而有效预防和监测因弧菌感染引发的疾病提供了科学有效的方法。
