TNF-α诱导大鼠软骨细胞焦亡模型的建立与评价
2022-06-06吴玉娇袁晓阳张运芳严尚学
徐 靓,吴玉娇,袁晓阳,张 峰,程 刚,张运芳,魏 伟,严尚学
骨关节炎(osteoarthritis, OA)是一种以关节软骨退变和关节腔炎症为主要病理变化的慢性关节退变疾病[1]。软骨细胞作为软骨组织中唯一的细胞类型,其功能的改变在OA中发挥着不可替代的关键作用[2]。细胞焦亡又称细胞炎性坏死,是一种由gasdermin蛋白介导的细胞程序性坏死[3],表现为细胞不断胀大直至细胞膜破裂,导致细胞内容物释放进而激活强烈的炎症反应。最近研究认为,细胞焦亡与OA病理进展密切相关,如焦亡在滑膜变化中起关键作用[4],与OA疼痛的病理机制相关[5],并且会加剧软骨的退化[6]。已有关于细胞焦亡方面的研究多集中于OA滑膜细胞、巨噬细胞,软骨细胞的相关研究较少。
基于细胞焦亡在OA发生发展过程中的作用,探索建立软骨细胞焦亡的细胞模型,对进一步阐明OA的病理机制,评价和筛选OA治疗药物具有重要意义。肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)是参与OA的重要促炎性细胞因子,可驱动炎症级联反应、诱导大量炎症和分解代谢因子产生[7]。该研究拟采用两步酶消化法收集大鼠软骨细胞进行体外培养,以不同质量浓度TNF-α诱导,模拟OA微环境,筛选出稳定的软骨细胞焦亡体外模型,为进一步阐明OA发生机制、筛选治疗OA的药物并评价其疗效及作用机制提供支持。
1 材料与方法
1.1 实验动物雄性SPF级SD大鼠,体质量约120 g,安徽省实验动物中心提供,合格证号:SCXK(皖)2017-001。本实验已通过安徽医科大学临床药理研究所动物实验伦理审查委员会批准(编号:PZ-2020-044)。
1.2 主要试剂Ⅱ型胶原酶购自美国Sigma公司;大鼠IL-1β、IL-18酶联免疫试剂盒购自上海酶联公司;TNF-α购自美国Peprotech公司;抗磷酸化核转录因子-κB p65 (Phospho-NF-κB p65, P-p65)抗体及抗p65抗体为美国CST公司产品;抗半胱天冬酶1(caspase-1)抗体及抗gasdermin D(GSDMD)抗体为美国Proteintech公司产品;抗核苷酸结合寡聚化结构域样受体蛋白3 (nucleotide-binding and oligomerization domain-like receptor containing protein 3, NLRP3)抗体及抗β-actin抗体为美国Affinity公司产品;抗基质金属蛋白酶13(matrix metalloproteinase-13, MMP-13)抗体及抗Ⅱ型胶原(type Ⅱ collagen, Col Ⅱ)抗体为美国Novus公司产品。
1.3 主要仪器全波长多功能酶标仪(型号: Infinite M1000 Pro,瑞士Tecan公司);荧光及化学发光成像系统(型号: ImageQuant LAS 4000,美国GE公司);激光共聚焦显微镜(型号:TCS SP8)、倒置LED显微镜(型号:DMil)(德国徕卡公司);场发射扫描电子显微镜(型号:GeminiSEM 300,德国蔡司公司)。
1.4 实验方法
1.4.1软骨细胞的分离、培养 使用手术刀片缓慢刮取大鼠膝关节软骨,无菌眼科剪将关节软骨剪碎至体积为1 mm×1 mm×1 mm大小,加入0.25%胰蛋白酶置于37 ℃摇箱消化40 min,用含血清的培养基终止胰酶消化后,加入0.2%Ⅱ型胶原酶于37 ℃摇箱内继续消化2 h,结束后将消化液吹散混匀,离心后PBS重悬,再离心,加入完全培养基分散细胞后转移到普通培养瓶中培养,48 h后首次换液。待细胞长满后进行传代处理,三代以内原代软骨细胞用于后续实验。
1.4.2软骨细胞鉴定 以甲苯胺蓝染色与Col Ⅱ免疫组织化学染色进行软骨细胞鉴定。采用爬片技术,细胞贴壁后取出盖玻片,4 %多聚甲醛固定20 min,3 %过氧化氢室温下孵育10 min,5% BSA封闭10 min,滴加Col Ⅱ一抗,4 ℃过夜。复温后滴加生物素标记的二抗,室温下孵育30 min。DAB显色,苏木精复染,梯度乙醇脱水,中性树胶封片。倒置相差显微镜下观察并拍照记录。对于甲苯胺蓝染色,固定后用甲苯胺蓝染色5 min,梯度乙醇脱水后常温干燥,中性树胶封片。
1.4.3CCK-8法检测软骨细胞的活力 制备细胞悬液,96孔板每孔加入5 000个细胞,过夜,细胞充分贴壁,给予TNF-α(0、5、10、20、40 ng/ml)不同浓度刺激,其中TNF-α(0 ng/ml)为对照组。48 h后每孔加入10 μl CCK-8,避光孵育1.5 h,酶标仪测定450 nm 处吸光度A值。细胞活力(%)=[ (A刺激组-A空白组)/(A对照组-A空白组)]×100%。
1.4.4Western blot检测软骨细胞焦亡信号蛋白、MMP-13及Col Ⅱ的表达 收集TNF-α(0、5、10、20、40 ng/ml)不同浓度刺激后的细胞,提取细胞总蛋白,电泳,转膜,封闭,分别加入P-p65、p65、NLRP3、caspase-1、GSDMD、MMP-13、Col Ⅱ、β-actin等一抗孵育过夜,加二抗37 ℃孵育2 h,洗膜显影。ImageJ软件分析灰度值并进行统计分析。
1.4.5ELISA检测软骨细胞培养上清液中IL-1β、IL-18的水平 收集TNF-α(20 ng/ml )刺激组和对照组的细胞培养上清液,ELISA法测定IL-1β、IL-18的浓度。
1.4.6免疫荧光检测软骨细胞GSDMD表达 将软骨细胞以TNF-α(20 ng/ml)处理48 h后,采用爬片技术以4%多聚甲醛固定20 min,用5%BSA封闭1 h,加入抗GSDMD抗体4 ℃孵育过夜,加入二抗室温孵育1.5 h,以DAPI染核10 min,用抗荧光淬灭剂封片,激光共聚焦显微镜拍照。
1.4.7扫描电镜观测软骨细胞的形态学改变 将软骨细胞以TNF-α(20 ng/ml)处理48 h后,采用爬片技术以2.5%戊二醛固定,乙醇梯度脱水、临界点干燥、镀膜、扫描电镜观察细胞形态。
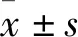
2 结果
2.1 软骨细胞形态学观察经过两步酶消化法分离得到的原代软骨细胞为球形,呈悬浮状态,大小均一,具有较强的折光性。贴壁后的软骨细胞大部分呈圆形、椭圆形或短梭形,培养4 d后,软骨细胞呈不规则的卵圆形或多角形,可见成簇现象。细胞基本爬满瓶底后,此时软骨细胞多为圆形,胞体丰满,胞质均匀,核大而圆并且互相连接成“铺路石”样结构。传代后细胞贴壁时间较原代细胞缩短,增殖速度加快(图1)。
2.2 软骨细胞鉴定3代内的阳性软骨细胞甲苯胺蓝染色可见细胞内有蓝紫色异染颗粒,Col Ⅱ免疫组织化学染色可见胞浆呈棕黄色。分离培养后二者均为阳性的软骨细胞比例约为98%。见图2。
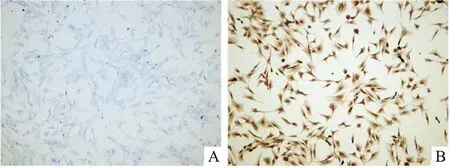
图2 大鼠软骨细胞鉴定 ×100A:甲苯胺蓝染色;B:Col Ⅱ染色
2.3 不同浓度TNF-α对细胞活力的影响以不同浓度TNF-α处理软骨细胞48 h,CCK-8检测结果显示(图3),随着TNF-α浓度增加,软骨细胞活力逐渐下降。与对照组比较,TNF-α(20、40 ng/ml)可抑制软骨细胞活力(F=4.474,P<0.05)。
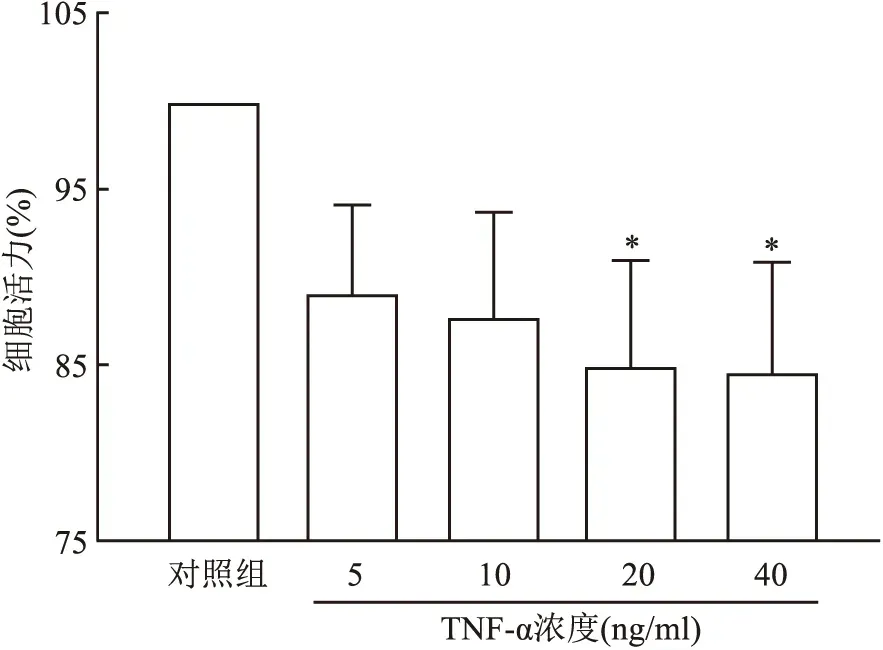
图3 不同浓度TNF-α对细胞活力的影响(n=3)与对照组比较:*P<0.05
2.4 不同浓度TNF-α对软骨细胞焦亡信号蛋白的影响图4结果显示,TNF-α(5、10、20、40 ng/ml)均可促进软骨细胞P-p65、NLRP3、caspase-1、GSDMD的蛋白表达,且随着浓度增加,蛋白表达水平逐渐升高。TNF-α(5 ng/ml)组P-p65、NLRP3、caspase-1、GSDMD的蛋白表达与对照组比较差异均无统计学意义。TNF-α(10 ng/ml)组P-p65、NLRP3的蛋白表达与对照组比较差异具有统计学意义(P<0.05,P<0.01)。而TNF-α(20 ng/ml)和TNF-α(40 ng/ml)处理的焦亡信号蛋白表达均存在显著性差异(P<0.05或0.01)。结合CCK-8结果,选择TNF-α浓度为20 ng/ml进行后续实验。
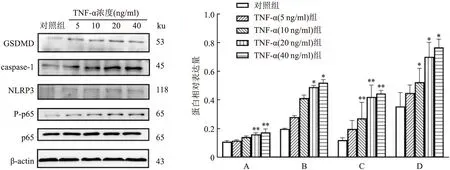
图4 TNF-α对软骨细胞焦亡信号蛋白的影响(n=3)A:GSDMD/β-actin;B:caspase-1/β-actin;C:NLRP3/β-actin;D:P-p65/p65;与对照组比较:*P<0.05,**P<0.01
2.5 TNF-α对软骨细胞MMP-13和Col Ⅱ表达的影响为进一步了解TNF-α对软骨细胞胶原代谢的影响,实验检测了TNF-α(20 ng/ml)刺激软骨细胞后MMP-13和Col Ⅱ的表达水平。图5结果显示,TNF-α(20 ng/ml)可提高软骨细胞MMP-13水平(t=4.337,P<0.05) ,降低Col Ⅱ的表达(t=4.287,P<0.05 )。结果提示TNF-α(20 ng/ml)破坏了软骨细胞内的基质平衡。
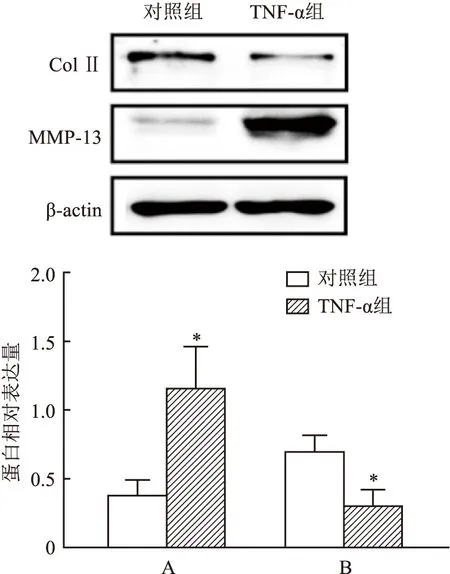
图5 TNF-α对软骨细胞MMP-13和Col Ⅱ表达的影响(n=3)A:MMP-13/β-actin;B:Col Ⅱ/β-actin;与对照组比较:*P<0.05
2.6 TNF-α对软骨细胞培养上清液中IL-1β、IL-18水平的影响ELISA结果显示,与对照组细胞培养上清液中的IL-1β、IL-18水平相比,TNF-α(20 ng/ml)刺激可上调关节软骨细胞培养上清液中促炎细胞因子IL-1β[(10.210±0.512)vs(24.680±0.449),t=21.230,P<0.001]和IL-18水平[(40.000±3.408)vs(96.360±5.598),t=8.599,P<0.01]。结果提示TNF-α(20 ng/ml)可促进软骨细胞内炎症因子IL-1β、IL-18的释放。
2.7 TNF-α对软骨细胞GSDMD表达的影响GSDMD定位于细胞质中,炎症环境下细胞膜上亦有表达。与对照组软骨细胞相比,TNF-α(20 ng/ml)刺激后的关节软骨细胞GSDMD荧光表达增强。见图6。
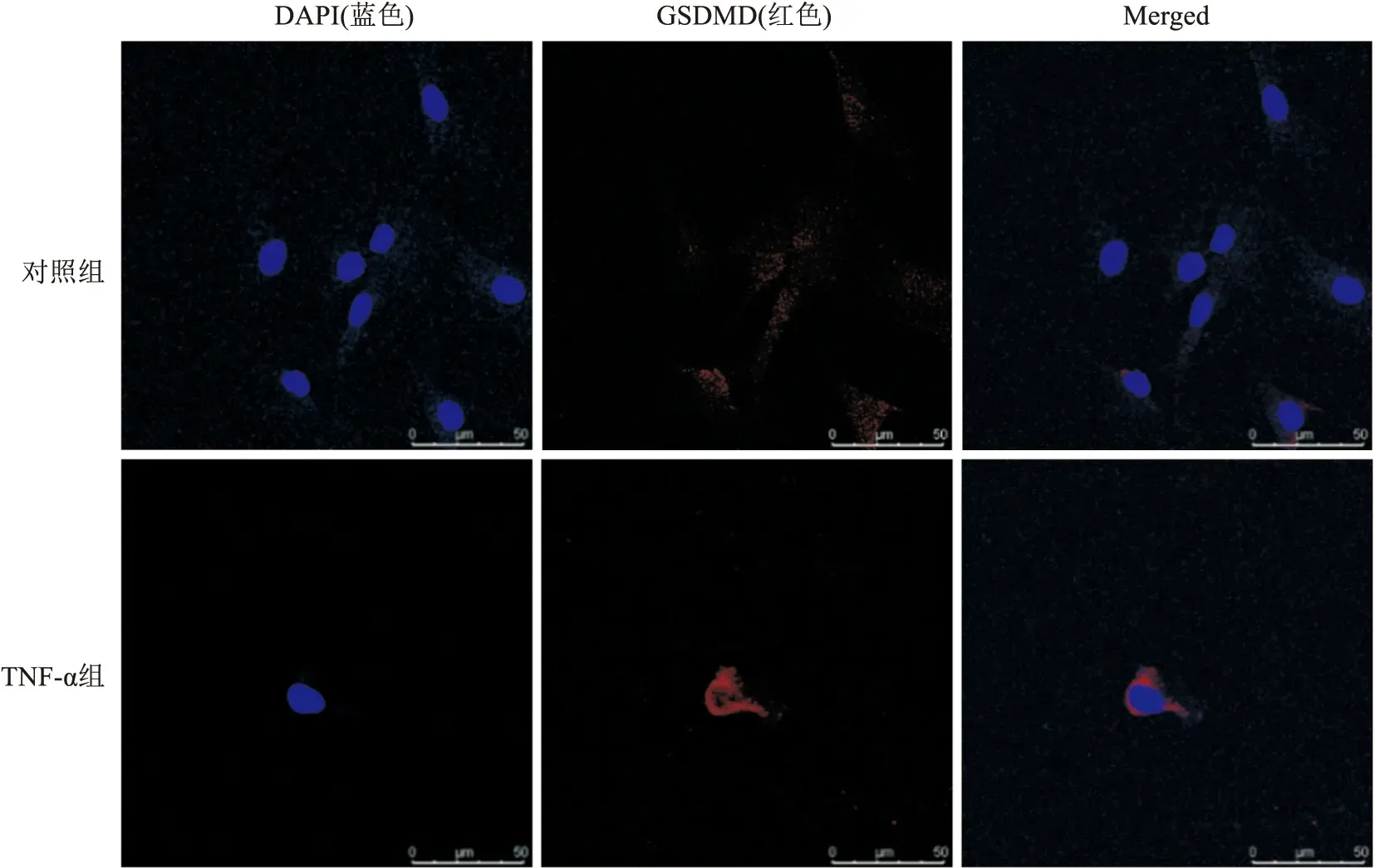
图6 TNF-α刺激对软骨细胞GSDMD表达的影响 ×630
2.8 TNF-α对软骨细胞焦亡形态学的影响扫描电镜结果(图7)显示,对照组软骨细胞结构完整,TNF-α(20 ng/ml)刺激后关节软骨细胞肿胀变形,细胞膜穿孔并破裂,显微结构破坏。结果提示TNF-α(20 ng/ml)可诱导软骨细胞发生焦亡形态学变化。
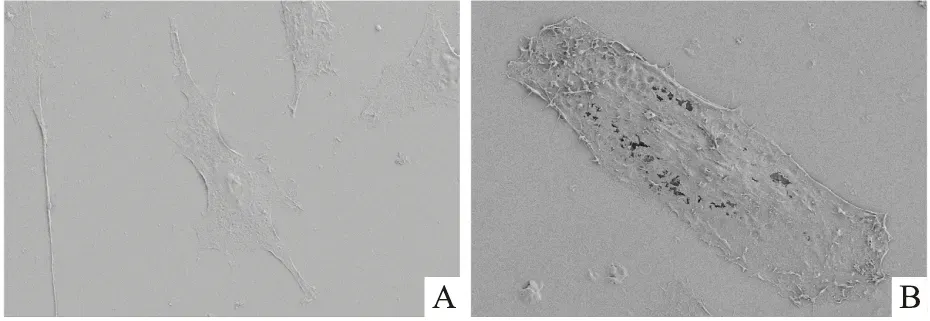
图7 扫描电镜下软骨细胞的形态变化 ×1 000A:对照组;B:TNF-α组
3 讨论
在经典的焦亡信号中,危险信号可刺激细胞膜上的模式识别受体并与之结合,形成由NLRP3、凋亡相关斑点样蛋白和效应分子caspase-1组成的NLRP3炎症小体[8],这些炎症小体激活caspase-1后进一步切割GSDMD产生膜孔,导致细胞肿胀并最终溶解,释放大量的促炎细胞因子,如IL-1β、IL-18等,这些致炎性细胞因子又进一步促进了焦亡的发生[9]。近年来研究[6]表明,OA患者的NLRP1和NLRP3表达水平显著升高;在OA患者的软骨中,未及时被吞噬的凋亡小体,可连同软骨钙化的增加通过继发性细胞焦亡加重OA[10],这些研究提示细胞焦亡与OA的发生、发展过程密切相关。
在本研究中,采用两步酶消化法提取的大鼠软骨细胞,细胞形态特征明显,甲苯胺蓝和Col Ⅱ染色为阳性,且纯度达到98%以上,提示软骨细胞提取分离成功。TNF-α(20 ng/ml)可抑制大鼠软骨细胞活力,致细胞穿孔破裂、显微结构破坏,其焦亡特征性信号分子P-p65、NLRP3、caspase-1和GSDMD表达水平上升,且培养上清液中IL-1β、IL-18水平升高。这些结果表明,TNF-α(20 ng/ml)可以成功诱导大鼠软骨细胞焦亡模型。细胞外基质丢失被认为是OA软骨损伤的主要原因之一[11-12]。在基质组成中,Col Ⅱ与其它胶原蛋白及非胶原蛋白结合,形成稳定的网状结构,为软骨提供拉伸强度[13]。在炎症过程中,NF-κB途径的激活抑制了软骨细胞合成代谢,并诱导基质金属蛋白酶的表达[2]。TNF-α(20 ng/ml)通过激活NF-κB信号促进大鼠软骨细胞MMP-13表达升高,诱导Col Ⅱ降解,导致了软骨细胞基质破坏。
综上所述,TNF-α(20 ng/ml)可模拟炎症微环境诱导大鼠软骨细胞焦亡发生。该模型可广泛用于研究OA发病机制及体外筛选治疗OA的潜在药物。
