胃饥饿素对高糖下人视网膜血管内皮细胞的保护作用及机制
2022-06-04李建波罗永锋
李建波,罗永锋
0引言
糖尿病视网膜病变(DR)是糖尿病严重的微血管并发症,是世界范围内工龄成人视力丧失的主要原因[1]。高血糖等因素引起视网膜微血管内皮细胞功能障碍,从而导致晚期视网膜新生血管形成,继发性视网膜脱离和玻璃体积血,最终导致患者视力下降[2]。越来越多的证据认为,DR是炎症、氧化应激等多因素参与的复杂疾病,病理机制有待逐步阐明[3]。目前,激光光凝、抗新生血管药物和玻璃体切除术是DR治疗的主要手段,但存在损害健康视网膜组织的风险,且这些治疗策略的疗效仍不充分[4]。因此,探索DR的病理机制和新的治疗策略成为近年来眼科领域的研究热点[5]。胃饥饿素(ghrelin)是一种在体内广泛分布的脑肠肽激素,通过与生长激素分泌素受体(GHSR)结合,发挥一系列生物学效应,主要调节与能量稳态相关的生理过程,如食欲、胰岛素信号、葡萄糖代谢和肥胖[6]。研究发现,胃饥饿素及其受体也在眼组织中表达,在实验性青光眼和视网膜新生血管疾病中显示出治疗潜力[7-8]。血浆胃饥饿素水平的改变是糖尿病及其并发症的潜在危险因素,据此推测靶向胃饥饿素可能是一种新的糖尿病治疗策略[9]。然而,关于胃饥饿素在DR中的作用鲜有报道。虽然高血糖导致视网膜组织损伤的确切机制尚不清楚,但有证据表明,糖尿病眼的慢性低度炎症在一定程度上驱动一系列DR症状的出现[10]。作为眼内的先天免疫系统,已证实视网膜细胞中的核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体参与了DR的发病机制。糖尿病患者的眼内有多种途径可以激活NLRP3炎症小体信号,随后通过上调白细胞介素(IL)-1β和IL-18的释放而发挥有害作用[11]。在本研究中,我们在体外观察胃饥饿素对高浓度葡萄糖条件下视网膜血管内皮细胞增殖、凋亡及NLRP3炎症小体的影响,以期为进一步研究胃饥饿素对DR的治疗作用奠定实验基础。
1材料和方法
1.1材料人视网膜血管内皮细胞购自上海中乔新舟生物科技有限公司;M199培养基购自武汉普诺赛生命科技有限公司;胎牛血清及胰蛋白酶购自美国Gibco公司;胃饥饿素购自美国Sigma公司;CCK-8试剂盒购自武汉伊莱瑞特生物科技有限公司;Annexin-APC/7-AAD细胞凋亡试剂盒购自天津三箭生物技术股份有限公司;兔多抗NLRP3抗体购自美国Abcam公司;兔多抗Caspase-1抗体及IL-18抗体均购自美国Affinity公司;兔多抗IL-1β购自武汉三鹰生物技术有限公司;小鼠单抗β-actin及辣根过氧化物酶标记的羊抗兔二抗均购自武汉博士德生物工程有限公司。
1.2方法
1.2.1细胞培养及分组将人视网膜血管内皮细胞置于含10%胎牛血清的M199培养基中,在37℃、5%CO2及饱和湿度条件下培养。将生长状态良好的细胞用高糖和不同浓度的胃饥饿素(0、5、10、20、40nmol/L)分别处理48h。根据CCK-8检测结果,选择胃饥饿素的最佳浓度进行后续实验。然后将细胞随机分为四组:正常对照组(NC,M199培养基中培养),胃饥饿素组(M199培养基中加入10nmol/L ghrelin),高糖组(HG,M199培养基中加入30mmol/L葡萄糖)及ghrelin+HG组(M199培养基中加入10nmol/L ghrelin和30mmol/L葡萄糖),四组细胞均处理48h。
1.2.2细胞增殖根据说明书使用CCK-8试剂盒检测人视网膜血管内皮细胞增殖。将细胞接种于96孔板中,每孔的密度为5×103cell/mL。不同组细胞处理48h后,每孔加10μL CCK-8试剂。37℃孵育4h后,在450nm的酶标仪上测定每孔的吸光度值(A)。计算细胞增殖率(%)为(A实验组-A空白组)/(A对照组-A空白组)×100%。A实验组为处理后细胞的吸光度值,A空白组为无细胞培养基的吸光度值,A对照组为未处理细胞的吸光度值。
1.2.3细胞凋亡采用Annexin-APC/7-AAD凋亡检测试剂盒检测细胞凋亡情况。将状态良好的细胞接种于6孔板中,每孔5×105个,37℃孵育48h。消化后收集细胞,1500r/min离心5min。然后用500μL结合缓冲液重悬细胞,加入5μL Annexin-APC和5μL 7-AAD染色。避光室温孵育15min,1h内流式细胞仪上机检测。
1.2.4Westernblotting检测细胞NLRP3和Caspase-1及IL-1β与IL-18的表达用RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度后,用SDS-PAGE凝胶分离40μg样品,转移到PVDF膜上。含5%脱脂奶粉的TBST封闭膜,加入稀释的一抗NLRP3(1∶1000)、Caspase-1(1∶5000)、IL-1β(1∶500)、IL-18(1∶500)和β-actin(1∶1000),在4℃孵育过夜。然后,用辣根过氧化物酶标记的羊抗兔IgG抗体(1∶50000)在室温下孵育2h。ECL显色曝光条带,采用Bandscan 5.0软件进行量化。
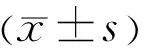
2结果
2.1胃饥饿素对高糖下人视网膜血管内皮细胞增殖的影响首先设置了不同浓度的ghrelin组,以筛选高糖环境下胃饥饿素对人视网膜血管内皮细胞的最佳保护作用浓度。CCK-8检查结果显示,与NC组相比,HG组细胞增殖率明显降低了近1/2,给予不同浓度胃饥饿素联合高糖处理,细胞增殖均有一定程度的升高。胃饥饿素浓度在10nmol/L时细胞增殖最强,而20、40nmol/L的胃饥饿素处理,使高糖下的细胞增殖率又逐渐降低(图1)。以上结果提示,浓度10nmol/L是胃饥饿素发挥保护作用的最佳浓度,因此后续研究中采用此浓度作为ghrelin组。NC组、ghrelin组、HG组及ghrelin+HG组的细胞增殖率分别为100.00%±0.00%、104.09%±0.61%、69.87%±0.68%、92.31%±3.62%,差异有统计学意义(F=200.83,P<0.001)。进一步组间两两比较显示,ghrelin组细胞增殖率高于NC组(t=11.70,P<0.001)。HG和ghrelin+HG组细胞增殖率均低于NC组(t=-76.26,P<0.001;t=-3.68,P<0.05)和ghrelin组(t=-64.88,P<0.001;t=-5.56,P<0.01)。与HG组相比,ghrelin+HG组细胞增殖率明显升高(t=10.56,P<0.001),见图2。
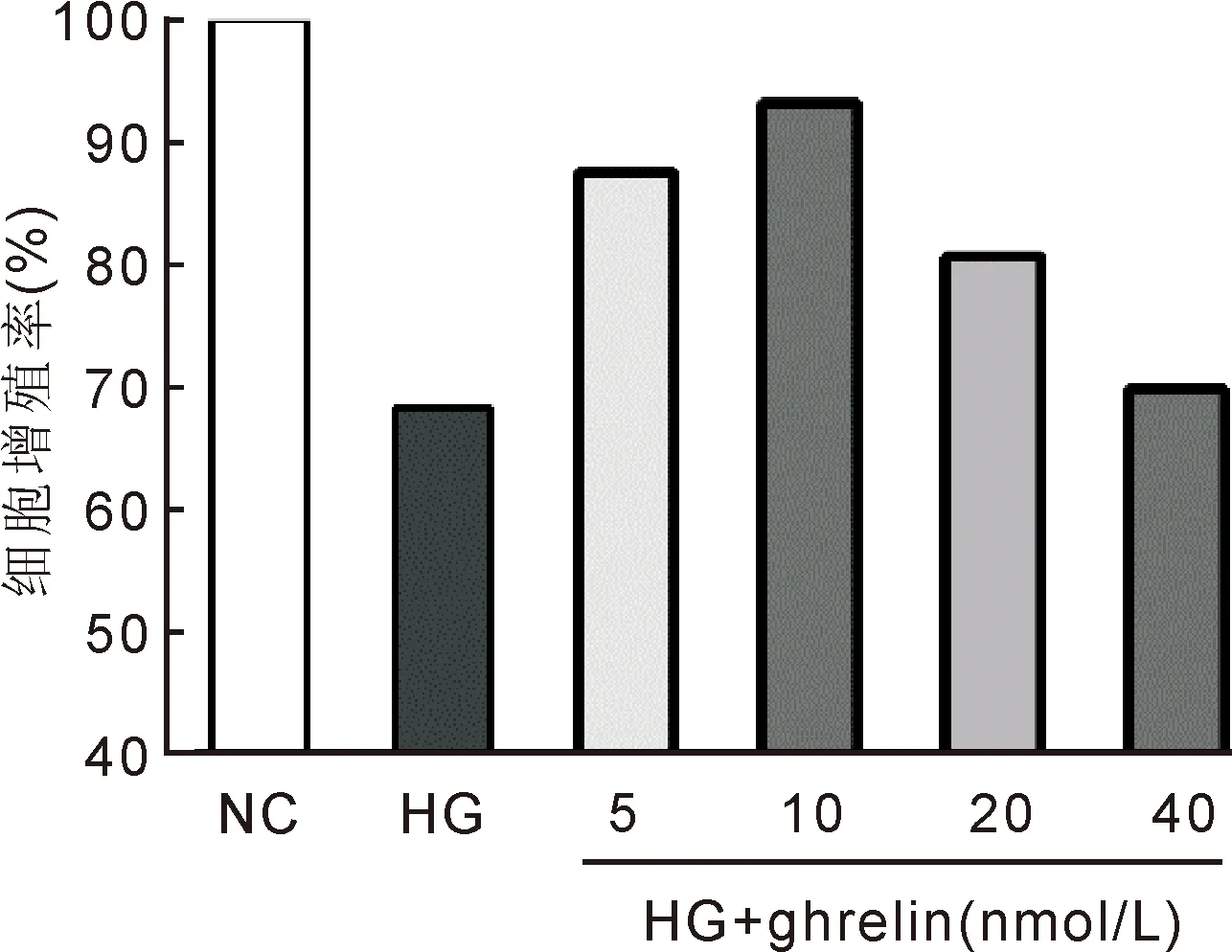
图1 CCK-8法筛选ghrelin作用浓度。
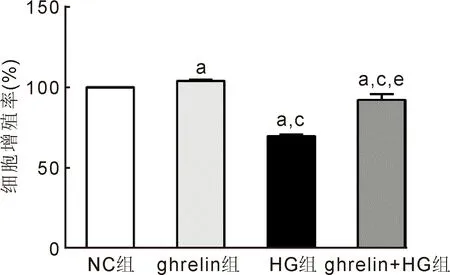
图2 CCK-8法检测各组人视网膜血管内皮细胞增殖情况 与NC组相比,ghrelin组细胞增殖增强,HG组和ghrelin+HG组细胞增殖减弱;与ghrelin组相比,HG组和ghrelin+HG组细胞增殖减弱;与HG组相比,ghrelin+HG细胞增殖增强。aP<0.05 vs NC组;cP<0.05 vs ghrelin组;eP<0.05 vs HG组。
2.2胃饥饿素对高糖下人视网膜血管内皮细胞凋亡的影响流式检测结果显示,NC组、ghrelin组、HG组、ghrelin+HG组的细胞凋亡率分别为4.94%±0.15%、3.58%±0.17%、28.33%±1.37%、14.24%±0.32%,差异有统计学意义(F=763.57,P<0.001)。进一步组间两两比较结果显示,ghrelin组细胞凋亡率低于对照组(t=-10.23,P<0.01)。
HG和ghrelin+HG组细胞凋亡率均高于NC组(t=29.30、45.51,均P<0.001)和ghrelin组(t=30.95,P<0.001;t=51.00,P<0.01)。与HG组相比,ghrelin+HG组细胞凋亡率明显降低(t=-17.30,P<0.001),见图3。
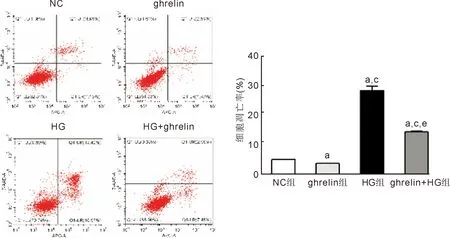
图3 流式细胞仪检测各组人视网膜血管内皮细胞凋亡情况 与NC组相比,ghrelin组细胞凋亡减少,HG组和ghrelin+HG组细胞凋亡增多;与ghrelin组相比,HG组和ghrelin+HG组细胞凋亡增多;与HG组相比,ghrelin+HG细胞凋亡减少。aP<0.05 vs NC组;cP<0.05 vs ghrelin组;eP<0.05 vs HG组。
2.3胃饥饿素对高糖下人视网膜血管内皮细胞NLRP3炎症小体蛋白表达的影响Western blotting结果显示,NC组、ghrelin组、HG组、ghrelin+HG组的NLRP3炎症小体相关蛋白相对表达量分别为:NLRP3(0.53±0.02、0.31±0.00、1.08±0.03、0.75±0.03);Caspase-1(0.22±0.03、0.12±0.01、0.60±0.07、0.34±0.05)。各组间差异均有统计学意义(NLRP3:F=495.92,P<0.001;Caspase-1:F=64.52,P<0.001)。进一步组间两两比较结果显示,ghrelin组细胞这两种蛋白的表达均低于NC组(NLRP3:t=-16.58,P<0.001;Caspase-1:t=-5.65,P<0.01)。HG和ghrelin+HG组NLRP3的蛋白表达均高于NC组(t=23.42,P<0.001;t=10.21,P<0.01)和ghrelin组(t=38.92,P<0.001;t=24.84,P<0.01)。HG和ghrelin+HG组Caspase-1的蛋白表达均高于NC组(t=9.12,P<0.01;t=3.41,P<0.05)和ghrelin组(t=12.29,P<0.001;t=7.07,P<0.01)。与HG组相比,ghrelin+HG组两种蛋白的相对表达明显降低(NLRP3:t=-12.42,P<0.001;Caspase-1:t=-5.48,P<0.01),见图4。

图4 Western blotting检测各组人视网膜血管内皮细胞NLRP3炎症小体蛋白的表达 与NC组相比,ghrelin组细胞表达NLRP3及Caspase-1减少,HG组和ghrelin+HG组细胞表达NLRP3及Caspase-1增多;与ghrelin组相比,HG组和ghrelin+HG组NLRP3、Caspase-1表达增多;与HG组相比,ghrelin+HG细胞NLRP3、Caspase-1表达减少。aP<0.05 vs NC组;cP<0.05 vs ghrelin组;eP<0.05 vs HG组。
2.4胃饥饿素对高糖下人视网膜血管内皮细胞IL-1β及IL-18蛋白表达的影响Western blotting结果显示,NC组、ghrelin组、HG组、ghrelin+HG组炎症蛋白的相对表达量分别为:IL-1β(0.34±0.06、0.20±0.04、0.76±0.06、0.46±0.07);IL-18(0.39±0.03、0.18±0.01、0.79±0.07、0.55±0.04)。各组间差异均有统计学意义(IL-1β:F=47.44,P<0.001;IL-18:F=114.57,P<0.001)。进一步组间两两比较结果显示,ghrelin组细胞这两种蛋白的表达均低于NC组(IL-1β:t=-3.40,P<0.05;IL-18:t=-12.33,P<0.01)。HG和ghrelin+HG组IL-1β的蛋白表达均高于NC组(HG:t=8.58,P<0.01;ghrelin+HG:t=2.27,P<0.05)和ghrelin组(HG:t=12.94,P<0.001;ghrelin+HG:t=5.35,P<0.01)。HG和ghrelin+HG组IL-18的蛋白表达均高于对照组(HG:t=9.33,P<0.01;ghrelin+HG:t=6.19,P<0.01)和ghrelin组(HG:t=14.99,P<0.001;ghrelin+HG:t=16.60,P<0.01)。与HG组相比,ghrelin+HG组两种蛋白的相对表达明显降低(IL-1β:t=-5.33,P<0.01;IL-18:t=-5.31,P<0.01),见图5。
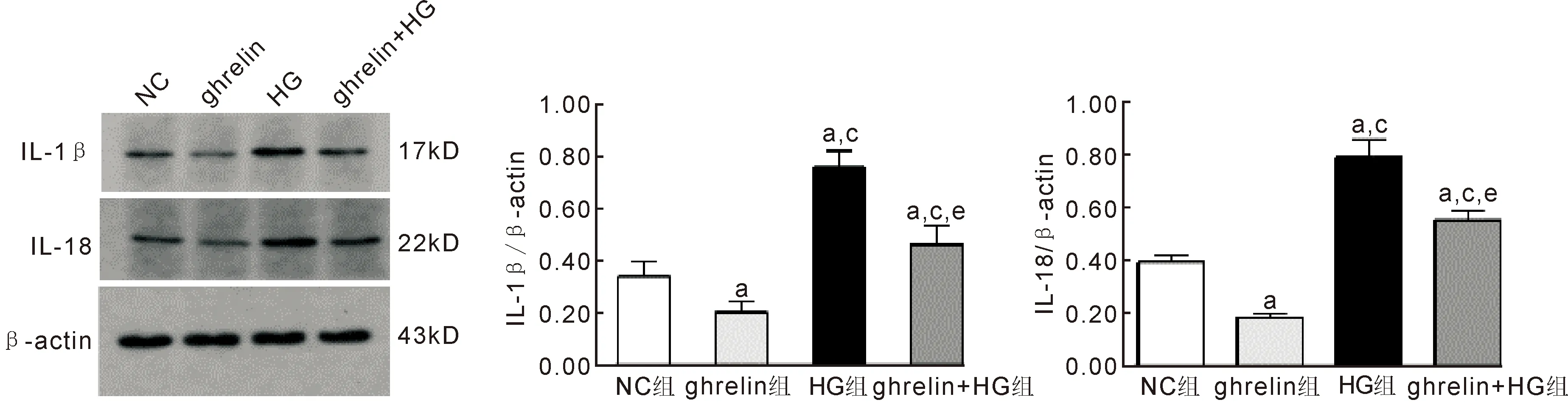
图5 Western blotting检测各组人视网膜血管内皮细胞炎症因子IL-1β及IL-18蛋白的表达 与NC组相比,ghrelin组细胞表达IL-1β、IL-18减少,HG组和ghrelin+HG组细胞表达IL-1β、IL-18增多;与ghrelin组相比,HG组和ghrelin+HG组IL-1β、IL-18表达增多;与HG组相比,ghrelin+HG细胞IL-1β、IL-18表达减少。aP<0.05 vs NC组;cP<0.05 vs ghrelin组;eP<0.05 vs HG组。
3讨论
胃饥饿素是Kojima等[12]在1999年发现的一种大脑肽,由28个氨基酸残基组成,相对分子质量为3314kDa。胃饥饿素广泛分布于人体细胞和组织,通过与其受体GHSR结合,可促进生长激素分泌,参与能量代谢,改善胃肠功能,保护心血管系统[13]。GHSR广泛分布于人的中枢神经系统和周围组织[14],在人眼睫状体色素上皮、视网膜色素上皮和虹膜中均有表达[15]。以往对胃饥饿素作用的研究主要集中在GH的分泌和调节生长与能量的平衡,近年来发现胃饥饿素可能具有更广泛的生物学效应,在许多眼病中的作用已引起关注。例如,胃饥饿素可减少大鼠慢性高眼压模型的神经节细胞凋亡[16],而青光眼患者血清和房水中的胃饥饿素水平显著降低[17]。对于视网膜血管性疾病,胃饥饿素在早产儿视网膜病变动物模型的两个阶段都发挥有益的作用[8]。针对糖尿病血管并发症的研究发现,糖尿病肾病患者血浆胃饥饿素水平明显低于无糖尿病并发症的患者,提示胃饥饿素在动脉粥样硬化、微血管疾病等糖尿病性内皮细胞功能障碍中发挥保护作用[18]。另有研究证明在糖尿病患者中内源性胃饥饿素表达下调,而外源性胃饥饿素可增强糖尿病患者下肢动脉灌注,表明胃饥饿素可能是一种潜在的外周动脉疾病的新疗法[19]。然而,胃饥饿素是否在DR这一微血管并发症中也同样发挥有益作用还有待研究。
为了初步探究胃饥饿素对DR的保护作用,本研究在体外观察了胃饥饿素对高糖条件下人视网膜血管内皮细胞增殖及凋亡的影响。我们观察了不同浓度胃饥饿素对高糖下细胞增殖率的影响,并选择了最佳的作用浓度10nmol/L用于后续研究。与正常对照组相比,高糖组的细胞增殖率明显降低,细胞凋亡率明显升高,这一结果与文献报道一致[20],提示高糖环境对视网膜血管内皮细胞可造成显著损伤。联合外源性胃饥饿素处理的细胞增殖率明显高于高糖组,细胞凋亡率明显低于高糖组,表明胃饥饿素对高糖损伤的人视网膜血管内皮细胞具有明显的保护作用。针对其他血管内皮细胞的一系列研究表明,胃饥饿素可刺激人真皮微血管内皮细胞、心脏微血管内皮细胞和人脐静脉内皮细胞的增殖,当抑制GHSR时,细胞增殖能力明显减弱[21-24]。然而也有研究发现,胃饥饿素在体外和体内均能抑制人脐静脉内皮细胞的增殖和大鼠脑微血管内皮细胞的增殖[25-26]。以上实验结果的差异可能与不同细胞所处的病理生理环境不同有关,因此,胃饥饿素对血管内皮细胞的作用有待进一步研究。
炎症小体是2002年由Tschopp研究小组首次提出的细胞质多蛋白复合物[27]。炎症小体负责Caspase-1的激活,随后产生细胞因子IL-1β和IL-18,并启动炎性细胞死亡程序[28]。已经发现了几种主要的炎症小体,包括NLRP1、NLRP3、NLRC4[29],到目前为止对NLRP3炎症小体的研究最为广泛。NLRP3炎症小体通常由NLRP3、ASC和Caspase-1组成[30]。越来越多的证据表明NLRP3炎症小体激活参与促进内皮细胞功能障碍[31],因此成为DR的重要致病因素[10-11]。鉴于此,本研究观察了NLRP3在胃饥饿素保护高糖损伤的视网膜内皮细胞中的可能角色。结果提示,NLRP3炎症小体在高糖条件下的人视网膜血管内皮中表达增加,其下游细胞因子IL-1β和IL-18的表达也有升高,而胃饥饿素处理可显著降低高糖下的NLRP3炎症小体信号通路的激活。最近的研究表明胃饥饿素在多种疾病中的保护作用与抑制NLRP3炎症小体有关[32-33],与本研究结果相一致,这些研究均提示NLRP3炎症小体是胃饥饿素发挥保护效应的一种可能机制。
本研究为胃饥饿素在DR发病机制中的作用和潜在机制提供了初步证据。我们发现高糖抑制人视网膜内皮细胞增殖,诱导细胞凋亡及NLRP3炎症小体活化,用胃饥饿素处理对细胞增殖有保护作用,对细胞凋亡和NLRP3炎症小体激活有抑制作用。据此认为,胃饥饿素可能是一种潜在的治疗靶点,以减少高糖诱导的视网膜血管内皮细胞损伤。然而,本研究仅在细胞实验层面对胃饥饿素的作用进行了初步观察,目前获得的结果尚不能证明胃饥饿素是直接通过抑制NLRP3炎症小体的激活而发挥高糖下的细胞保护作用的。此外,胃饥饿素是否在DR的动物模型和患者中也同样发挥保护作用尚不清楚,其作用和分子机制还需要深入研究。
