外泌体在疱疹病毒潜伏中的作用及研究进展
2022-06-02陈彦廷郑从森杨亚慧陈玫婷覃丽梅
陈彦廷,郑从森,杨亚慧,陈玫婷,覃丽梅
(佛山科学技术学院 生命科学与工程学院,广东 佛山 528225)
疱疹病毒是具有囊膜的线状双链DNA 病毒,因代表病毒即单纯疱疹病毒能引起疱疹而得名。疱疹病毒颗粒是直径为150 nm、由162 个壳粒排列组成的二十面体[1],囊膜上有糖蛋白组成的纤突。疱疹病毒主要侵害皮肤、黏膜以及神经组织等,可引起哺乳类、鸟类、爬行类、两栖类、昆虫以及软体动物的疾病,导致淋巴细胞增生及其他病理变化。
根据基因结构和同源性等特征将疱疹病毒分为α、β、γ 三个亚科。α 疱疹病毒亚科内含单纯疱疹病毒1 型(Herpes simplex virus 1,HSV-1)、马立克氏病毒(Marek’s disease,MDV)、鸡传染性喉气管炎病毒(Infectious laryngotracheitis virus,ILTV)、伪狂犬病病毒(Pseudorabies virus,PRV)等,这类病毒增殖速度快并引起细胞病变;β 疱疹病毒亚科内含巨细胞病毒(Cytomegalovirus,CMV)、人疱疹病毒6 型(Herpesviruses 6,HHV-6)等,被这类病毒感染的细胞形成巨细胞,细胞生长周期长;γ 疱疹病毒亚科内含EB 病毒(Epstein-Barr virus,EBV)和卡波西氏肉瘤相关疱疹病毒(Kaposi sarcoma-associated Herpesviruses,KSHV)等,被这类病毒感染的淋巴样细胞可导致淋巴增生等病理变化[2]。
潜伏感染是疱疹病毒的重要特点,疱疹病毒在潜伏期间能逃避机体免疫系统的识别,同时将病毒基因组整合到宿主细胞DNA 中,使病毒进入潜伏感染状态。此时,病毒蛋白表达量很少甚至没有,然而当机体免疫力下降时,病毒可再次激活并快速增殖[3]。不同种类的疱疹病毒在潜伏感染时选择的部位有所不同,包括感觉神经节、角膜、淋巴细胞等。
1 外泌体的结构与功能
外泌体是一类由细胞分泌至体液中的磷脂纳米囊泡,直径介于30 nm~150 nm 之间,大多数不同类型的细胞在生理和病理条件下均可分泌外泌体。1983 年外泌体首次被报道,起初被认为是机体内一种“垃圾车”的机制用于清除细胞不必要的蛋白质[4]。然而随着研究的深入,人们发现外泌体是细胞间信号传递的重要载体,能将宿主细胞中的蛋白质、DNA、mRNA、miRNA 和ncRNA 等活性成分转移至相邻或远端细胞,同时参与机体的免疫应答、血管生成、细胞增殖、肿瘤转移等生理和病理过程[5]。目前发现多种细胞可分泌外泌体,如肿瘤细胞、巨噬细胞、淋巴细胞及内皮细胞等。
由于外泌体是从细胞中释放出来的囊泡,可能被病毒“挟持”,进行细胞间的病毒物质的交换。近些年来,研究发现外泌体在疱疹病毒的潜伏感染中发挥作用,同时被病毒潜伏感染的细胞分泌的外泌体具有控制受体细胞中基因表达和影响细胞活力的能力。还有许多疱疹病毒已进化到能够将病毒组分包裹至外泌体中,通过外泌体的整合和释放,触发下游的级联反应,从而影响疾病的发生、发展进程,如图1 所示。
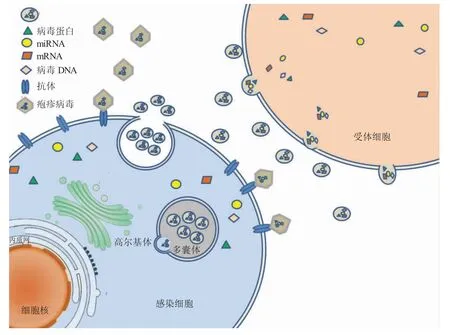
图1 外泌体和靶细胞之间的物质交流
2 外泌体在疱疹病毒潜伏感染中的作用
2.1 外泌体影响EBV 的潜伏
EB 病毒(Epstein-Barr Virus,EBV)感染机体时首先攻击上皮细胞和B 细胞,同时在B 细胞中发生潜伏感染,以逃避宿主的免疫损伤。同时,这些潜伏感染的病毒在机体免疫力低下时可被再激活并增殖,从而引起相应的疾病。不同的潜伏感染模式对不同类型的淋巴系统肿瘤的发生有所影响,但不论是哪种潜伏感染模式,均可通过改变宿主细胞基因转录或组成性活化宿主细胞关键信号通路,诱导宿主细胞的恶性转化。在EBV 感染的机体中,外泌体主要是通过整合或携带病毒编码产物及宿主细胞内的功能性物质,如病毒蛋白、mRNA 和miRNA 等,随后将其递送给未感染细胞发挥调控作用。EBV 在裂解复制期间,感染细胞中病毒DNA 大量复制,并通过外泌体释放到细胞外感染其他细胞。此外,EBV 感染的细胞分泌的外泌体中含有潜伏膜蛋白2A(Latent membrane protein-2A,LMP2A),该蛋白可模拟B细胞受体(BCR)触发的信号,改变正常B 细胞的发育,可见病毒感染细胞分泌的外泌体在病毒潜伏期中发挥关键调节作用[6]。
外泌体可能还会影响与EB 病毒相关疾病的发生和发展,载有EBV 编码产物的外泌体被未感染细胞内化后,多条细胞内信号通路被激活,进而操控细胞的增殖和凋亡,影响细胞的微环境,从而参与EBV相关疾病的发生机制。Keryer-Bibens 等[7]研究发现,EBV 相关NPC 细胞分泌的外泌体中包含EBV 潜伏膜蛋白1(Latent membrane protein-1,LMP-1)和半乳糖凝集素9(Galectin-9),能够抑制T 细胞活化和增殖,导致EBV 相关肿瘤的发生。同时,研究发现,用含有LMP-1 的外泌体处理EBV 阴性细胞,能够诱导上皮-间质转化(EMT),从而促进细胞的迁移和侵袭能力[8]。
2.2 外泌体影响HSV 的潜伏
单纯疱疹病毒(Herpes Simplex Virus,HSV)具有神经细胞嗜性,一旦HSV 感染神经末梢,病毒就能在神经节内将病毒核衣壳通过逆转运的方式从轴突运送到神经细胞以外的地方。HSV 感染3 周后,病毒的复制活性将会显著减弱,此阶段被称为潜伏感染,此时宿主不会出现临床症状;然而当潜伏状态被打破,如紫外线照射、精神状态及压力、激素水平变化、免疫抑制剂的使用、免疫缺陷病毒感染等[9],HSV-1 病毒将从潜伏状态进入重激活状态。此时,病毒开始表达具有功能的病毒蛋白,在神经细胞中组装成具有感染性的病毒颗粒,并沿着轴突方向运输到感染部位并大量复制,从而导致HSV-1 病毒再激活[10]。研究发现,病毒可利用神经元独特的细胞生物学特点建立潜伏感染的物质基础,外泌体可以将HSV-1 编码的糖蛋白B(gB)或gB/ MHC-II 类分子复合物从HSV-1 感染的细胞转移到其他细胞,使受体细胞产生对病毒的免疫反应[11],进而使得神经元成为HSV 的存储库。
当HSV-1 开始进入潜伏阶段,病毒抗原特异性CD8+T 细胞在受感染的神经组织中浸润,并将携带有病毒DNA 的神经元细胞包围住,这些浸润神经组织的CD8+T 细胞具有抑制HSV-1 从神经细胞中再激活的功能[12]。然而,在潜伏感染过程中,HSV-1 所表达的潜伏相关转录本(Latency Associated Transcript,LAT)直接或间接地导致了三叉神经组织中CD8+T 的功能衰竭,从而促进病毒的再激活[13]。LAT 不但可以抑制细胞内HSV-1 裂解靶细胞相关基因的表达,阻止免疫反应导致的宿主细胞死亡,促进HSV-1 建立潜伏感染,还能通过抑制细胞凋亡,使被病毒感染的细胞免于被机体清除,从而达到维持潜伏感染细胞存活的目的[14]。外泌体作为细胞间信号传递的重要载体,可将宿主细胞中的活性成分运送给其他细胞,比如HSV-1 感染的细胞分泌的外泌体可将HSV 潜伏期高表达的LAT 传递给其他细胞,进一步促进或维持HSV 的潜伏感染。
此外,人胚胎肺成纤维细胞(HELF)中的IFI-16 存在于细胞核中,可控制病毒DNA 复制;用siRNA沉默后会增强HSV-1、HSV-2 和HCMV 的复制,推测IFI16 可能是疱疹病毒复制周期中的一种新的限制性因子,可被分泌到外泌体中调控病毒潜伏[15]。
2.3 外泌体影响KSHV 的潜伏
卡波西肉瘤疱疹病毒(Kaposi’s Sarcoma associated Herpes Virus,KSHV)主要感染上皮细胞、内皮细胞、B 细胞和巨噬细胞,一般在感染宿主细胞后24~48 h 进入潜伏期。在潜伏期间,KSHV 绝大多数病毒基因也是停止表达,只表达如ORF73/LANA、ORF72/v-Cyclin、ORF71/v-FLIP 等潜伏期相关基因,而且不释放病毒颗粒[16]。研究发现,KSHV 至少编码11 种过去未发现并在KSHV 潜伏感染的细胞中表达的miRNA,这些miRNA 序列在KSHV 感染的细胞中的表达情况表明,miRNA 介导的RNA 干扰导致宿主细胞mRNA 表达下调可能是建立或维持KSHV 潜伏感染的关键步骤[17]。有报道表明,KSHV 能将某些特定的病毒和细胞成分分泌到外泌体中,被感染的细胞分泌的外泌体优先结合那些参与代谢、翻译和细胞迁移的蛋白质,这些外泌体蛋白可能参与旁分泌或自分泌过程,携带有病毒的遗传物质的外泌体由此可操纵肿瘤微环境,影响肿瘤的发生发展进程。研究发现,KSHV 感染的细胞分泌的外泌体包含有参与重塑上皮粘附连接的蛋白质,表明外泌体可能调节细胞的锚定或运动,有助于维持病毒潜伏感染。潜伏感染时,KSHV 病毒基因的少量表达限制了免疫系统检测到的抗原表位数量,从而逃避宿主细胞的免疫应答,使病毒得以存活。还有研究表明,潜伏感染的细胞可能在所有KSHV 诱导的肿瘤中起着关键作用。
2.4 外泌体影响MDV 的潜伏
马立克氏病病毒(Marek’s Disease Virus,MDV)在易感鸡中的致病过程分为四个阶段:早期溶细胞感染阶段、潜伏感染阶段、晚期溶细胞感染阶段、增殖阶段。病毒感染后约6 天进入MDV 潜伏阶段,此时病毒复制停止,鸡群临床症状消失,淋巴组织内表达的MDV 抗原消失,也检测不到病毒抗原和肿瘤抗原的表达。MDV 潜伏感染主要与CD4+T 细胞有关,在MDV 潜伏感染期间,活化的CD4+T 细胞成为MDV 基因组的储存库,同时被MDV 感染的T 细胞最终会发展成为淋巴瘤细胞,因此T 细胞在MDV感染和致病过程中发挥重要作用,即在MDV 潜伏感染期,病毒基因组可能通过外泌体整合到静息状态下的CD4+T 淋巴细胞中逃逸宿主的免疫监视。
MDV 感染的外泌体中发现含有MDV 的糖蛋白gB、被膜蛋白VP22 及特异性磷蛋白pp38 等[18]。其中,pp38 是MDV 编码的立即早期(Immediately early)蛋白,主要是在B 淋巴细胞和T 淋巴细胞中存在,并能与pp24 结合形成异物二聚体发挥生物活性,而pp38/pp24 二聚体中1.8 kb mRNA 之间的双向启动子参与病毒潜伏,同时发现1.8 kb 转录本家族与MDV 潜伏的诱导和维持有关[19]。
某些宿主细胞因子如IL-6、IL-18、IFNγ 和NO 能促进病毒潜伏的建立和维持。研究发现,巨噬细胞的激活导致机体内IFNγ 水平增加,进而可以刺激NO 的产生,而巨噬细胞源性的NO 对T 细胞有丝分裂反应起抑制作用[20]。在MDV 潜伏感染过程中,NO 通过限制T 细胞活化、增殖和减少活化T 细胞的供应来降低病毒感染细胞的水平。同时,MDV 在潜伏感染期间可诱导一氧化氮合酶(inducible NO synthase,iNOS)的产生,而iNOS 的存在有利于MDV 潜伏感染的建立和维持;iNOS 抑制剂处理细胞后发现病毒载量显著增加[21]。外泌体作为细胞间的传递载体,可能会将这些细胞因子运送到其他宿主细胞,在MDV 潜伏感染的维持和建立中起到一定的作用。
2.5 疱疹病毒影响外泌体的分泌和功能
不同的疱疹病毒对外泌体的分泌也有一定程度的影响。致癌性疱疹病毒(如EBV 和KSHV)感染可能会调节受感染细胞外泌体的含量和功能,进而创造有助于癌症的发展微环境。研究发现,潜伏的疱疹病毒可显著改变外泌体的内容物,如在感染EBV 和KSHV 外泌体中均鉴定出230 种蛋白质是未感染细胞分泌的外泌体中没有的,其中93 种蛋白质对EBV 感染的外泌体具有特异性,而22 种对KSHV 外泌体具有特异性[22]。同时,在双重感染的细胞中还存在其他16 种不同的蛋白质,而在未感染的对照细胞中则没有检测到这些蛋白质,说明外泌体内容物的差异可能是不同种病毒感染特有的[23]。
研究发现,在EBV 感染的机体内,表达LMP1 的上皮细胞产生的外泌体可以被成纤维细胞、上皮细胞和内皮细胞吸收;含LMP1 的外泌体的另一个特性是它们与人脐静脉内皮细胞(HUVEC)的潜在结合增强,同时LMP1 影响参与粘附和细胞通讯的多种细胞蛋白的表达,并对外泌体的成分和功能有所影响[24]。LMP1 以及其他病毒蛋白可能对外泌体的成分和功能产生有效影响,机体在病毒潜伏和慢性感染时,外泌体参与维持病毒感染的持久性[25]。
3 讨论
疱疹病毒可以感染多种物种,不但会威胁人体的生命健康,还会危害到畜牧养殖业的发展。病毒潜伏与病毒感染的持续性以及再感染的发生密切相关,探究外泌体在疱疹病毒潜伏期中的作用,或许有助于深入了解病毒的致病机制。目前可知,外泌体在疱疹病毒的感染和传播中发挥重要的作用。病毒感染细胞后,病毒DNA 大量复制合成,在部分疱疹病毒潜伏期间通过外泌体能将病毒的遗传物质传递至未感染细胞,逃避机体的免疫应答,并维持病毒的潜伏。同时,不同的疱疹病毒也会对外泌体的分泌和功能有影响,以增强病毒自身的潜伏性和持久性。目前对疱疹病毒的研究主要集中在人型疱疹病毒,对其他种属疱疹病毒研究不足,本文对外泌体在部分疱疹病毒中的作用进行整理和总结,可为深入研究外泌体在其他疱疹病毒潜伏感染中的作用提供参考。
