组成型雄烷受体人源化小鼠模型的构建与验证
2022-06-02李海山谢文平周丽丽沈国林宋乃宁陈会明
李海山,谢文平,周丽丽,沈国林,宋乃宁,陈会明
(中国检验检疫科学研究院化学品安全研究所,北京 100176)
代谢综合征是导致糖尿病、心脑血管疾病的危险因素,而糖尿病、心脑血管疾病是社会关注度高、威胁人类健康的重要疾病。国际糖尿病联盟预测2045年世界上约有6.93亿糖尿病患者[1]。组成型雄烷受体(constitutive androstane receptor,CAR)在外源化学物代谢、能量代谢、内分泌激素代谢等过程中发挥重要作用,是机体对外源性化学物暴露的感受器[2-3]。外源性化学物通过对CAR活化特性的激活/拮抗,干扰机体对环境暴露的其他外源化学物代谢过程、内源物质的代谢过程、能量代谢的稳态,进而导致代谢紊乱和毒物-毒物相互作用。在已知的人类核受体超家族中,CAR 对化学物的应答存在显著的物种差异[4],给动物实验测试数据外推到人带来挑战和不确定性。基于CAR 在代谢干扰研究领域的重要性和物种差异特性,构建表达人源化CAR 的动物模型具有重要意义。本研究通过基因编辑技术分别构建CAR基因敲除小鼠模型和表达人源CAR全序列转基因小鼠模型,杂交得到不表达小鼠自身CAR、仅表达人源CAR的小鼠模型,并对其表达水平、剪接变异体、物种特异性化学物应答等特征开展鉴定和有效性评价。
1 材料与方法
1.1 实验动物 野生型C57BL 小鼠,8 周龄,雌性10只用于繁育,雄性20只用于繁育和实验,购自北京维通利华实验动物技术有限公司(生产许可证号SCXK[京]2021-0006)。动物常规喂养于独立通风笼具,自由饮水;光照12 h,黑暗12 h,温度21~26 ℃,日温差不超过4 ℃,相对湿度40%~70%。CAR基因敲除小鼠模型由赛业(广州)生物技术有限公司按设计方案实施,表达人源CAR全序列转基因小鼠模型由中国医学科学院实验动物研究所按设计方案实施。获得的阳性首建鼠在本课题组实验室繁育、杂交和鉴定。
1.2 主要仪器及试剂 荧光定量聚合酶链反应(PCR)仪(美国ABI公司),超速低温离心机(德国Sigma 公司),超低温冰箱(日本Sanyo 公司),核酸分析仪(美国Thermo Fisher Scientific公司)。
6-(4-氯苯基)咪唑并[2,1-b][1,3]噻唑-5-甲醛-O- (3,4-二氯苯基) 肟(CITCO,CAS号:338404-52-7)、1,4-双-[2-(3,5,二氯吡啶氧基)]苯(TCPOBOP,CAS号:76150-91-9)、橄榄油(美国Sigma 公司),Trizol、反转录试剂盒及SYBR预混试剂盒(日本Takara公司),组织裂解液(北京维通达生物技术有限公司)。
1.3 方法
1.3.1CAR基因敲除小鼠模型的构建 按照转录激活因子样效应物核酸酶(transcription activatorlike effector nuclease,TALEN)方法构建。剪取4周龄鼠尾尖于组织裂解液中。扩增CAR-KO上游引物:5′-TAACCCACAGAAGAAGGCTATGCCC-3′,CAR-KO 下游引物:5′-CATACCAGTCTTTAATCGGAGACCGG-3′,野生型小鼠扩增片段长度为370 bp,单向测序引物:5′-GGTCTGACTTACCGAGCGAGCAC-3′。
1.3.2 表达人源CAR全序列转基因小鼠模型的构建 按照细菌人工染色体大片段序列转基因方法构建。细菌人工染色体克隆RP11-297K8 含人源CAR全长序列,长度173 000 bp。剪取4 周龄鼠尾尖于组织裂解液中。扩增阅读框前区(Up)上游引物:5′-CCAGGAAGTCAGCAGAAGAGG-3′,Up下游引物:5′-GGAAGAGAAGAAGGGTGGGA C-3′,产物长度435 bp;阅读框区(CAR)上游引物:5′-CAGCGCATTAAAGTGGTAGCC-3′,CAR下游引物:5′-GCCTAGGTGACAGAGCAAGAAC-3′,产物长度301 bp;阅读框后区(Down)上游引 物:5′-CCACGCCCAGACTGACTTATTAC-3′,Down 下 游 引 物:5′-GGAGAATCGCTTGAACCAGG-3′,产物长度314 bp。
1.3.3 肝、肠组织CAR基因表达水平和肝组织人源CAR剪接变异体丰度 采用荧光定量PCR 法。取8周龄雄性野生型、CAR人源化小鼠各3只,二氧化碳麻醉处理后,摘取肝、肠组织,剪取来源于3个人体的人肝组织块(该数据为第一作者在美国从事博士后研究期间在马里兰大学药学院使用实验室保存的人肝组织块总RNA 测试),按照Trizol试剂盒的操作要求提取总RNA,采用分光光度计在260 nm 和280 nm 波长处测定其光密度值,验证总RNA的浓度与纯度。按照反转录试剂盒操作说明,将样本中的mRNA转录为互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA)。应用实时定量PCR 仪,测定各样本等质量总RNA的mRNA的循环阈值(cycle threshold,Ct)值。小鼠CAR上 游 引 物: 5′- CCCTGACAGACCCGGAGTTA-3′,小鼠CAR下游引物:5′-GCCGAGACTGTTGTTCCATAAT-3′;人源CAR上游引物:5′-GAGCTGAGGAACTGTGTGGTA-3′,人源CAR下游 引 物:5′-CTTTTGCTGACTGTTCTCCTGAA-3′;人源CAR剪接变异体SV02(扩增0、2 型共用)上游引物:5′-AGATGGAGCCCGTGTGGG-3′;SV13(扩增1、3型共用)上游引物:5′-GAAGATGGAGCCCGTGTATCTC-3′;SV4(扩增4 型专用)上游引物:5′-AGATGGAGCCCGTGACCG-3′;SV01(扩增0、1 型共用)下游引物:5′-GGTAACTCCAGGTCGGTCAGG-3′;SV23 (扩 增2、3 型共用)下游引物:5′-AACTCCAGGTCGGTCTGTAAGAT-3′;SV4(扩增4型专用)下游引物:5′-TGCTGGCCCTTGATGTAGCT-3′。
1.3.4 物种特异性激活剂应答反应 通过比较给予激活剂后肝组织CAR典型靶基因细胞色素P450(cytochrome P450,CYP) 2B和3A相对表达水平。8周龄雄性野生型、CAR基因敲除小鼠、人源化CAR小鼠各9只,分为对照、TCPOBOP、CITCO组,每组3只。对照组腹腔注射橄榄油10 ml/kg体重,连续3 d,于末次注射24 h后二氧化碳麻醉处死小鼠,摘取肝组织;TCPOBOP用橄榄油配制为0.3 mg/ml 溶液,单次腹腔注射3 mg/kg 体重,注射72 h 后取小鼠肝组织;CITCO 用橄榄油配制为2 mg/ml溶液,腹腔注射20 mg/kg体重,连续3 d,于末次注射24 h 后取小鼠肝组织。CYP2B上游引物:5′-TCCTGACCAGTTCCTGGATG-3′,CYP2B下 游引 物:5′-CTGGAGGATGGACGTGAAGAA-3′,扩增产物长度162 bp;CYP3A上游引物:5′-GTCAAACGCCTCTCCTTGCTG-3′,CYP3A下 游引物:5′-GGCTTGCCTTTCTTTGCCTTC-3′,扩增产物长度277 bp;内参照基因β-actin上游引物:5′-GGCTGTATTCCCCTCCATCG-3′,β-actin下游引物:5′-CCAGTTGGTAACAATGCCATGT-3′,扩增产物长度181 bp。以目的基因与内参照基因计算目的基因相对表达水平,相对表达量=2-△△Ct。
1.4 统计学方法 采用SPSS 22.0 软件进行统计学分析,符合正态分布的计量资料以均数±标准差表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1CAR基因敲除小鼠鉴定结果 经测序鉴定,其CAR外显子区缺失10 bp 碱基序列(GATATCAACA),见图1加框部分。

图1 CAR基因敲除小鼠测序
2.2 人源CAR转基因小鼠鉴定结果 经特异性引物扩增片段鉴定,人源CAR转基因小鼠基因组中扩增出人源CAR基因片段,细菌人工染色体中CAR序列、上游、下游片段,典型鉴定结果见图2。

图2 人源CAR转基因小鼠特异片段扩增鉴定
2.3 野生型、CAR基因敲除、CAR人源化小鼠肝、肠组织CAR基因表达水平CAR基因敲除小鼠肝、肠组织不表达任何CAR;野生型小鼠肝组织鼠源CAR表达水平为(24.1±1.2),与CAR人源化小鼠人源CAR的表达水平(23.8±1.4)接近;野生型小鼠肠组织的鼠源CAR表达水平为(25.6±1.5),而CAR人源化小鼠人源CAR表达水平为(30.6±2.1),差异有统计学意义(P<0.01)。
2.4CAR人源化小鼠肝组织CAR剪接变异体表达丰度 对人源5 种主要CAR 剪接变异体(SV0-SV4)的肝表达丰度与人肝组织丰度相比较,结果显示二者此5 种主要CAR 剪接变异体肝组织表达丰度非常接近。见图3。
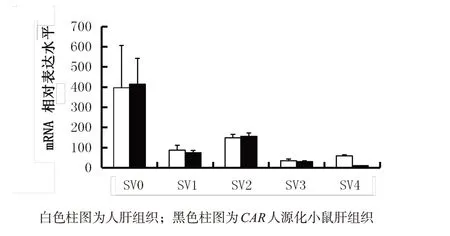
图3 CAR人源化小鼠肝组织与人肝组织主要CAR剪接变异体丰度
2.5 物种特异性激活剂应答 野生型、CAR基因敲除、CAR人源化小鼠肝组织CAR 两种典型靶基因(CYP2B、CYP3A)在给予物种特异性激活剂CITCO(人源CAR 激活)、TCPOBOP(鼠源CAR激活)与相应溶剂对照组相对表达水平,野生型小鼠给予TCPOBOP后肝组织2种靶基因表达水平显著诱导,此种诱导效应在CAR基因敲除小鼠完全消失;CAR人源化小鼠仅对人特异性激活剂CITCO 产生应答,肝组织细胞色素P450 2B、3A表达显著升高,见表1。

表1 小鼠物种特异性激活剂应答(n=3)
3 讨论
本研究构建了CAR基因敲除小鼠和人源CAR转基因小鼠,杂交获得了CAR人源化小鼠。构建的CAR人源化小鼠主要优点:转入基因片段包含CAR基因全序列及上下游调控序列,表达水平与鼠CAR相当(生理水平表达);肝组织表达人CAR主要剪接变异体,其表达丰度与人肝组织相当[5];主要脏器CAR表达模式与人相当,不同于小鼠CAR脏器分布(人CAR优势表达于肝脏,小鼠CAR优势表达于肝脏和小肠)[6]。
在已知的人类48种核受体中,CAR配体结合域基因序列在人与常用实验动物大鼠、小鼠之间差异最大[4],因此对外源化学物的应答表现出显著的物种特异性,常被用作物种特异性的工具化学物CITCO特异性激活人源CAR,对大鼠、小鼠CAR均无明显作用[7];反之,TCPOBOP则特异性激活鼠源CAR,对人源CAR无明显作用[8]。本研究建立的CAR 人源化小鼠表现出期望的表型。目前国际上高通量筛选平台对数万种化学物样本库进行了CAR 活性的体外筛选[9],但由于化学物在体内经过吸收、分布、代谢、排泄复杂过程,尤其是经过生物转化作用生成一系列的代谢物,亟待开发有效的体内模型进行验证。化学物安全性评价动物实验最常使用的啮齿类动物是大鼠,机制研究使用小鼠也较普遍,由于化学物对CAR 活性调节的物种差异,很可能过高估计或过低估计化学物的毒理学效应,尤其代谢干扰效应介导的有害结局。应用本研究构建的CAR 人源化小鼠有助于对关注的化学物体外筛查结果进行体内验证,为风险评估过程中物种差异的不确定度评价提供科学依据。
机体代谢稳态主要通过一类称为外源物核受体或代谢核受体的转录因子超家族而发挥作用,CAR是其中重要的成员,与孕烷X受体(pregnane X receptor,PXR)、过氧化物酶体增殖物激活受体(peroxisome proliferators activated receptors,PPARs)、芳烃受体(aryl hydrocarbon receptor,AhR)等共同构成调控网络,2007年美国国家研究委员会(NRC)将PXR/CAR/PPAR/AhR 途径列为体外测试毒性途径之一[10]。近年来毒理学界有害结局路径(Adverse outcome pathway,AOP)概念及框架方兴未艾,CAR 在促癌、胆汁淤积等AOP中发挥重要作用,受到广泛重视[11]。由于这些调节子呈现网络调控,尤其PXR与CAR作用和激活剂之间更是密切关联,本课题组对PXR 也开展了基因编辑模式动物的工作,将产生PXR/CAR人源化小鼠,提供深入研究的有力工具。
