脐带间充质干细胞移植对卵巢早衰模型小鼠卵巢功能的影响
2022-06-02赵淑颖郭广玲董斯睿龚琴琴刘晨晨计璐伟
赵淑颖,郭广玲,董斯睿,张 超,龚琴琴,刘晨晨,计璐伟
卵巢早衰(premature ovarian failure,POF)是指女性在40岁前由于卵巢内卵泡耗竭或被破坏,或因手术切除卵巢而发生的卵巢功能衰竭,且以低雌激素及高促性腺激素为特征,并会造成停经、雌孕激素缺乏、骨质疏松、胆固醇增高和皮肤缺乏弹性、乳腺萎缩、抑郁等症状[1]。POF在40岁以上女性发病率为1%~2%,且近年来呈上升和年轻化趋势[2]。POF病因复杂,主要由于遗传因素、自身免疫性疾病、环境因素、医源性损伤(放射治疗、化学治疗、手术)或特发性原因引起[3]。目前对于POF的治疗措施主要包括雌孕激素替代疗法、基因疗法、促排卵治疗、免疫治疗及卵巢移植等,中医治疗方法有辨证论治和针灸治疗等。这些治疗方法虽然对POF的临床症状具有一定的缓解作用,但尚无法从根本上修复受损的卵巢功能;此外许多治疗方法有较多的不良反应,因此现阶段针对POF无完全有效的治疗方法[4]。因此亟需寻求一种新的治疗方案。而干细胞的出现给研究学者带来很大希望。人脐带血间充质干细胞 (human umbilical cord mesenchymal stem cells,hUCMSCs)对人体组织和器官有修复再生的能力,且没有医学伦理的困扰[5]。有研究表明,间充质干细胞可在卵巢中定向迁移到受损的部位,在小鼠模型中被证明可以恢复卵巢功能并改善生育能力[6]。hUCMSCs还具有强增殖分化能力、低免疫原性、易于分离扩增、病毒和微生物的感染概率低、采集方便等优势,因其显著优点而成为理想的干细胞来源。笔者应用hUCMSCs移植治疗由环磷酰胺(cyclophosphamidec,CTX)导致的小鼠POF。
1 材料与方法
1.1 实验材料
1.1.1 实验动物与细胞
选择SPF(specific pathogen free)级ICR(Institute of Cancer Research)雌性小鼠40只,鼠龄8周,体质量25~30 g。均由湖北医药学院动物中心提供,动物使用许可证号SYXK(鄂)2019-0031。给予全价营养饲料,保持室温为21℃~25℃、相对湿度50%~70%的条件下,每天光照12 h,自由饮食水,适应性喂养1周;实验前进行小鼠阴道脱落细胞涂片,将动情周期正常38只小鼠纳入实验,排除2只无正常动情周期小鼠。
hUCMSCs原代细胞由武汉中源协和有限公司提供。
1.1.2 主要试剂与仪备
CTX(粉剂,每支200 mg)(苏恒瑞医药股份有限公司,中国);苏木精染液、伊红染液及4%多聚甲醛溶液(福州飞净生物科技有限公司,中国)。酶联免疫吸附分析(enzyme-linked immunosorbent assay,ELISA)试剂盒(上海笃玛生物科技有限公司,中国)。
光学显微镜(BX53+DP74。奥林巴斯,日本);全自动染色机(达科为生物技术股份有限公司,中国)、切片机[徕卡显微系统(上海)有限公司,中国];InfintiteF50酶标仪(奥地利);离心机(飞鸽,中国)。
1.2 方法
1.2.1 细胞培养
取原代hUCMSCs,吸弃多余的培养液,继而放于37℃、体积分数5%CO2中继续培养,直至细胞贴壁到达90%以上。取对数生长期细胞进行冲洗、胰蛋白酶消化,血清进行消化终止。离心、去除上清液后,将细胞配成2×106/mL单细胞悬液备用。
1.2.2 动物分组、建模
将SPF级ICR小鼠采用SPSS生成随机数字的方法分成3组,空白对照组(正常小鼠)10只,POF模型组(POF组)与hUCMSCs实验组(hUCMSCs组)各14只。空白对照组不做任何处理;POF组与hUCMSCs组小鼠每天均腹腔注射CTX 70 mg/kg[7],连续给药15 d。以动情周期紊乱和动情间期延长为判断建模成功的标准。
1.2.3 给药方案与检测
建模成功后第1天,hUCMSCs组经尾静脉注射hUCMSCs进行治疗,POF组注射同等剂量的0.9%氯化钠溶液(生理盐水)。3组在hUCMSCs移植后的7 d、14 d分别进行小鼠眼眶采集静脉血并分离血清和摘取卵巢组织,检测各项指标。
1.2.4 观察指标
1.2.4.1 一般状态及动情周期 记录小鼠的皮肤毛泽、饮食、排便及活动情况,记录体质量。建模期间每天8:00~9:00用自制棉签在小鼠阴道内轻轻旋转2~3圈;将小鼠阴道脱落细胞平铺于载玻片上进行染色,在光学显微镜下观察动情周期情况。
1.2.4.2 激素测定 采集建模完成后当天和移植hUCMSCs后7 d、14 d各组小鼠眼眶静脉血,于3 000 r/min条件下离心10 min;分离血清于-20℃条件下保存。用ELISA试剂盒检测雌激素(estrogen,E2)、卵泡刺激素(follicle stimulating hormone,FSH)、抗苗勒管激素(anti-müllerian hormone,AMH)水平。
1.2.4.3 卵巢组织学形态 取各时期不同组的小鼠颈椎脱臼处死,摘取双侧卵巢组织与子宫组织;将一侧卵巢放于-80℃冰箱备用,另一侧卵巢组织及子宫放于4%多聚甲醛溶液中4℃条件下固定72 h;制备5μm切片,每隔10张取1片。用苏木精-伊红(hematoxylin-eosin,HE)染色后,在光学显微镜下观察子宫、卵巢组织及各级卵泡[6],分别计算原始卵泡、初级卵泡、次级卵泡、闭锁卵泡。
1.3 统计学方法
采用SPSS 16.0统计软件进行统计学分析。数据以均数±标准差表示,采用单因素方差分析联合Bonferroni法进行差异性比较。P<0.05为差异有统计学意义。
2 结果
2.1 3组小鼠的一般情况和动情周期比较
空白对照组小鼠活动灵敏,皮毛光泽度等无明显异常表现,对外界刺激的反应性好,灵活性强。POF组小鼠活动明显减少、精神萎靡、摄食减少、皮毛光泽度下降等变化。hUCMSCs组在hUCMSCs移植后,小鼠活动度有所增加、反应灵敏、摄食量增加、皮毛有光泽等。POF组、hUCMSCs组在注射CTX后均发生动情周期紊乱,表现为动情间期延长。
2.2 3组小鼠体质量变化比较
建模完成后,POF组和hUCMSCs组小鼠体质量与空白对照组比较均明显降低,差异有统计学意义(P<0.05);而POF组小鼠体质量与hUCMSCs组比较,差异无统计学意义(P>0.05)。hUCMSCs移植后7 d及14 d,hUCMSCs组小鼠体质量明显增加,与POF组比较,差异均有统计学意义(P<0.05)。见表1。
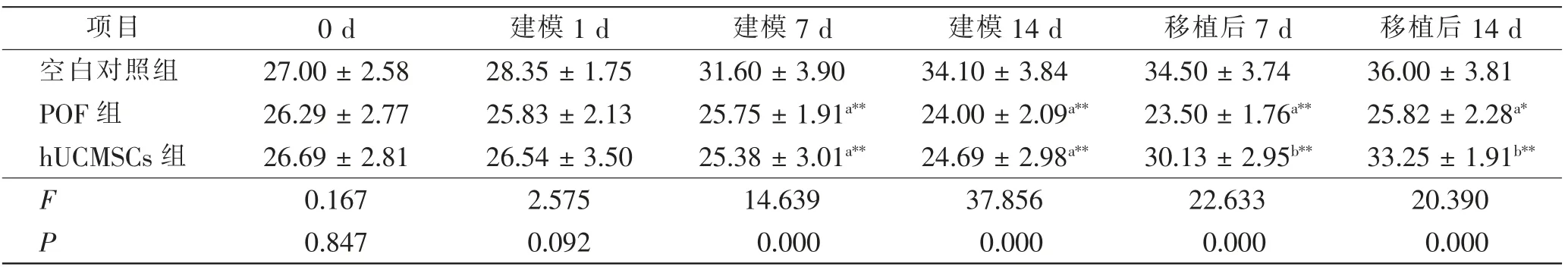
表1 3组小鼠hUCMSCs移植前后体质量水平变化比较Tab.1 Comparison of body mass changes before and after hUCMSCs transplantation in 3 groups
2.3 3组小鼠血清雌激素水平比较
建模完成后,POF组、hUCMSCs组血清E2均明显降低,与空白对照组比较,差异均有统计学意义(P<0.05)。hUCMSCs移植后7 d及14 d,hUCMSCs组与POF组比较,差异无统计学意义(P>0.05)。见表2。
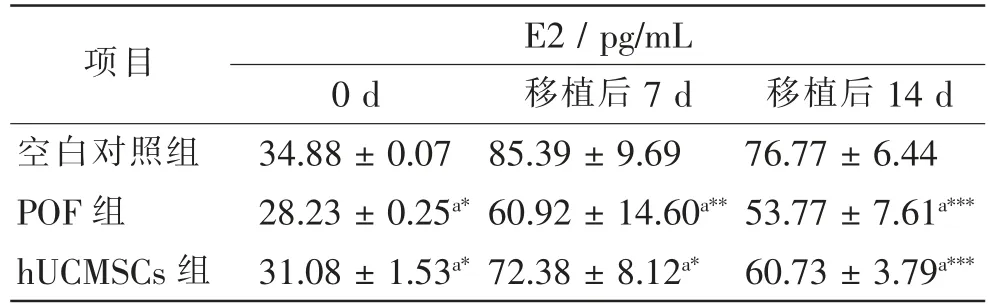
表2 3组小鼠hUCMSCs移植前后E2水平变化比较Tab.2 Comparison of E2 levels before and after hUCMSCs transplantation in 3 groups
2.4 3组小鼠血清卵泡刺激素水平比较
建模完成后,POF组、hUCMSCs组血清FSH均高于空白对照组,差异均有统计学意义(P<0.05)。与7 d空白对照组相比,其14 d的FSH下降10.08%,POF组下降4.65%,hUCMSCs组下降3.28%。hUCMSCs移植后7 d,hUCMSCs组血清FSH水平与POF组比较,差异无统计学意义(P>0.05);与空白对 照组比较,差异有统计学意义(P<0.05)。hUCMSCs移植后14 d,hUCMSCs组血清FSH水平明显降低,与POF组比较,差异有统计学意义(P<0.05);与空白对照组比较,差异有统计学意义(P<0.05)。见表3。

表3 3组小鼠hUCMSCs移植前后FSH水平变化比较Tab.3 Comparison of FSH levels before and after hUCMSCs transplantation in 3 groups
2.5 3组小鼠血清抗苗勒管激素水平比较
建模完成后,与空白对照组比较,POF组与hUCMSCs组血清AMH均降低,差异有统计学意义(P<0.05)。与7 d空白对照组相比,其14 d的AMH下降25.44%,POF组下降22.29%,hUCMSCs组下降16.16%。hUCMSCs移植后7 d,hUCMSCs组血清AMH水平与POF组比较,差异无统计学意义(P>0.05);hUCMSCs移植后14 d,hUCMSCs组血清AMH水平下降,与POF组比较,差异有统计学意义(P<0.05);hUCMSCs组血清AMH水平与空白对照组比较,差异无统计学意义(P>0.05)。见表4。

表4 3组小鼠hUCMSCs移植前后AMH水平变化比较Tab.4 Comparison of AMH levels before and after hUCMSCs transplantation in 3 groups
2.6 3组小鼠卵巢组织结构改变及卵泡计数比较
空白对照组小鼠卵巢皮质及髓质结构清晰,各级卵泡排列有序,且颗粒细胞排列整齐、层次多。POF组可见卵巢组织萎缩,卵巢结构混乱,颗粒细胞层排列凌乱甚至死亡,卵巢间质严重纤维化,功能卵泡数目明显减少,闭锁卵泡增多。hUCMSCs组可见卵巢组织的形态和结构均有恢复,间质纤维化减少,功能卵泡增多,均优于POF组。见表5、图1。

图1 3组小鼠hUCMSCs移植后卵巢组织HE染色结果(HE,100×)Fig.1 HE staining images of ovary tissue after mice hUCMSCs transplantation in 3 groups(HE,100×)

表5 3组小鼠hUCMSCs移植后卵泡计数比较Tab.5 Comparison of follicle counts after hUCMSCs transplantation in 3 groups

续表5Continous Tab.5
2.7 hUCMSCs移植后对小鼠子宫组织的影响
空白对照组子宫内膜发育良好,间质疏松,腺体丰富。POF组小鼠子宫内膜发育不良,间质血管明显减少、腺体数量少。hUCMSCs移植后,hUCMSCs组子宫腺体和血管数量明显增加。见图2。
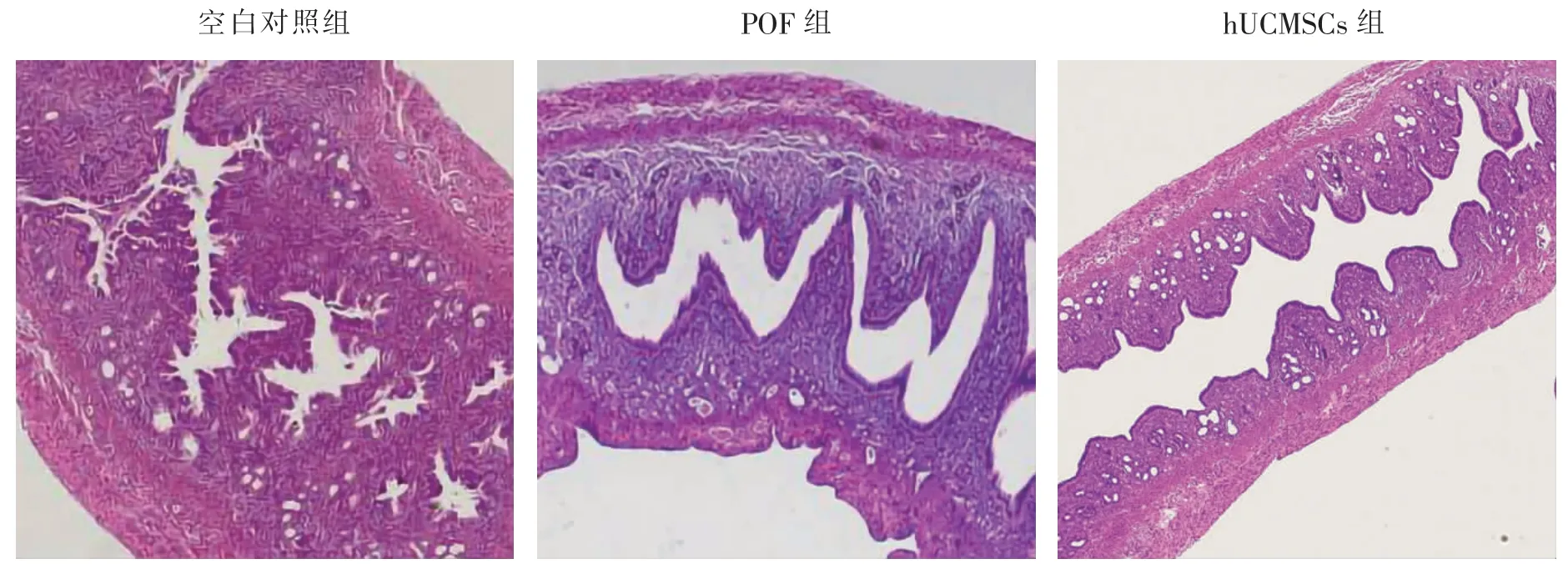
图2 3组小鼠hUCMSCs移植后子宫组织HE染色结果(40×)Fig.2 HE staining images of uterus tissue after mice hUCMSCs transplantation in 3 groups(40×)
3 讨论
干细胞治疗相比起传统、冗长的药物治疗,不仅效果显著,也能缩短整个治愈周期。间充质干细胞能够分泌有利机体生长、更新和修复的细胞因子及外泌体,促进损伤组织的修复,同时还具有抑制炎症及双向免疫调节的功能。干细胞的归巢效应,可以优先向炎症区域和损伤的组织归巢,从而更好地发挥血管生成、抗氧化应激、抗炎作用[8]。有研究表明hUCMSCs可为女性子宫内膜疾病[9]、卵巢癌[10]、不孕症[11]等妇科疾病临床治疗提供新的种子细胞,为开辟治疗妇科疾病的新途径提供了理论依据。
CTX是临床中常用于非特异性细胞周期抗癌药物的烷化剂,具有很高的生殖毒性,对卵巢组织造成不可逆的损伤[12]。有研究报道,当CTX的剂量达到100 mg/kg时,可造成卵巢内卵泡数量减少一半以上[13]。Liu TE等[7]报道在单次腹腔注射CTX(70 mg/kg),在第14天后卵巢质量没有明显变化。Sun M等[14]报道,腹腔注射CTX(50 mg/kg)连续15 d后,POF小鼠在1个月内体质量与正常小鼠相比仍然较低。笔者实验采用腹腔注射CTX后,小鼠出现E2、AMH水平明显降低,FSH水平明显升高,卵巢萎缩,间质纤维化严重,各级卵泡数的降低,闭锁卵泡数目增加。说明笔者实验建立的动物模型符合POF的激素水平状态和组织学形态。Mohamed SA等[15]研究发现,在移植hUCMSCs后,可通过旁分泌途径改善卵巢微环境的状态,提高E2水平,降低FSH的水平,减少闭锁卵泡,修复卵巢组织。Yin N等[16]研究发现,小鼠在移植hUCMSCs后,可表达血红素加氧酶-1(heme oxygenase-1,HO-1)基因,通过激活应激活化蛋白激酶(c-Jun N-terminal kinase,JNK)/B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)信号通路调控CD8+、CD28-T细胞的增殖分化,促进hUCMSCs移植后POF小鼠卵巢功能的恢复。笔者研究结果表明,与7 d空白对照组相比,其14 d的FSH下降10.08%,POF组下降4.65%,hUCMSCs组下降3.28%。可能由于机体FSH持续刺激卵巢,通过负反馈作用降低小鼠体内E2水平,进而加速了卵巢促性腺激素受体活性,减少卵巢对FSH的敏感性,造成改善卵巢功能作用减弱,会引起卵泡质量及数量减少,进而影响其卵巢恢复的时间。同时说明可增加干细胞移植次数、剂量及提高归巢率增加其利用率,可能会改善FSH持续刺激卵巢,可减缓颗粒细胞的凋亡和抑制卵泡闭锁,促进卵巢微环境改变。
AMH是由卵巢中颗粒细胞分泌的一种糖蛋白,AMH可通过抑制卵泡的募集,降低卵泡对促卵泡雌激素的敏感性,减少优势卵泡的形成,减慢卵泡池的过快衰竭[17]。由于AMH水平不随月经周期的变化而变化,检测稳定性优于其他性激素,AMH水平具有很好的周期内和周期间的稳定性,可以很好地预测卵巢的反应[18]。笔者实验显示,在hUCMSCs移植后14 d,hUCMSCs组血清AMH明显得到改善;与7 d空白对照组相比,其14 d的AMH下降25.44%,POF组下降22.29%,hUCMSCs组下降16.16%。结果说明,hUCMSCs移植后AMH水平明显得到改善。分析原因是hUCMSCs可抑制卵巢颗粒细胞凋亡,恢复卵巢激素水平,促进不同阶段卵泡细胞的发育,对化学治疗药物诱导的POF修复卵巢功能的作用得到强化。有项研究报道在移植间充质干细胞后可抑制POF大鼠卵巢颗粒细胞的凋亡并改善卵巢功能储备。
笔者研究结果说明hUCMSCs移植可以改善由化学治疗药物造成的卵巢储备功能下降的状况。hUCMSCs移植可改善卵巢微环境的状态,从而可以提高E2,降低FSH的水平,改善卵泡功能。尽管hUCMSCs移植能有效缓解卵巢功能的下降,但能否使其卵巢功能恢复到年轻小鼠水平,仍需进一步的实验。
目前干细胞移植存在的问题:①移植细胞计数的最优选择,细胞在外界的活性及在体内存活率;②干细胞移植后在小鼠卵巢内发挥最大效应的时间;③干细胞移植后不能排除这些细胞的致瘤性,也不能评估幼鼠是否会出现异常、突变等情况[19]。
综上所述,hUCMSCs移植可促进卵巢组织的修复,抑制颗粒细胞的凋亡,提高卵巢功能,进而改善卵巢的储备。此外,hUCMSCs移植改善POF小鼠卵巢功能的机制尚不完全清楚,仍需开展更深入的研究,为POF提供最有效的最新的途径。
