SALL4蛋白表达在肝细胞癌和肝良性病变区分中的价值
2022-06-02闫春伟田立蕊
肝细胞癌(HCC)是最常见的肝脏恶性原发肿瘤,区分肝癌和肝良性病变对患者病情预测及管理具有非常重要的价值。甲胎蛋白(AFP)是HCC较为常见的血清诊断标志物,但AFP也常见于其他肿瘤患者中,缺乏足够的敏感度和特异性
。婆罗双树样基因-4(SALL4)已被广泛用作多数生殖细胞瘤(GCTs)标志物,包括原发性和转移性病症
。SALL4是位于染色体20q13.13-13.2中的一个锌指转录因子,在维持胚胎肝细胞的自我更新和多能性方面发挥着重要作用
。研究表明,SALL4蛋白能在体细胞癌中表达,其中包括原发癌(高达95%)、转移性胃腺癌(33%)和经常转移的食管和结肠腺癌(分别高达20%及8%)
。然而,在HCC中发现SALL4蛋白表达,说明SALL4蛋白存在潜在的诊断价值。本研究采用免疫组化分析SALL4蛋白在肝癌中的表达,旨在分析其在恶性和良性肝脏病变中的诊断价值。
运用SPSS 21.0的统计学软件,进行数据统计分析,计数资料用“%”表示,采用x2检验,计量资料患用(±s)来表示,以(P<0.05)作为差异具有统计学意义。
1 资料与方法
1.1 研究对象 选取入住我院的HCC和肝良性病变患者113例,采用Edmondson-Steiner分级对HCC患者进行疾病分级。本研究经相关医学伦理学会审批通过且患者及家属签署知情同意书。
1.2 纳入及排除标准 纳入标准:①年龄≥18岁的患者;②病理显示HCC;③包括肝腺瘤和局灶性结节增生患者。排除标准:①患有多发性肿瘤疾病的患者;②患者病例资料缺失或不愿意提供资料者;③患者怀孕或处于哺乳期。
1.3 方法
1.3.2 ShRNA SALL4转染 ShRNA抑制采用GIPZ慢病毒ShRNA靶向人SALL4(Waltham,MA),慢病毒表达SALL4 Sh’RNA颗粒在HEK293T细胞中产生。采用稳转方式,按照每孔8×10
Hu7人HCC细胞数量接种于6孔板中,且每孔加入2 ml不含抗生素的细胞培养基;孵育过夜后,离心弃去培养基,并加入1 ml含有慢病毒颗粒(在10 μg/ml聚凝胺中)的培养基;继续培养24 h后,离心除去培养基,并在每孔中加入2 ml新鲜的培养基;48 h后,弃去培养基,在每孔中加入含有2 mg/ml的嘌呤霉素;每3~4天更换1次以作菌株选择,这样经过2周的霉素筛选后获得单一菌株。
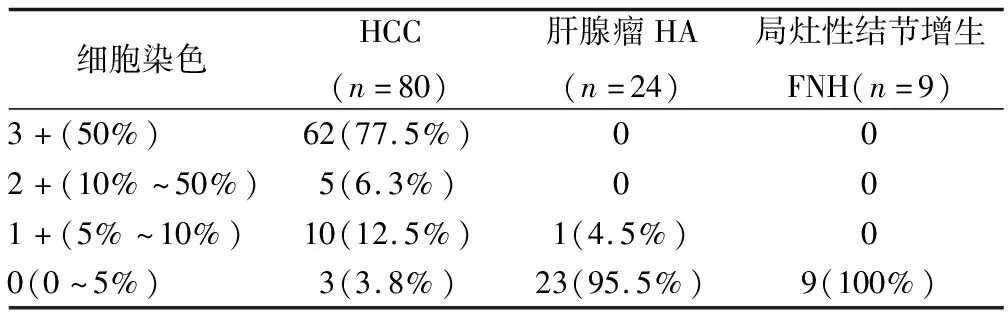
1.3.1 免疫组化分析 SALL4蛋白表达的检测采用免疫组化分析。免疫反应采用半定量评估法,阴性为0(0~5%细胞染色),弱阳性为1+(5%~10%细胞染色),阳性为2+(10%~50%细胞染色),强阳性为3+(50%以上细胞染色),其中染色强度为0~3+。邻近的肝组织为良性肝细胞癌的切片,也进行了百分比评估细胞染色。
2.1 患者一般临床指标 见表1。
1.4 统计学方法 采用SPSS 20.0软件进行数据分析。计量数据以表示,计数资料数据以%表示。计量指标采用独立样本
检验进行组间比较;计数指标采用卡方检验进行组间比较(必要时辅以精确概率法直接计算
值);采用向采用Spearman相关性分析探究SALL4与肝病变类型,HCC分级及分期的相关性。
<0.05表示差异有统计学意义。
(2)教学内容可重复使用。除了时空自主性强外,异步在线教育也是信息网络时代教育资源的组成部分。大量传统教学资源上传后,形成优秀教学案例的共享空间,是对传统课堂教学的延伸,是传播和扩大优质教学内容及教学方法的重要方式。
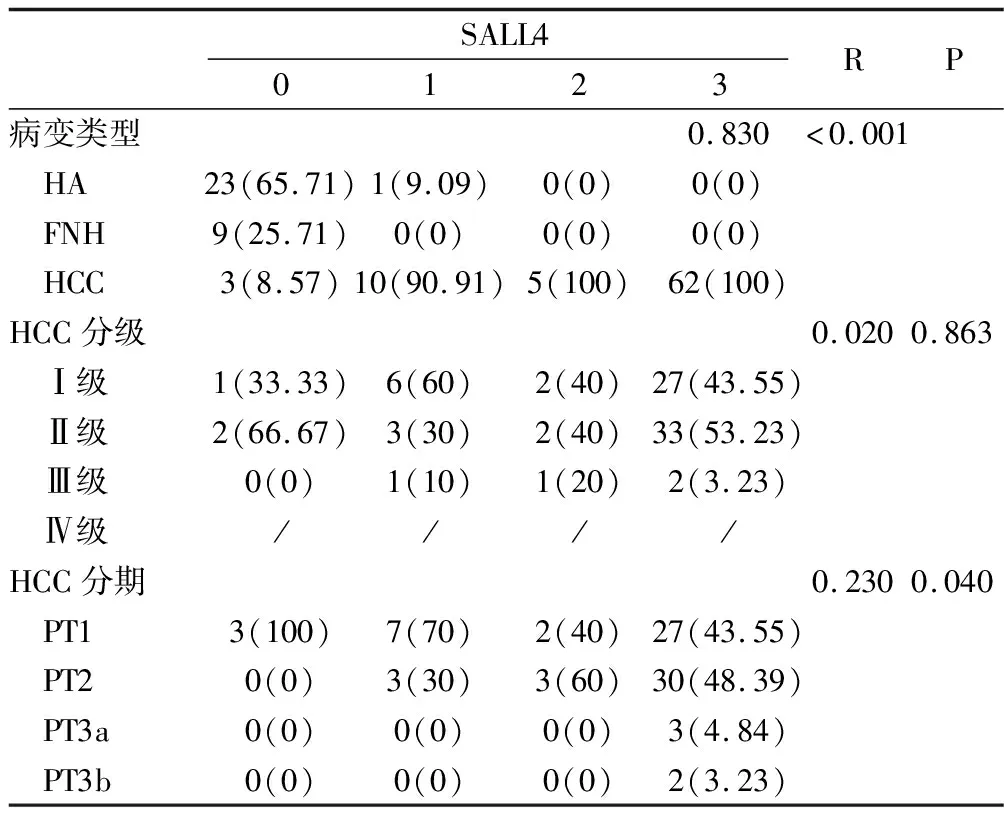
2.3 SALL4在肝癌病变中染色等级与肿瘤分期的相关性分析 见表3。病变类型与SALL进行Sprarman相关性分析显示,病变类型与SALL4呈正相关(
=0.830,
<0.001);而从HCC分级来看,主要存在于1级和2级,HCC分级与SALL4经Spearman相关性分析显示,两者未见统计学相关(
=0.863)。HCC分期与SALL进行Sprarman相关性分析显示,病变类型与SALL4呈正相关(
=0.230,
=0.040)。
2 结果
1.3.3 蛋白提取和免疫印迹分析 采用常规方法操作。
2.2 HCC和良性肝癌组织中SALL4蛋白表达 半定量分析SALL4染色显示结果显示,在HCC细胞中发现强而弥散的胞质和局灶性核SALL4阳性染色77例(96.25%),其中包括62例强阳性,染色和5例阳性,染色和10例弱阳性,染色局灶性阳性,而另外3例(3.8%)无染色现象,见表2和图1。

机械设计制造与自动化技术在应用中,基础参数的准确性为主要的影响因素。以质检参数为基准进行分析,如机械配件生产中螺帽合格内径规格尺寸为20mm,系统错误设定为25mm,则极大的影响了自动化技术的应用效果,同时对于系统生产运行的安全性也造成了较大的影响。因此实际分析机械设计制造与自动化技术在应用中,落实基础参数的准确性则为重要的注意事项。

分析乾隆南巡期间排名前十的游览景观,杭州以西湖、孤山和云栖3处景观列在首位,苏州和镇江都以2处景观即寒山和灵岩山、金山和焦山并列第二,江宁、扬州和常州各以1处景观即栖霞山、大明寺、惠山位居第三。此外,苏州的虎丘是乾隆帝赋诗吟诵的重要景观,扬州的天宁寺和高旻寺、杭州的织造府行宫是乾隆帝题联赐匾的重要景观。
2.4 ShRNA介导人Hu7 HCC细胞中SALL4沉默 采用ShRNA干扰SALL4在人Hu7 HCC细胞中动力学表达沉默。转染SALL4-ShRNA到两个独立的克隆体(分别标记为1#和2#)Hu7细胞中,载体作为对照,与Western Blot结果(图2A)均显示了SALL4表达的显著下调。根据菌落形成和大小进一步证明总菌落数都有明显下降,这表明细胞增殖和肿瘤发生了,同时2个克隆体中SALL4表达也显示下调了,见图2B、C。沉默SALL4后,Hu7细胞数量显著增加。

3 讨论
迄今为止,已有多种肿瘤标志物在HCC中被发现。研究表明,糖皮质激素-3免疫染色可用于鉴别非肝硬化肝细胞癌与腺瘤
,但虽具有较高的灵敏度,但在区分HCC和肝良性病变中效果较差
。此外,核染色β-连环素也被证实在鉴别高分化HCC的高危/非典型腺瘤具有积极意义
。本研究发现婆罗双树样基因-4(SALL4)蛋白可在HCC病例中呈阳性表达,而在良性肝脏病变中则为阴性或弱阳性,这说明SALL4是一种新的HCC生物标志物,并具有潜在的应用价值。
本研究证实了SALL4在临床中的诊断价值。同时结果还显示,SALL4在HCC的不同分级中均有发现,但其表达水平与HCC的分级无显著相关性,对SALL4表达水平与HCC分期进行相关性分析,其结果显示两者具有显著统计学相关性,这说明了SALL4在HCC诊断中具有较高的敏感度。本研究还证实了SALL4能明显抑制Hu7细胞增殖沉默,这与陈圆圆等
的研究成果有共同之处,SALL4基因沉默可能是癌症治疗的新靶点,可在化疗过程增加化疗的敏感度。基于这些研究结果,SALL4有望成为肝细胞癌的生物标志物和潜在的治疗新靶点。
SALL4是维持胚胎干细胞多潜能分化和自我更新的重要调控基因。研究显示,该基因突变常导致恶性肿瘤的发生,且SALL4基因在血液系统肿瘤中高表达,在肿瘤发生的信号通路中起着重要的调节作用
。同时,SALL4也被证实与白血病、卵巢癌、子宫内膜癌、胃癌、乳腺癌和肺癌等其他实体瘤都有着精密联系,这也说明研究SALL4具有非常重要的意义。本研究通过动态沉默ShRNA检测Hu7细胞SALL4表达,发现其可明显减少菌落形成和细胞生长,这进一步证实了SALL4在肝细胞癌发生中的重要作用。
[1] 陈小炎, 刘也夫.血清肿瘤标志物在原发性肝癌诊断中的研究进展[J].现代肿瘤医学, 2019, 27(9):168-172.
[2] Menesy AN, Ahmed NA, Elaraman MM,
.Golgi protein 73 versus serum α-fetoprotein as tumor markers for hepatocellular carcinoma in patients with hepatitis C cirrhosis[J].Egyp Liver J, 2018, 8(1):17-22.
[3] Williams AS, Shawwa A, Merrimen J,
.Expression of OCT4 and SALL4 in diffuse large B-cell lymphoma: an analysis of 145 consecutive cases and testicular lymphomas[J].Am J Surg Pathol, 2016, 40(7):950-957.
[4] 刘海荣,李岩.人类婆罗双树样基因-4研究进展[J].肿瘤研究与临床, 2016,28(7):497-501.
[5] 张鹏, 邵孟, 钱晖,等.SALL4在肿瘤中的作用及临床应用价值[J].临床检验杂志,2018,36(2):130-132.
[6] Ofuji K, Saito K, Nakamoto Y,
.Abstract 573: Glypican-3 is a predictive marker for recurrence of hepatocellular carcinoma after surgical resection, especially in early stage[J].Cancer Res, 2015, 75(15 Supplement):573-573.
[7] Geramizadeh B, Seirfar N.Diagnostic value of arginase-1 and glypican-3 in differential diagnosis of hepatocellular carcinoma,cholangiocarcinoma and metastatic carcinoma of liver[J].Hepat Mon, 2015, 15(7):e30336.
[8] Hale G,Liu X, Hu J,
.Correlation of exon 3|[beta]|-catenin mutations with glutamine synthetase staining patterns in hepatocellular adenoma and hepatocellular carcinoma[J].Mod Pathol, 2016, 29(11):1370-1380.
[9] 陈园园, 叶园园, 李至臻,等.SALL4基因沉默对MCF-7/A细胞增殖和化疗敏感性的影响[J].中国肿瘤, 2016,25(2):132-137.
[10] 王珏, 张惠洁.SALL4基因在人恶性肿瘤中的研究进展[J].实用肿瘤学杂志, 2016,30(5):99-102.
[11] Chan AL, La HM, Legrand JMD,
.Germline Stem Cell Activity Is Sustained by SALL4-Dependent Silencing of Distinct Tumor Suppressor Genes[J].Stem Cell Reports,2017,9(3):956-971.
