血清GP73联合肝硬度值对原发性肝癌患者根治性切除术后预后评估的价值*
2022-06-02何凤霞尚亚婷
原发性肝癌(PHC)在世界范围内发病率逐年上升。多数PHC患者确诊时已是中晚期,严重威胁患者生命健康
。目前手术切除是PHC患者主要治疗手段,但PHC术后易复发,患者预后不佳,肝切除术后5年复发率高达70%
。因此寻找有效的分子标志物,对患者术后进行监测,对于 PHC的治疗和预后评估具有重要意义。高尔基体糖蛋白 73(GP73)是一种表达于人类上皮细胞中的跨膜糖蛋白,在肝癌、胃癌等多种肿瘤中异常表达
。Zhang等
研究表明,GP73对肝癌的诊断与预后评估具有一定价值。研究表明,肝硬度检测(LSM)值与肝硬化程度相关,而肝硬化程度直接决定患者肝切除手术的难度、术中出血量的多少及其预后
。陈熙等
研究表明,LSM是肝癌患者肝切除术后发生并发症的独立危险因素。然而GP73与PHC患者根治性切除术后的预后相关性尚未见报道,LSM用于PHC患者根治性切除术后的预后报道相对较少。本研究通过检测PHC患者根治性切除术前血清GP73水平及LSM,探讨二者与PHC根治性切除术后预后的关系,现报道如下。
1 资料与方法
1.1 一般资料 选择2015年3月至2017年9月在我院就诊并进行根治性切除术治疗的PHC患者85例(PHC组),其中男49例,女36例;年龄35~78岁,平均(47.40±9.52)岁。另选取同期健康体检人员85例作为对照组,其中男45例,女40例;年龄34~76岁,平均(47.84±8.91)岁。两组患者一般资料比较,差异无统计学意义(均
>0.05)。本研究获得医院医学伦理委员会批准,患者或监护人均知情同意并自愿签署知情同意书。
1.2 纳入及排除标准 纳入标准:①诊断符合《原发性肝癌诊治规范(2011)》标准
;②经影像学诊断为PHC;③均进行根治性切除术治疗且均为首次治疗,术前均未行放疗、化疗;④临床病例资料完整。排除标准:①合并有其他恶性肿瘤患者;②转移性肝癌者;③合并免疫性疾病、血液系统疾病、急慢性肝炎或严重感染性疾病者。
1.3 研究方法
记得一个星期六的上午,我跟着妈妈去超市购物。妈妈总是有看不完物品,我的肚子都饿得咕咕叫起来了,在我多次向妈妈表达“我饿了”后,我们才从超市往回赶。半路上,我们经过新华书店,我请求妈妈陪我看会儿书。
1978年,改革开放的春风吹暖云岭大地,个体户的梦想在“万物生长”的时代沃土中发芽;40年后,树木成林,云南民营经济从无到有,从小到大,从弱到强,稳增长、促创新、增就业、助脱贫,成为推动经济社会发展不可或缺的重要力量,唱响一曲“春天的故事”。
1.4 统计学方法 采用SPSS 22.0进行统计学分析,计量资料以均数±标准差表示,多组间比较采用单因素方差分析,进一步两组间比较采用
-
检验;ROC曲线分析GP73、LSM对PHC患者术后复发的诊断价值,Kaplan-Meier分析PHC患者术后3年无进展生存率。
<0.05为差异有统计学意义。
1.3.2 ELISA法检测血清GP73水平 采用ELISA法检测血清GP73水平,检测仪器FAMIER-150型全自动酶联免疫分析仪,严格按照试剂盒说明书进行操作,检测试剂盒购于罗氏诊断产品(上海)有限公司。
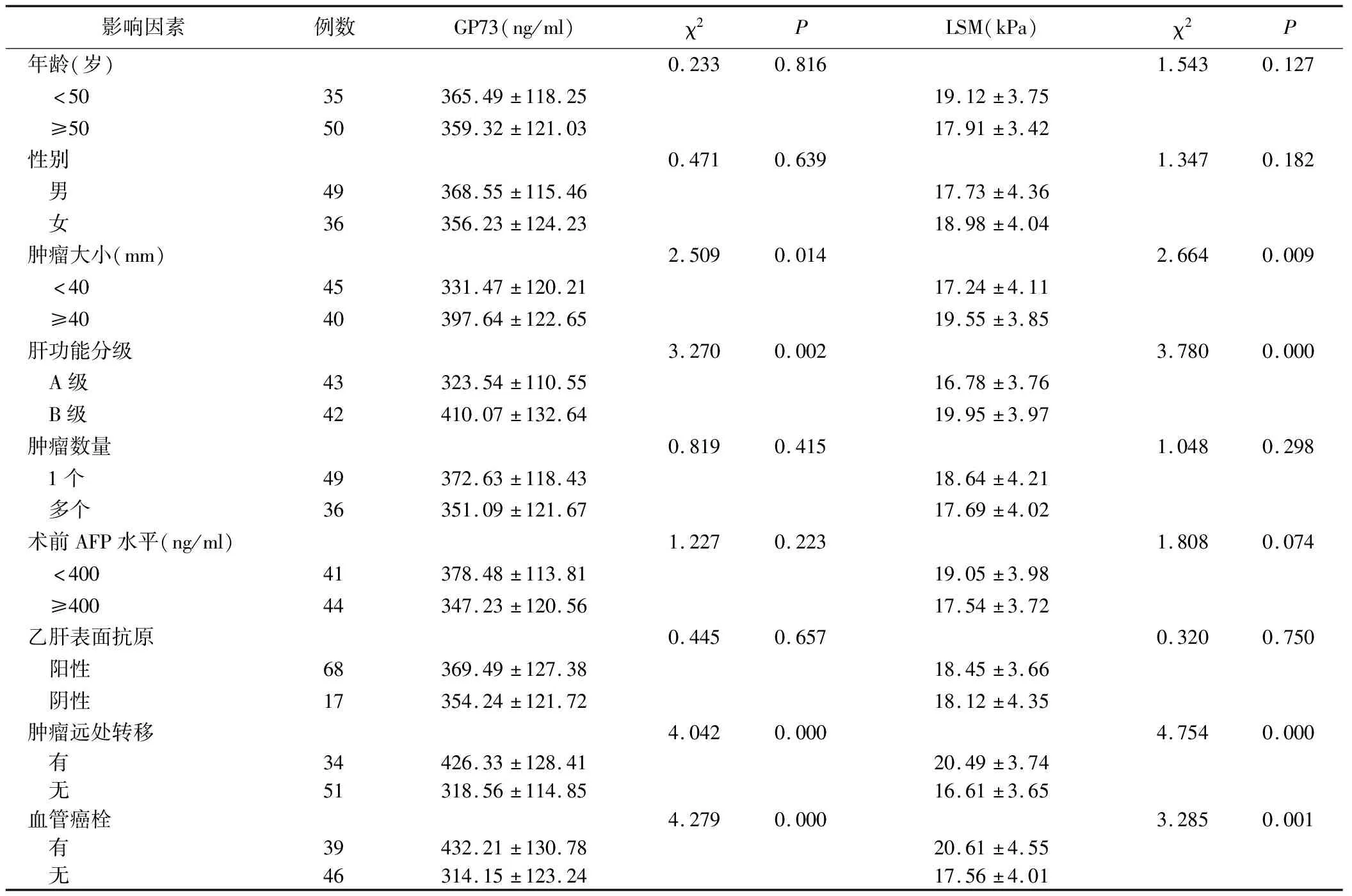
2.2 PHC患者GP73、LSM表达水平与临床病理特征关系 见表2。
1.3.1 LSM检测 采用法国ECHoSENS公司生产FibroScan 检测,具体检测方法参照用户手册。每位患者测定5次,取平均值。
2 结果
B1={{3,4},{3,5},{4,5}}; B2={{1,2,3},{1,2,4},{1,2,5}};
2.1 PHC患者根治性切除术前与对照组人员血清GP73、LSM水平变化情况 见表1。

1.3.3 治疗与随访 所有患者行肝癌根治性切除手术治疗,通过术后病理判断肿瘤分期、肿瘤直径、远处转移、血管癌栓状态等。根治性切除手术判断标准参考文献
。患者术后管理包括给予抗感染、保肝、维持内环境稳定、营养支持等。对所有患者进行术后3年随访,术后第1年每3个月复查1次,行超声、CT或MRI和血清 AFP检查,1年后每半年复查1次,根据复查情况行再次手术、射频等保守治疗。统计患者发生复发与无进展生存情况,复发包括单纯肝内肿瘤复发、远处转移和血管侵犯等。
我们在剪拼的过程中,为了保持原始图形的完整,希望不要剪得太碎,也就是希望剪裁后的碎片数不要太多.上述过程Ⅳ中,反复地剪裁小正方形,造成了非常多的碎片.下面介绍另外一种剪裁方法,可以大幅减少碎片的数量.
2.3 PHC患者血清GP73、LSM水平与根治性切除术后预后的关系 术后3年随访,其中48例患者发生复发转移,37例未发生复发转移。与未复发组患者比较,复发组患者血清GP73、LSM水平显著升高,差异有统计学意义(
<0.05),见表3。

2.4 血清GP73、LSM表达水平对术后复发的预测价值 血清GP73预测PHC术后复发的曲线下面积为0.835,截断值为341.96 mg/ml,敏感度为84.21%,特异性为77.08%。LSM预测PHC术后复发的曲线下面积为0.829,截断值为18.03 kPa,敏感度为78.95%,特异度为81.25%。血清GP73、LSM联合预测PHC术后复发的曲线下面积为0.925,敏感度为94.74%,特异度为77.08%。
2.5 GP73、LSM表达水平与患者总无进展生存的关系 以PHC患者血清GP73表达水平将PHC患者分为≥361.49 ng/ml组和<361.49 ng/ml组,根据LSM值将患者分为≥18.23 kPa组和<18.23 kPa组。通过Kaplan-Meier生存分析可知,血清GP73≥361.49 ng/ml组患者3年无进展生存率显著低于血清GP73<361.49 ng/ml患者(52.14%
81.83%,
<0.05);LSM≥18.23 kPa组患者3年无进展生存率显著低于LSM<18.23 kPa组患者(52.75%
80.06%,
<0.05)。见图1。

3 讨论
PHC因为发病隐匿、早期症状不典型,病情发展迅速,多数患者确诊时已至中晚期,失去最佳治疗机会,仅有20%~30%患者可进行手术切除。但肝癌细胞具有生长活跃、侵袭性强等特点,使得PHC患者术后复发率较高,严重影响远期疗效
。肝切除术后2年内肿瘤复发较多,血清甲胎蛋白常用于肝癌疗效与预后的判断,但是灵敏度与特异度均不高
。GP73是一种与肝细胞癌相关的糖蛋白,主要在胆管上皮细胞中,在正常肝细胞中不表达或很少表达,在病变的肝细胞中呈高水平表达,有研究表明,GP73作为潜在的肿瘤标志物在肝癌的早期诊断与疗效评判有重要价值
。但GP73在PHC患者手术后预后相关性尚不清楚,本研究显示GP73在PHC患者血清中表达水平升高,且在PHC根治性切除术后复发患者血清中水平较高,这可能与GP73具有促进肝细胞肝癌的上皮间质转化和转移有关
,表明血清GP73水平对PHC患者术后复发有一定预测价值。本研究结果显示血清GP73预测PHC术后复发敏感度为84.21%,但是特异性较低。
FibroScan为无创性诊断肝纤维化的新技术,LSM可作为PHC早期诊断与预后判断的指标,但是单独使用存在特异度低的缺点
,与其他指标联合检测具有更高诊断价值
。本研究结果显示,PHC患者LSM较对照组升高,且发生术后复发的患者LSM值较高,GP73、LSM联合预测PHC术后复发的曲线下面积为0.925,敏感度为94.74%,特异度为77.08%,表明GP73、LSM对PHC患者术后复发具有一定预测价值。另外,本研究结果发现,GP73、LSM与PHC肿瘤大小、肝功能分级、远处转移和血管癌栓有关,而这些因素是PHC患者手术切除术后复发的危险因素
,进一步证实GP73、LSM与PHC患者术后复发有关。Kaplan-Meier生存分析显示GP73、LSM水平与PHC患者根治性切除术后生存情况有关,提示临床上监测PHC患者术前血清 GP73水平及LSM变化,对PHC患者根治性切除术后预后判断具有重要的临床意义。
[1] Yuan P, Zhang Z, Kuai J.Analysis on efficacy and safety of TACE in combination with RFA and MWA in the treatment of middle and large primary hepatic carcinoma[J].J BUON, 2019, 24(1):163-170.
[2] 魏复群,罗柳平,梁东,等.Ki-67表达与原发性肝癌根治性切除术后行预防性肝动脉化疗栓塞患者预后的关系[J].中国普通外科杂志,2019,28(7):825-832.
[3] Association for the Study of the Liver.EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma[J].J Hepatol,2018,69(1):182-236.
[4] Chen LG, Wang HJ, Yao HB,
.GP73 is down-regulated in gastric cancer and associated with tumor differentiation[J].World J Surg Oncol,2013, 11(1):132-138.
[5] Zhang Y, Xi Y, Fang J,
.Identification and characterization of monoclonal antibodies against GP73 for use as a potential biomarker in liver cancer screening and diagnosis[J].J Immunoassay Immunochem,2016,37(4):390-406.
[6] Martin AN, Kerwin MJ, Turrentine FE,
.Blood transfusion is an independent predictor of morbidity and mortality after hepatectomy[J].J Surg Res,2016,206(1):106-112.
[7] 陈熙, 彭永海, 胡朝辉, 等.肝硬度值预测肝癌肝切除术后并发症的应用价值[J].中华消化外科杂志,2018,17(5):466-473.
[8] 中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版)[J].临床肿瘤学杂志,2011,16(10):71-88.
[9] Bray F, Ferlay J, Soerjomataram I,
.Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.
[10] Zhou F, Huang HZ, Zhou MT,
.Surgical treatment and chemotherapy of adult primary liver sarcoma: experiences from a single hospital in China[J].Dig Surg,2019,36(1):46-52.
[11] 周彬, 陆惠波, 侯凯哲.血清甲胎蛋白,甲胎蛋白异质体与肝癌患者的近期疗效和预后的关系及其诊断价值分析[J].国际消化病杂志,2020,40(1):67-70,74.
[12] Yao M, Wang L, Leung PSC,
.The clinical significance of GP73 in immunologically mediated chronic liver diseases: experimental data and literature review[J].Clin Rev Allergy Immunol, 2018,54(2):282-294.
[13] Ye JZ, Yan SM, Yuan CL,
.GP73 level determines chemotherapeutic resistance in human hepatocellular carcinoma cells[J].J Cancer,2018,9(2):415-423.
[14] Yang Y, Liu Q, Li Z,
.GP73 promotes epithelial-mesenchymal transition and invasion partly by activating TGF-β1/Smad2 signaling in hepatocellular carcinoma[J].Carcinogenesis,2018,39(7):900-910.
[15] 陈亮,刘东杰,周旭,等.剪切波弹性成像测量肝硬度值对肝癌患者肝切除术后预后评估[J].中国老年学杂志, 2020,40(10):2062-2065.
[16] 刘晓彦,马丽娜,雒夏,等.肝硬度联合血清超敏C反应蛋白检测在诊断乙肝肝硬化并发原发性肝癌中的价值[J].中华肿瘤杂志,2015,37(2):119-122.
[17] 乐琪,朱同恩,莫志远,等.原发性肝癌患者手术切除术后早期复发影响因素分析[J].中国普通外科杂志,2019,28(1):18-23.
